名校
1 . 以 作催化剂,可用乙烯脱除烟气中
作催化剂,可用乙烯脱除烟气中 并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的
并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的 ,实验装置(夹持装置已略)如图所示:
,实验装置(夹持装置已略)如图所示:
回答下列问题:
(1)装置a中的作用是___________ 。(答2点)
(2)装置b中有S、 、
、 生成,则发生反应的化学方程式为
生成,则发生反应的化学方程式为___________ 。
(3)装置c用冷水水浴的目的是___________ 。
(4)有同学认为可将溴水换成酸性高锰酸钾溶液,你认为是否可行,说明你的理由___________ 。
(5)装置e中品红溶液的作用是___________ 。
(6)为制作反应的催化剂,实验小组制备了一定质量含杂质 样品,为测定其中
样品,为测定其中 的质量分数,现进行如下实验:
的质量分数,现进行如下实验:
步骤1:称取0.4000g样品,向样品中加入足量稀硫酸和 ,得到含
,得到含 的溶液。
的溶液。
步骤2:向含 的溶液中加入过量NaOH后通入足量
的溶液中加入过量NaOH后通入足量 ,过滤得到
,过滤得到 沉淀。
沉淀。
步骤3:向沉淀中逐滴加入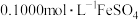 溶液,恰好完全反应时消耗
溶液,恰好完全反应时消耗 溶液20.00mL。(
溶液20.00mL。( 被还原为
被还原为 )
)
①步骤1中发生反应的离子方程式为___________ 。
②样品中 的质量分数为
的质量分数为___________ 。(保留4位有效数字)
 作催化剂,可用乙烯脱除烟气中
作催化剂,可用乙烯脱除烟气中 并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的
并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的 ,实验装置(夹持装置已略)如图所示:
,实验装置(夹持装置已略)如图所示: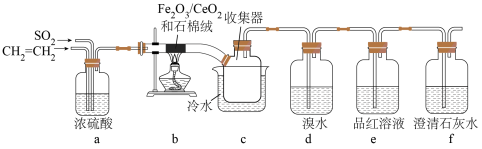
回答下列问题:
(1)装置a中的作用是
(2)装置b中有S、
 、
、 生成,则发生反应的化学方程式为
生成,则发生反应的化学方程式为(3)装置c用冷水水浴的目的是
(4)有同学认为可将溴水换成酸性高锰酸钾溶液,你认为是否可行,说明你的理由
(5)装置e中品红溶液的作用是
(6)为制作反应的催化剂,实验小组制备了一定质量含杂质
 样品,为测定其中
样品,为测定其中 的质量分数,现进行如下实验:
的质量分数,现进行如下实验:步骤1:称取0.4000g样品,向样品中加入足量稀硫酸和
 ,得到含
,得到含 的溶液。
的溶液。步骤2:向含
 的溶液中加入过量NaOH后通入足量
的溶液中加入过量NaOH后通入足量 ,过滤得到
,过滤得到 沉淀。
沉淀。步骤3:向沉淀中逐滴加入
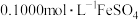 溶液,恰好完全反应时消耗
溶液,恰好完全反应时消耗 溶液20.00mL。(
溶液20.00mL。( 被还原为
被还原为 )
)①步骤1中发生反应的离子方程式为
②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-06-01更新
|
156次组卷
|
3卷引用:湖北省新高考协作体2022-2023学年高一下学期5月联考化学试题
2 . 某实验室保存过氧化钠时方法不当导致过氧化钠试剂结块,表面为白色,将块状物敲开,内部呈现淡黄色。
(1)将该实验室过氧化钠药品用铝箔包裹(铝箔上用针扎出许多小孔)放入水中反应,写出其中产生气体的成分是_____ (填化学式)。
(2)甲组同学为测定制得的Na2O2样品的纯度,设计装置如图:
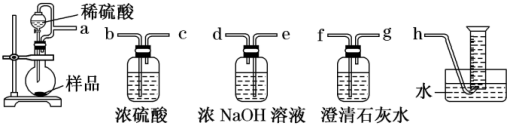
分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果_____ (填“偏大”“偏小”或“无影响”)。测定装置的接口从左至右正确的连接顺序是_____ 。
(3)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果_____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如表所示:
在上述实验中,能够证明乙组分析正确的最佳方案是_____ (填实验序号)。根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是_____ 。
(4)丙组根据上述提供的有关信息:称取一定质量的样品(m克),加入少量MnO2固体,再用甲组同学设计的装置测定常温常压下生成O2体积,并换算成标准状况下氧气的体积为VL,计算该药品中过氧化钠的纯度为:_____ (不必化简)。
(1)将该实验室过氧化钠药品用铝箔包裹(铝箔上用针扎出许多小孔)放入水中反应,写出其中产生气体的成分是
(2)甲组同学为测定制得的Na2O2样品的纯度,设计装置如图:

分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果
(3)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果
| 实验方案 | 产生的现象 |
| I.取烧瓶中的反应液加入少量MnO2粉末 | 有大量气泡逸出 |
| II.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| III.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液先变红后褪色 |
(4)丙组根据上述提供的有关信息:称取一定质量的样品(m克),加入少量MnO2固体,再用甲组同学设计的装置测定常温常压下生成O2体积,并换算成标准状况下氧气的体积为VL,计算该药品中过氧化钠的纯度为:
您最近一年使用:0次
名校
解题方法
3 . 无水FeCl3是芳香烃取代反应常用的催化剂,它具有易水解、易升华的性质。某同学用5.60g干燥铁粉制得13.00g无水FeCl3样品,实验装置如图所示。下列说法正确的是
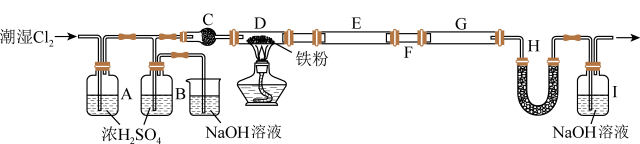

| A.该实验中FeCl3的产率为60% |
| B.装置C、H中的药品可以都为P2O5 |
| C.装置B用于干燥氯气,装置E和G用于收集产物 |
| D.可用K4[Fe(CN)6]溶液检验FeCl3产品中是否存在FeCl2 |
您最近一年使用:0次
2023-04-04更新
|
1836次组卷
|
10卷引用:湖北省圆创2023届高三3月联合测评化学试题
湖北省圆创2023届高三3月联合测评化学试题湖北省武汉市圆创联考2023届高三3月质检化学试题(已下线)T13-化学实验基础湖北省名校联盟2023届高三3月联合测评化学试题(已下线)选择题11-15(已下线)化学-2023年高考押题预测卷03(云南,安徽,黑龙江,山西,吉林五省通用)(含考试版、全解全析、参考答案、答题卡)(已下线)题型35 微型成套装置实验流程四川省成都市双流棠湖中学2023-2024学年高三上学期11月期中考试化学试题甘肃省天水市第一中学 第三中学联考2023-2024学年高三上学期第三次月考 化学试题(已下线)热点19 化学微型实验
名校
4 . 钴及其化合物在化工生产中有重要的用途。三氯化六氨合钴(Ⅲ)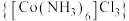 是黄色或橙黄色晶体,实验室以
是黄色或橙黄色晶体,实验室以 为原料经催化制备
为原料经催化制备 ,步骤如下:
,步骤如下:
I. 的制备
的制备
 可以通过钴和氯气反应制得,实验室制备纯净
可以通过钴和氯气反应制得,实验室制备纯净 可用如图实验装置(已知:
可用如图实验装置(已知: 易潮解)。
易潮解)。
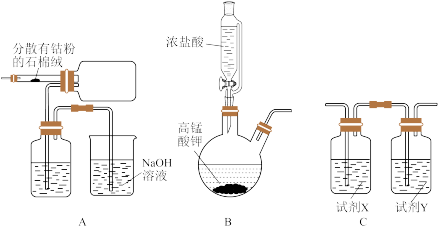
(1)B装置用于制备氯气,其反应的化学方程式为_______ 。A装置中洗气瓶内所装试剂的名称为_______ 。
(2)组装好仪器进行实验时,要先加入浓盐酸,使B装置中开始生成氯气,待A装置内充满黄绿色气体,再加热A装置中的钴粉,目的是_______ 。
II.三氯化六氨合钴(Ⅲ)的制备。其原理为:
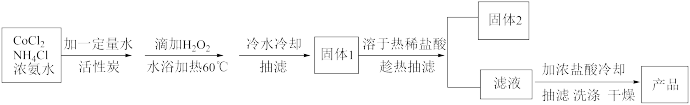
已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
(3)水浴温度不超过60℃的原因是_______ 。
(4)下列说法不正确的是_______(填标号)。
III.晶体结构测定与钴含量分析。
(5)测定晶体结构最常见的仪器是_______ ,从而获取晶胞形状和大小、分子或原子在微观空间的有序排列。 中心离子采取
中心离子采取 杂化,其空间结构为
杂化,其空间结构为_______ 。
(6)利用 将KI氧化成
将KI氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用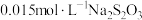 标准溶液滴定生成的
标准溶液滴定生成的 ,
, 所得产物为
所得产物为 。若称取样品的质量为0.295g,滴定
。若称取样品的质量为0.295g,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为54.00mL。该样品中钴元素的质量分数为
标准溶液的平均体积为54.00mL。该样品中钴元素的质量分数为_______ %。
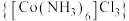 是黄色或橙黄色晶体,实验室以
是黄色或橙黄色晶体,实验室以 为原料经催化制备
为原料经催化制备 ,步骤如下:
,步骤如下:I.
 的制备
的制备 可以通过钴和氯气反应制得,实验室制备纯净
可以通过钴和氯气反应制得,实验室制备纯净 可用如图实验装置(已知:
可用如图实验装置(已知: 易潮解)。
易潮解)。
(1)B装置用于制备氯气,其反应的化学方程式为
(2)组装好仪器进行实验时,要先加入浓盐酸,使B装置中开始生成氯气,待A装置内充满黄绿色气体,再加热A装置中的钴粉,目的是
II.三氯化六氨合钴(Ⅲ)的制备。其原理为:

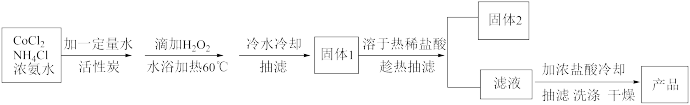
已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
(3)水浴温度不超过60℃的原因是
(4)下列说法不正确的是_______(填标号)。
A. 除作为反应物外,还有调节溶液的pH、增强 除作为反应物外,还有调节溶液的pH、增强 的氧化性的作用 的氧化性的作用 |
| B.活性炭是脱色剂、固体2是活性炭 |
C.加入浓盐酸,析出产品的反应方程式为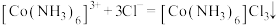 |
| D.可用乙醇水溶液洗涤产品 |
III.晶体结构测定与钴含量分析。
(5)测定晶体结构最常见的仪器是
 中心离子采取
中心离子采取 杂化,其空间结构为
杂化,其空间结构为(6)利用
 将KI氧化成
将KI氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用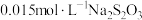 标准溶液滴定生成的
标准溶液滴定生成的 ,
, 所得产物为
所得产物为 。若称取样品的质量为0.295g,滴定
。若称取样品的质量为0.295g,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为54.00mL。该样品中钴元素的质量分数为
标准溶液的平均体积为54.00mL。该样品中钴元素的质量分数为
您最近一年使用:0次
2022-12-16更新
|
603次组卷
|
3卷引用:湖北省武汉市第六中学2023-2024学年高三上学期第二次月考化学试题
名校
解题方法
5 . 碱式碳酸铜[Cu2(OH)2CO3](Mr=222)是一种草绿色晶体,可用于铜盐、油漆和烟花的制备。实验室制备碱式碳酸铜的步骤如下:
I.分别配制0.50mol∙L-1CuSO4溶液和0.50mol∙L-1Na2CO3溶液。
II.将30mLCuSO4溶液和36mL Na2CO3溶液混合、搅拌均匀。
III.将II的混合溶液加热至75℃,搅拌15min。
IV.静置使产物沉淀完全后,抽滤、洗涤、干燥、称重,分析样品组成和晶体结构。
回答下列问题:
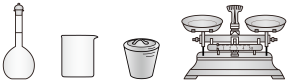
(1)步骤I中,配制0.50mol∙L-1CuSO4溶液时,不需要使用下列仪器中的_______ (填仪器名称)。
(2)步骤II中,若误将CuSO4溶液与Na2CO3溶液等体积混合,二者恰好完全反应,生成蓝色的Cu4(SO4)(OH)6∙2H2O晶体,其反应的离子方程式为_______ 。
(3)步骤III中,若温度高于90℃,产品中混有的黑色固体是_______ 。
(4)步骤IV中,检验沉淀是否洗涤干净的试剂是_______ ;称得产品的质量为1.332g,则该实验所得碱式碳酸铜的产率是_______ 。
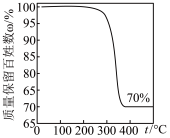
(5)对样品进行热重分析得到的曲线如下图所示,则铜元素的质量分数是_______ ,与理论值相差不大。使用_______ 实验可进一步测定样品的晶体结构。
I.分别配制0.50mol∙L-1CuSO4溶液和0.50mol∙L-1Na2CO3溶液。
II.将30mLCuSO4溶液和36mL Na2CO3溶液混合、搅拌均匀。
III.将II的混合溶液加热至75℃,搅拌15min。
IV.静置使产物沉淀完全后,抽滤、洗涤、干燥、称重,分析样品组成和晶体结构。
回答下列问题:
(1)步骤I中,配制0.50mol∙L-1CuSO4溶液时,不需要使用下列仪器中的

(2)步骤II中,若误将CuSO4溶液与Na2CO3溶液等体积混合,二者恰好完全反应,生成蓝色的Cu4(SO4)(OH)6∙2H2O晶体,其反应的离子方程式为
(3)步骤III中,若温度高于90℃,产品中混有的黑色固体是
(4)步骤IV中,检验沉淀是否洗涤干净的试剂是
(5)对样品进行热重分析得到的曲线如下图所示,则铜元素的质量分数是

您最近一年使用:0次
2022-09-17更新
|
501次组卷
|
3卷引用:湖北省武汉市部分学校2022-2023学年高三上学期9月调研考试化学试题
名校
解题方法
6 . 亚硝酰氯( ,沸点:
,沸点: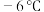 ;易水解,能与
;易水解,能与 反应)可作为有机合成试剂。在实验室可用
反应)可作为有机合成试剂。在实验室可用 (沸点:
(沸点: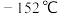 )和
)和 (沸点:
(沸点: )在一定条件下反应制备,其反应原理为
)在一定条件下反应制备,其反应原理为 。回答下列问题:
。回答下列问题:
(1)实验室常用铜与稀硝酸反应制备 ,若将
,若将 加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则
加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则 物质的量浓度为
物质的量浓度为___________ ;研究表明, 和
和 溶液在稀
溶液在稀 中反应也可制得
中反应也可制得 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)实验室若以 和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的
和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的 ,则其连接顺序为
,则其连接顺序为___________ →jh(按气流方向,用小写字母表示)。
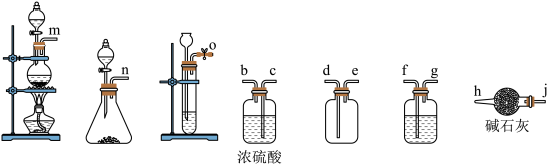
(3) 的制备,装置(夹持仪器已省略)如下图所示。
的制备,装置(夹持仪器已省略)如下图所示。

①将催化剂负载在玻璃棉上的目的是___________ 。
②为分离产物和未反应的原料,低温浴槽A的温度区间应控制在___________ (填字母)。
A.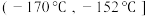 B.
B.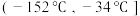 C.
C.
③仪器C中收集的物质是___________ (填化学式)。
(4) 样品中
样品中 的质量分数测定。取
的质量分数测定。取
 样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用
样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用 的
的 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。 的质量分数为
的质量分数为___________ 。
 ,沸点:
,沸点: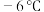 ;易水解,能与
;易水解,能与 反应)可作为有机合成试剂。在实验室可用
反应)可作为有机合成试剂。在实验室可用 (沸点:
(沸点: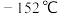 )和
)和 (沸点:
(沸点: )在一定条件下反应制备,其反应原理为
)在一定条件下反应制备,其反应原理为 。回答下列问题:
。回答下列问题:(1)实验室常用铜与稀硝酸反应制备
 ,若将
,若将 加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则
加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则 物质的量浓度为
物质的量浓度为 和
和 溶液在稀
溶液在稀 中反应也可制得
中反应也可制得 ,该反应的离子方程式为
,该反应的离子方程式为(2)实验室若以
 和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的
和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的 ,则其连接顺序为
,则其连接顺序为
(3)
 的制备,装置(夹持仪器已省略)如下图所示。
的制备,装置(夹持仪器已省略)如下图所示。
①将催化剂负载在玻璃棉上的目的是
②为分离产物和未反应的原料,低温浴槽A的温度区间应控制在
A.
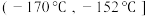 B.
B.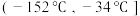 C.
C.
③仪器C中收集的物质是
(4)
 样品中
样品中 的质量分数测定。取
的质量分数测定。取
 样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用
样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用 的
的 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
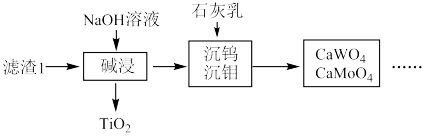
7 . 从烟气脱硝催化剂(含 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。
(1)粉碎的目的是_______ ,滤渣1的成分为_______ 。
(2)若酸浸还原产物为 ,其中V的化合价是
,其中V的化合价是_______ 。用 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式_______ 。
(3)写出“富集氧化”过程的化学方程式_______ ,若用 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
_______ mol。
(4)可用 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为_______ %。(保留1位小数)
(5) 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。________ 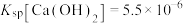 ,
,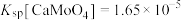 ,且
,且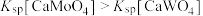 。
。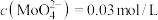 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为_______ 时开始产生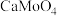 沉淀。
沉淀。
 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。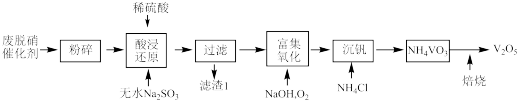
(1)粉碎的目的是
(2)若酸浸还原产物为
 ,其中V的化合价是
,其中V的化合价是 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式(3)写出“富集氧化”过程的化学方程式
 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
(4)可用
 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为(5)
 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。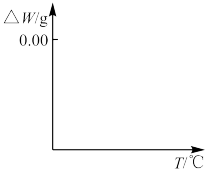
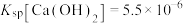 ,
,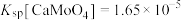 ,且
,且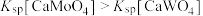 。
。
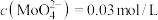 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为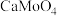 沉淀。
沉淀。
您最近一年使用:0次
2023-02-24更新
|
822次组卷
|
4卷引用:湖北省华中师范大学第一附属中学等高考联盟2023届高三下学期2月联考化学试题
名校
8 . Ⅰ.现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:
(1)如图表示0.25 盐酸标准液第二次滴定前后50
盐酸标准液第二次滴定前后50 滴定管中液面的位置,该次滴定所用标准盐酸体积为
滴定管中液面的位置,该次滴定所用标准盐酸体积为_______  。
。

(2)现实验室中有石蕊和甲基橙两种指示剂,该实验应选用_______ 作指示剂。
(3)根据所给数据,该烧碱样品的物质的量浓度为_______  (保留两位有效数字)。
(保留两位有效数字)。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______。
Ⅱ.某研究小组为测定软锰矿中 的质量分数,实验步骤如下:准确称取0.5000g软锰矿样品,加入1.34g
的质量分数,实验步骤如下:准确称取0.5000g软锰矿样品,加入1.34g 再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到250
再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到250 容量瓶中并定容。取出25.00
容量瓶中并定容。取出25.00 待测液置于锥形瓶中,再用0.0100
待测液置于锥形瓶中,再用0.0100
 标准溶液进行滴定,当滴入20.00
标准溶液进行滴定,当滴入20.00
 溶液时恰好完全反应。(已知
溶液时恰好完全反应。(已知 、
、 在酸性条件下均能将
在酸性条件下均能将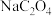 氧化,且还原产物均为
氧化,且还原产物均为 。)
。)
(5)酸化 溶液可选用的酸是
溶液可选用的酸是_______ , 标准溶液应置于
标准溶液应置于_______ (填“酸式”或“碱式”)滴定管中。
(6) 和
和 在酸性条件下反应的离子方程式为
在酸性条件下反应的离子方程式为_______ 。
(7)到达滴定终点的实验现象是_______ 。
(8)根据实验数据计算,软锰矿中 的质量分数为
的质量分数为_______ %。
| 滴定序号 | 待测液体积( ) ) | 所消耗盐酸标准液的体积( ) ) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 | |||
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |
 盐酸标准液第二次滴定前后50
盐酸标准液第二次滴定前后50 滴定管中液面的位置,该次滴定所用标准盐酸体积为
滴定管中液面的位置,该次滴定所用标准盐酸体积为 。
。
(2)现实验室中有石蕊和甲基橙两种指示剂,该实验应选用
(3)根据所给数据,该烧碱样品的物质的量浓度为
 (保留两位有效数字)。
(保留两位有效数字)。(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.读取盐酸体积时,滴定结束时俯视读数 |
| D.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
Ⅱ.某研究小组为测定软锰矿中
 的质量分数,实验步骤如下:准确称取0.5000g软锰矿样品,加入1.34g
的质量分数,实验步骤如下:准确称取0.5000g软锰矿样品,加入1.34g 再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到250
再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到250 容量瓶中并定容。取出25.00
容量瓶中并定容。取出25.00 待测液置于锥形瓶中,再用0.0100
待测液置于锥形瓶中,再用0.0100
 标准溶液进行滴定,当滴入20.00
标准溶液进行滴定,当滴入20.00
 溶液时恰好完全反应。(已知
溶液时恰好完全反应。(已知 、
、 在酸性条件下均能将
在酸性条件下均能将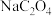 氧化,且还原产物均为
氧化,且还原产物均为 。)
。)(5)酸化
 溶液可选用的酸是
溶液可选用的酸是 标准溶液应置于
标准溶液应置于(6)
 和
和 在酸性条件下反应的离子方程式为
在酸性条件下反应的离子方程式为(7)到达滴定终点的实验现象是
(8)根据实验数据计算,软锰矿中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
9 . 草酸亚铁是一种重要化工原料,可作为合成锂离子电池正极材料磷酸亚铁锂的原材料。以硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O] 制备草酸亚铁晶体(FeC2O4·nH2O)及相关实验如下。

Ⅰ.制备
用托盘天平称取18.0 g硫酸亚铁铵于400mL烧杯中,加入90mL水、6mL 2 mol ·L-1硫酸,加热溶解。将此溶液转移至三口烧瓶中,通过装置a向三口烧瓶中滴入40mL3mol ·L-1 H2C2O4溶液。将溶液加热至沸,不断搅拌,以免暴沸,有黄色沉淀析出。将混合液过滤,充分洗涤沉淀,再用丙酮洗涤固体产品两遍,抽干并晾干,称量。
(1)装置a的名称为_______ ,装置b的作用是_______ 。
(2)三口烧瓶的最适宜容积为_______ mL(填“150”、“250”或“500”)。
(3)制备草酸亚铁的反应离子方程式为_______ 。
(4)为提高过滤速度,可采用的操作是_______ ;已知草酸亚铁的溶解度在冷水中为0.022g/100g,热水中为0.023g/100g,则洗去沉淀表面的易溶性杂质时采用_______ 洗涤效果更好(填“冷水”或“热水”)。
Ⅱ.产品分析
(a)产物的定性试验
取0.5g草酸亚铁样品,用2 mol ·L-1硫酸溶解,配成5mL水溶液。
Fe3+的检验:取一滴溶液于点滴板上,_______,说明有Fe3+存在。
Fe2+的检验:取少量样品溶液,滴入酸性KMnO4溶液。
(b)产物的组成测定
准确称取样品0.1440 g于250mL锥形瓶内,加入25mL 2 mol ·L-1硫酸使样品溶解,用浓度为0.02 mol·L-1高锰酸钾标准溶液滴定,消耗溶液V1。然后向此溶液中加入2 g锌粉和5mL2 mol·L-1硫酸,煮沸溶液5~8min,用NH4SCN溶液在点滴板上检验一滴溶液,如溶液不出现红色,进行下一步滴定。将溶液过滤至另一个锥形瓶内,用10 mL 2 mol·L-1硫酸冲洗残余的锌(无铁单质)和锥形瓶2~3次,将洗涤液并入滤液内,用高锰酸钾溶液继续滴定至终点,记下体积为V2。
(5)将检验方案补充完整:_______ 。检验Fe2+时,若观察到紫红色褪去,_______ (填“能”或“不能”)说明样品中存在Fe2+。
(6)第一次滴定时发生反应的离子方程式为_______ 。
(7)若V1=23.35mL,V2=8.00mL,则n=_______ ;若进行第二次滴定前,用NH4SCN溶液检验时出现红色,则测得的n值_______ (填“偏大”“偏小”或“无影响”)。

Ⅰ.制备
用托盘天平称取18.0 g硫酸亚铁铵于400mL烧杯中,加入90mL水、6mL 2 mol ·L-1硫酸,加热溶解。将此溶液转移至三口烧瓶中,通过装置a向三口烧瓶中滴入40mL3mol ·L-1 H2C2O4溶液。将溶液加热至沸,不断搅拌,以免暴沸,有黄色沉淀析出。将混合液过滤,充分洗涤沉淀,再用丙酮洗涤固体产品两遍,抽干并晾干,称量。
(1)装置a的名称为
(2)三口烧瓶的最适宜容积为
(3)制备草酸亚铁的反应离子方程式为
(4)为提高过滤速度,可采用的操作是
Ⅱ.产品分析
(a)产物的定性试验
取0.5g草酸亚铁样品,用2 mol ·L-1硫酸溶解,配成5mL水溶液。
Fe3+的检验:取一滴溶液于点滴板上,_______,说明有Fe3+存在。
Fe2+的检验:取少量样品溶液,滴入酸性KMnO4溶液。
(b)产物的组成测定
准确称取样品0.1440 g于250mL锥形瓶内,加入25mL 2 mol ·L-1硫酸使样品溶解,用浓度为0.02 mol·L-1高锰酸钾标准溶液滴定,消耗溶液V1。然后向此溶液中加入2 g锌粉和5mL2 mol·L-1硫酸,煮沸溶液5~8min,用NH4SCN溶液在点滴板上检验一滴溶液,如溶液不出现红色,进行下一步滴定。将溶液过滤至另一个锥形瓶内,用10 mL 2 mol·L-1硫酸冲洗残余的锌(无铁单质)和锥形瓶2~3次,将洗涤液并入滤液内,用高锰酸钾溶液继续滴定至终点,记下体积为V2。
(5)将检验方案补充完整:
(6)第一次滴定时发生反应的离子方程式为
(7)若V1=23.35mL,V2=8.00mL,则n=
您最近一年使用:0次
10 . 氯化铁和高铁酸钾都是常见的水处理剂。下图为制备高铁酸钾的工艺流程。
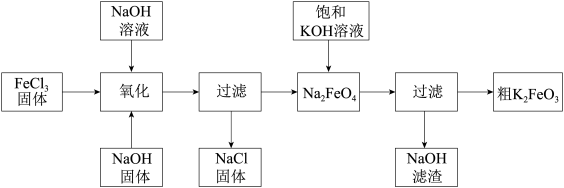
已知高铁酸钾(K2FeO4) 为暗紫色固体,可溶于水,干燥的高铁酸钾在常温下可以在空气中长期稳定存在,198℃以上分解为氧化铁,但含水的高铁酸酸钾或高铁酸钾溶液热稳定性明显下降,80 ℃以上时迅速分解为Fe(OH)3。请回答下列问题:
(1)FeCl3做净水剂的原理(用离子方程式表示)_______ 。
(2)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3沉淀,请补充并配平该反应方程式:_______ _______K2FeO4+_______ H2O =_______Fe(OH)3↓+_______ KOH+_______
(3)下图是1mol/LK2FeO4溶液在不同pH环境中 浓度随时间变化的曲线图:
浓度随时间变化的曲线图:
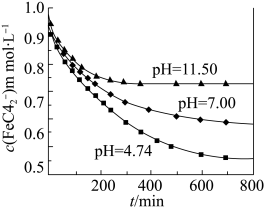
①K2FeO4固体如何保存:_______
②K2FeO4溶液如何配制:_______
(4)化学上,人们常用“标准电极电势”衡量物质氧化性和还原性的强弱,“标准 电极电势”正值数值越大,氧化性越强,负值数值越负,还原性越强。
①请对三个强氧化剂在不同环境下的氧化性强弱排序;_______ ;_______ 。
②写出高铁酸钾在弱酸性环境下将Mn2+氧化生成MnO2并生成Fe(OH)3胶体的离子方程式_______
(5)可用滴定分析法测定粗K2FeO4的纯度,有关离子方程式为
① +
+ +2H2O=
+2H2O= +Fe(OH)3↓+OH-
+Fe(OH)3↓+OH-
②2 +2H+=
+2H+= +H2O
+H2O
⑥ +6Fe2++14H+ =2Cr3++6Fe3++7H2O
+6Fe2++14H+ =2Cr3++6Fe3++7H2O
现称取1.980g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250mL容量瓶中。每次取25.00mL加入稀硫酸酸化,用0.1000mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93mL。则上述样品中高铁酸钾的质量分数为_______ 。

已知高铁酸钾(K2FeO4) 为暗紫色固体,可溶于水,干燥的高铁酸钾在常温下可以在空气中长期稳定存在,198℃以上分解为氧化铁,但含水的高铁酸酸钾或高铁酸钾溶液热稳定性明显下降,80 ℃以上时迅速分解为Fe(OH)3。请回答下列问题:
(1)FeCl3做净水剂的原理(用离子方程式表示)
(2)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3沉淀,请补充并配平该反应方程式:
(3)下图是1mol/LK2FeO4溶液在不同pH环境中
 浓度随时间变化的曲线图:
浓度随时间变化的曲线图:
①K2FeO4固体如何保存:
②K2FeO4溶液如何配制:
(4)化学上,人们常用“标准电极电势”衡量物质氧化性和还原性的强弱,“标准 电极电势”正值数值越大,氧化性越强,负值数值越负,还原性越强。
| 氧化剂/还原产物 | 标准电极电势(酸性,298K, 1mol/L) | 氧化剂/还原产物 | 标准电极电势(碱性,298K,1mol/L) |
 /Fe3+ /Fe3+ | 2.20V |  /Fe(OH)3 /Fe(OH)3 | 0.72V |
 /Mn2+ /Mn2+ | 1.51V |  /MnO2 /MnO2 | 0.60V |
| HClO/Cl- | 1.63V | ClO-/Cl- | 0.89V |
①请对三个强氧化剂在不同环境下的氧化性强弱排序;
②写出高铁酸钾在弱酸性环境下将Mn2+氧化生成MnO2并生成Fe(OH)3胶体的离子方程式
(5)可用滴定分析法测定粗K2FeO4的纯度,有关离子方程式为
①
 +
+ +2H2O=
+2H2O= +Fe(OH)3↓+OH-
+Fe(OH)3↓+OH-②2
 +2H+=
+2H+= +H2O
+H2O⑥
 +6Fe2++14H+ =2Cr3++6Fe3++7H2O
+6Fe2++14H+ =2Cr3++6Fe3++7H2O现称取1.980g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250mL容量瓶中。每次取25.00mL加入稀硫酸酸化,用0.1000mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93mL。则上述样品中高铁酸钾的质量分数为
您最近一年使用:0次



