1 . 化学与生产、生活息息相关。请回答下列问题:
(1)小苏打是常用的食品添加剂,烘焙面包时可用它做膨松剂,还可以调节酸度,写出调领闹节酸度时的离子反应方程式__________ 。
(2)汽车尾气的主要成分是CO和NO,加入适当催化剂,可使两者反应生成 和另种无毒的气体,写出反应的化学方程式
和另种无毒的气体,写出反应的化学方程式__________ ,做还原剂的是__________ 。
(3)工业上常用稀盐酸清洗锅炉内壁的水垢(主要成份是碳酸钙和氢氧化镁),请写出反应的离子方程式__________ (写出一个即可)。
(4)工业废水中含有的重铬酸根离子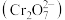 有毒,必须处理达标后才能排放。工业上常用绿矾
有毒,必须处理达标后才能排放。工业上常用绿矾 做处理剂,反应的离子方程式如下:
做处理剂,反应的离子方程式如下:
该离子方程式中的X应为__________ (填微粒符号),当反应转移了 电子时,生成
电子时,生成 的物质的量为
的物质的量为__________ (保留两位有效数字)。
(1)小苏打是常用的食品添加剂,烘焙面包时可用它做膨松剂,还可以调节酸度,写出调领闹节酸度时的离子反应方程式
(2)汽车尾气的主要成分是CO和NO,加入适当催化剂,可使两者反应生成
 和另种无毒的气体,写出反应的化学方程式
和另种无毒的气体,写出反应的化学方程式(3)工业上常用稀盐酸清洗锅炉内壁的水垢(主要成份是碳酸钙和氢氧化镁),请写出反应的离子方程式
(4)工业废水中含有的重铬酸根离子
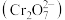 有毒,必须处理达标后才能排放。工业上常用绿矾
有毒,必须处理达标后才能排放。工业上常用绿矾 做处理剂,反应的离子方程式如下:
做处理剂,反应的离子方程式如下:
该离子方程式中的X应为
 电子时,生成
电子时,生成 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 实验室用下列方法均可制取氯气:
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②NaClO+2HCl=NaCl+Cl2↑+H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若各反应转移的电子数相同,则①、②、③生成的氯气质量之比为
①MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O②NaClO+2HCl=NaCl+Cl2↑+H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若各反应转移的电子数相同,则①、②、③生成的氯气质量之比为
| A.1:1:1 | B.2:1:2 | C.1:2:1 | D.1:1:5 |
您最近一年使用:0次
3 . 氮及其化合物是重要的化工原料。回答下列问题:
(1)利用如图所示装置及药品制取氨气。

①A中制取氨气的化学方程式为___________ 。
②C为方框内氨气的收集装置,则a应与___________ (填“b”或“c”)相连。
③证明氨气已集满的操作和现象是___________ 。
(2)若观察到装置D中的烧瓶内产生了红色喷泉。则说明氨气具有的性质是___________ 。
(3)氨经催化氧化可制备硝酸,氨催化氧化的化学方程式为___________ 。
(4) 可用碱液吸收:
可用碱液吸收: (未配平),已知M是一种盐,且在生
(未配平),已知M是一种盐,且在生
成物中M与 的物质的量比为1∶1.则M的化学式为
的物质的量比为1∶1.则M的化学式为___________ 。
(5)NO可在一定条件下,用氨气还原成可直接排入空气中的无毒气体,此反应中氧化剂和还原剂的物质的量之比___________
(1)利用如图所示装置及药品制取氨气。

①A中制取氨气的化学方程式为
②C为方框内氨气的收集装置,则a应与
③证明氨气已集满的操作和现象是
(2)若观察到装置D中的烧瓶内产生了红色喷泉。则说明氨气具有的性质是
(3)氨经催化氧化可制备硝酸,氨催化氧化的化学方程式为
(4)
 可用碱液吸收:
可用碱液吸收: (未配平),已知M是一种盐,且在生
(未配平),已知M是一种盐,且在生成物中M与
 的物质的量比为1∶1.则M的化学式为
的物质的量比为1∶1.则M的化学式为(5)NO可在一定条件下,用氨气还原成可直接排入空气中的无毒气体,此反应中氧化剂和还原剂的物质的量之比
您最近一年使用:0次
名校
解题方法
4 . 在实验室中用二氧化锰与浓盐酸在加热条件下反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示:

(1)连接上述仪器的正确顺序(填各接口处的字母):E接______;_______接______;_____接_____;_____接F。
(2)气体发生装置中进行反应的化学方程式:___________ ,在该反应中,氧化剂与还原剂的物质的量之比是_____ ;若在反应中生成了标况下2.24L氯气,则电子转移的个数是____  ;NaOH溶液中发生反应的离子方程式:
;NaOH溶液中发生反应的离子方程式:_____ 。
(3)装置中,饱和食盐水的作用是________ ;浓硫酸的作用是_______ 。
(4)化学实验中常用湿润的淀粉KI试纸检验是否有 产生。如果有
产生。如果有 产生,可观察到
产生,可观察到_______ ,反应化学方程式为_____ 。
(5)工业上氯气和石灰乳反应可以制取漂白粉,家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是______ 。
A.盐 B.食醋 C.烧碱 D.纯碱
该反应放热会使体系温度升高,导致氯气和石灰浆发生副反应产生杂质 ,该副反应中还原剂与氧化剂的质量之比为
,该副反应中还原剂与氧化剂的质量之比为_____ 。

(1)连接上述仪器的正确顺序(填各接口处的字母):E接______;_______接______;_____接_____;_____接F。
(2)气体发生装置中进行反应的化学方程式:
 ;NaOH溶液中发生反应的离子方程式:
;NaOH溶液中发生反应的离子方程式:(3)装置中,饱和食盐水的作用是
(4)化学实验中常用湿润的淀粉KI试纸检验是否有
 产生。如果有
产生。如果有 产生,可观察到
产生,可观察到(5)工业上氯气和石灰乳反应可以制取漂白粉,家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是
A.盐 B.食醋 C.烧碱 D.纯碱
该反应放热会使体系温度升高,导致氯气和石灰浆发生副反应产生杂质
 ,该副反应中还原剂与氧化剂的质量之比为
,该副反应中还原剂与氧化剂的质量之比为
您最近一年使用:0次
名校
5 . 设 NA为阿伏加德罗常数的值。下列有关叙述正确的是
| A.2.24L 的 H2O 溶液中,含有氧原 子数为 0.1NA |
| B.0.1molOH-中共有电子数目为 0.9NA |
| C.1molCl2通入足量 NaOH 溶液中转移电子的数目为 2NA |
| D.100g 质量分数为 46%的乙醇水溶液中氧原子的数目为 4NA |
您最近一年使用:0次
2022-03-14更新
|
647次组卷
|
2卷引用:山西省阳泉市第十一中学校2022-2023学年高一上学期期末(线上)考试化学试题
6 . 用电石(主要成分为CaC2,含CaS和Ca3P2等)制取乙炔时,常用CuSO4溶液除去乙炔中的杂质。反应为:
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析不正确的是
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析不正确的是
| A.CaS、Ca3P2发生水解反应的化学方程式:CaS+2H2O=Ca(OH)2+H2S↑、Ca3P2+6H2O=3Ca(OH)2+2PH3↑ |
| B.不能依据反应①比较硫酸与氢硫酸的酸性强弱 |
| C.反应②中每24 mol CuSO4氧化11 mol PH3 |
| D.用酸性KMnO4溶液验证乙炔还原性时,H2S、PH3有干扰 |
您最近一年使用:0次
2021-09-03更新
|
7443次组卷
|
19卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题
山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题2021年新高考北京化学高考真题2021年北京高考化学试题变式题1-10黑龙江省哈尔滨德强学校2021-2022高三(清北班)上学期期中线下考试化学试题福建省厦门市湖滨中学2021-2022学年高三上学期期中考试化学试题(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)上海南汇中学2021-2022学年高三下学期阶段考试化学试题(已下线)微专题10 “守恒法”在氧化还原反应计算中的应用-备战2023年高考化学一轮复习考点微专题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题(已下线)热点情景汇编-专题三 氧化还原中的化学(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)河北正定中学2022-2023学年高二下学期第二次月考化学试题(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京师范大学第二附属中学2023-2024学年高三上学期10月月考化学试题北京一零一中学2023-2024学年高三上学期11月统练五化学试题天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题北京市北京师范大学第二附属中学2021-2022学年高三上学期期中考试化学试题北京市第十三中学2023-2024学年高三上学期开学考化学试卷 北京八中2023-2024学年高二下学期3月月考化学试题
名校
7 . 某温度下,将氯气通入氢氧化钠溶液中,反应得到氯化钠、次氯酸钠、氯酸钠的混合液,经测定溶液中次氯酸钠和氯酸钠的浓度之比为1:2,则氯气与氢氧化钠溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
| A.21:5 | B.4:1 | C.3:1 | D.11:3 |
您最近一年使用:0次
2020-04-02更新
|
630次组卷
|
6卷引用:山西省阳泉市2019-2020学年高一上学期期末考试化学试题
解题方法
8 . 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将其与浓盐酸混合加热,产生了黄绿色气体。
(1)该反应的化学方程式为____________________ 。
(2)反应中氧化剂是_______ (填化学式),锰元素的化合价________ (填“升高”或“降低”)。若消耗了17.4 g MnO2,则生成标准状况下Cl2的体积是_______ L,转移电子的物质的量是______ mol。
(3)用此反应制得的氯气中常混有_______ ,要收集到干燥纯净的氯气,应使气体依次通过装有_______ 、_______ 的洗气瓶后再收集。
(1)该反应的化学方程式为
(2)反应中氧化剂是
(3)用此反应制得的氯气中常混有
您最近一年使用:0次
名校
9 . 锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,产物有硝酸锌、X和水,则X可能是
| A.NO | B.N2O | C.N2O3 | D.NO2 |
您最近一年使用:0次
2018-02-05更新
|
603次组卷
|
6卷引用:山西省阳泉市第一中学校2023-2024学年高二上学期开学考试化学试题
山西省阳泉市第一中学校2023-2024学年高二上学期开学考试化学试题广西南宁市第三中学2017-2018学年高一上学期期末考试化学试题鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第3节 氮的循环 课时3 硝酸高一必修第二册(人教2019版)第五章 第二节 氮及其化合物 课时3 硝酸(已下线)第07讲 硝酸(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)湖北省罗田县第一中学2021-2022学年高一下学期3月月考化学试题
名校
10 . 一定量的镁溶于一定浓度的硝酸的反应中,产生标准状况下的N2O气体11.2L,在所得的溶液中加入足量的氢氧化钠溶液,完全反应后过滤出沉淀,经洗涤、蒸干并充分灼烧,最后得到固体的质量为
| A.20g | B.40g | C.58g | D.80g |
您最近一年使用:0次
2016-12-09更新
|
309次组卷
|
5卷引用:2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷



