名校
1 . 为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成 ,致密保护层—“发蓝”。化学处理过程中涉及到的反应为
,致密保护层—“发蓝”。化学处理过程中涉及到的反应为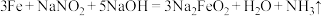 ,下列叙述错误的是
,下列叙述错误的是
 ,致密保护层—“发蓝”。化学处理过程中涉及到的反应为
,致密保护层—“发蓝”。化学处理过程中涉及到的反应为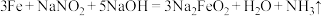 ,下列叙述错误的是
,下列叙述错误的是| A.铁做还原剂,被氧化 | B. 中N元素的化合价为+3价 中N元素的化合价为+3价 |
C.氧化性: | D.反应中每转移3mol电子,生成11.2L |
您最近一年使用:0次
2024-02-22更新
|
124次组卷
|
2卷引用:山西省长治市上党好教育联盟2023-2024学年高一上学期1月期末化学试题
解题方法
2 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(主要成分为MnS,还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备,工艺流程如图所示,回答下列问题:
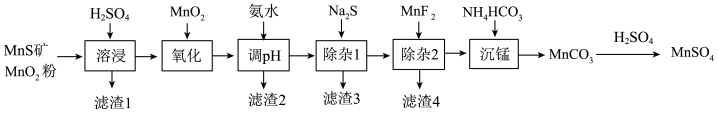
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下表:
(1)已知“溶浸”中发生反应的化学方程式为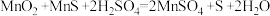 ,当生成0.5molMnSO4时,该反应中转移的电子数为
,当生成0.5molMnSO4时,该反应中转移的电子数为_____ ,该反应中n(还原剂):n(氧化剂)=_____ ,“滤渣1”的主要成分为_____ (化学式)。
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,酸性条件下MnO2氧化Fe2+反应的离子方程式为_____ 。
(3)“除杂1”的目的是去Zn2+和Ni2+,“除杂2”的目的是将Mg2+转化为MgF2沉淀从而除去Mg2+,试推测“调pH”是为了除_____ (填元素符号),溶液的pH范围应调节在_____ ~6(当某金属离子沉淀完全视作该金属离子已除净)。
(4)写出“沉锰”时发生反应的离子方程式_____ 。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为Li3NixCoyMnzO6,其中Ni、Co、Mn、O的化合价次为+2、+3、+4、-2,当x=y=1时,z=_____ ,试用氧化物的形式表示镍钴锰三元材料:_____ [某些含氧酸盐可以写成氧化物的形式(例如:NaAlO2以表示为NaO·Al2O3]。

相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下表:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
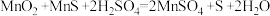 ,当生成0.5molMnSO4时,该反应中转移的电子数为
,当生成0.5molMnSO4时,该反应中转移的电子数为(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,酸性条件下MnO2氧化Fe2+反应的离子方程式为
(3)“除杂1”的目的是去Zn2+和Ni2+,“除杂2”的目的是将Mg2+转化为MgF2沉淀从而除去Mg2+,试推测“调pH”是为了除
(4)写出“沉锰”时发生反应的离子方程式
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为Li3NixCoyMnzO6,其中Ni、Co、Mn、O的化合价次为+2、+3、+4、-2,当x=y=1时,z=
您最近一年使用:0次
2023-07-09更新
|
156次组卷
|
2卷引用:山西省长治市2022-2023学年高一下学期期末测试化学试题
3 . 设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.44g丙烷中含有的极性共价键的数目为11NA |
| B.30g由甲醛(HCHO)和乙酸组成的混合物中含有氧原子的数目为NA |
| C.13.8g二氧化氮与水完全反应过程中转移电子的总数目为0.3NA |
| D.0.1mol·L-1稀盐酸中含有氯离子数目为0.1NA |
您最近一年使用:0次
2023-07-09更新
|
90次组卷
|
2卷引用:山西省长治市2022-2023学年高一下学期期末测试化学试题
名校
解题方法
4 . 已知: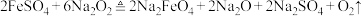 ,则该反应中被氧化的
,则该反应中被氧化的 与被
与被 还原的
还原的 的物质的量之比为
的物质的量之比为
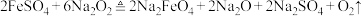 ,则该反应中被氧化的
,则该反应中被氧化的 与被
与被 还原的
还原的 的物质的量之比为
的物质的量之比为| A.2:3 | B.1:4 | C.5:1 | D.1:5 |
您最近一年使用:0次
名校
解题方法
5 . 用 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:
①
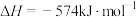
②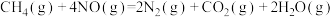
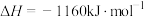
下列说法不正确的是
 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:①

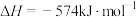
②
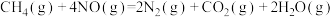
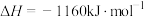
下列说法不正确的是
A.若标准状况下4.48L 与 与 完全反应生成 完全反应生成 、 、 和水蒸气,放出的热量为173.4kJ 和水蒸气,放出的热量为173.4kJ |
B.由反应①可推知: 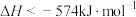 |
C.反应①②中,相同物质的量的 发生反应,转移的电子数相同 发生反应,转移的电子数相同 |
D.反应②中当4.48L 反应完全时转移的电子为1.60mol 反应完全时转移的电子为1.60mol |
您最近一年使用:0次
2022-09-04更新
|
2204次组卷
|
44卷引用:山西省长治二中2018-2019学年高二上学期第一次月考化学试题
山西省长治二中2018-2019学年高二上学期第一次月考化学试题山西省沁县中学2020-2021学年高二上学期第一次月考化学试题2015-2016学年湖南省冷水江一中高二上学期期中(理)化学试卷2016-2017学年河北省唐山市开滦一中高二上10月月考化学试卷 2016-2017学年江苏省泰州中学高二上月考一化学试卷山西省朔州市第一中学2017-2018学年高二8月月考化学试题山东省枣庄市第八中学东校区2017-2018学年高二10月月考化学试题甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二3月月考化学试题山西省朔州市平鲁区李林中学2018-2019学年高二上学期第一次月考化学试题河南省周口市中英文学校2018-2019学年高二上学期第一次月考化学试题(已下线)2018年10月21日 《每日一题》人教选修4-每周一测高二人教版选修4 第一章 第三节 化学反应热的计算福建省泉州市泉港区第一中学2018-2019学年高二上学期第二次月考化学试题江苏省江阴市第一中学2018-2019学年高二下学期期中考试化学试题步步为赢 高二化学暑假作业:作业七 化学反应与能量甘肃省兰州市第一中学2019-2020学年高二9月月考化学试题安徽省青阳县第一中学2019-2020学年高二10月月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节 化学反应的热效应 课时3 反应焓变的计算高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 第二节综合训练(已下线)【南昌新东方】5. 南昌三中 徐钢 吴丹.广东省深圳市第七高级中学2020-2021学年高二上学期第一学段考试化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过综合 章末素养综合检测人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过综合 章末素养综合检测山东省德州市10校联考2020—2021学年高二上学期期中模块检测(人教版) 化学试题广东省清远市凤霞中学2020-2021学年高二上学期期中考试化学(选科)试题湖北省咸宁市通城二中2020-2021学年高二上学期10月月考化学试题选择性必修1(SJ)专题1专题综合检测选择性必修1专题1第一单元 课时2 反应热的测量与计算重庆市缙云教育联盟2021-2022学年高三8月月度质量检测化学试题河南省内乡县第三高级中学2021-2022学年高二上学期第一次月考化学试卷河北省石家庄实验中学2021-2022学年高二上学期10月月考化学试题安徽省蚌埠第三中学2021-2022学年高二下学期开学测试化学试题三峡名校联盟2021-2022学年高二上学期联考化学试题云南省丽江市第一高级中学2021-2022学年高二上学期期中考试化学试题(已下线)化学反应的热效应——进阶学习第一章化学反应的热效应甘肃省兰州市西固区三校2021-2022学年高二上学期期中联考化学(理科)试题江西省金溪县第一中学2022-2023年度高二上学期第一次月考化学试题河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题吉林省九台龙成实验学校2022-2023学年高二上学期第一次月考化学试题宁夏石嘴山市第三中学2022-2023学年高二下学期第一次月考化学(理)试题1.1.2反应热的测量与计算 课后黑龙江哈尔滨第一中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
6 . 一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成HClO,遇有机物易燃烧或爆炸。Cl2O的熔点是-120.6℃,沸点是2.0℃。利用反应2HgO+2Cl2=Cl2O+HgCl2•HgO可制备Cl2O。某同学利用如图装置制备Cl2O,请回答下列问题:
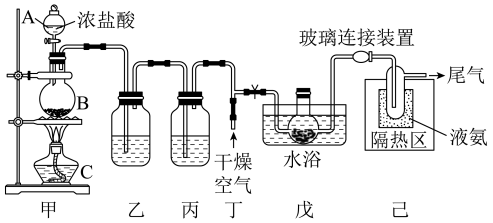
(1)装置甲的作用是为该制备反应提供Cl2,写出该装置中制备Cl2的离子反应方程式为_______ 。
(2)装置乙的洗气瓶中盛有的试剂是_______ ;装置丙的作用是 _______ 。
(3)装置戊中的特型烧瓶内盛有玻璃丝,玻璃丝上附着有HgO粉末,其中玻璃丝的作用是_______ 。
(4)装置戊和装置己之间的装置为玻璃连接装置,而不是橡胶管,其原因是_______ 。
(5)该同学的装置存在一个明显的不足之处,请你帮他提出改进措施_______ 。
(6)反应2HgO+2Cl2=Cl2O+HgCl2•HgO中,生成1molCl2O转移电子的数目为_______ 。若实验开始前称量装置戊中的玻璃丝与HgO的混合物的质量为48.0g,实验结束后玻璃丝及其附着物的质量为53.5g,则制备的Cl2O为_______ mol。

(1)装置甲的作用是为该制备反应提供Cl2,写出该装置中制备Cl2的离子反应方程式为
(2)装置乙的洗气瓶中盛有的试剂是
(3)装置戊中的特型烧瓶内盛有玻璃丝,玻璃丝上附着有HgO粉末,其中玻璃丝的作用是
(4)装置戊和装置己之间的装置为玻璃连接装置,而不是橡胶管,其原因是
(5)该同学的装置存在一个明显的不足之处,请你帮他提出改进措施
(6)反应2HgO+2Cl2=Cl2O+HgCl2•HgO中,生成1molCl2O转移电子的数目为
您最近一年使用:0次
名校
解题方法
7 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如图所示:

①加入Fe粉进行转化反应的离子方程式为____ ,生成的沉淀与硝酸反应,生成____ 后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的方程式为____ ;若反应物用量比为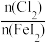 =1.5时,氧化产物为
=1.5时,氧化产物为____ ,当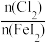 >1.5后,单质碘的收率会降低,原因是
>1.5后,单质碘的收率会降低,原因是____ 。
(2)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1molI2,消耗的KI至少____ mol。
(3)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物,再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总离子反应方程式为____ 。
(1)I2的一种制备方法如图所示:

①加入Fe粉进行转化反应的离子方程式为
②通入Cl2的过程中,若氧化产物只有一种,反应的方程式为
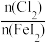 =1.5时,氧化产物为
=1.5时,氧化产物为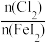 >1.5后,单质碘的收率会降低,原因是
>1.5后,单质碘的收率会降低,原因是(2)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1molI2,消耗的KI至少
(3)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物,再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总离子反应方程式为
您最近一年使用:0次
名校
解题方法
8 . Co(OH)2在空气中加热时,固体(不含其他杂质)质量随温度变化的曲线如图所示,取400℃时的产物(其中Co的化合价为+2,+3),用500mL5.1mol·L-1盐酸将其恰好完全溶解,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。下列说法错误的是
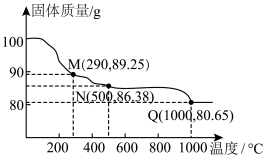

A.290℃时,固体的成分仅有 |
B.400℃时,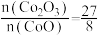 |
| C.500℃时,固体中氧元素总质量分数约为26.6% |
| D.生成的黄绿色气体可用于工业上生产“84”消毒液 |
您最近一年使用:0次
2022-07-03更新
|
548次组卷
|
4卷引用:山西省长治市2021-2022学年高二下学期期末联考化学试题
山西省长治市2021-2022学年高二下学期期末联考化学试题河北省保定市2021-2022学年高二下学期期末考试化学试题江西省南昌市第二中学2022-2023学年高三上学期第三次考试化学试题(已下线)2022年福建省高考真题变式题(选择题6-10)
名校
9 . 某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。

已知:I.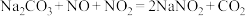 ;
;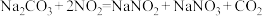 。
。
II.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___________ 。
(2)若使“吸收”步骤中的NOx完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___________ 。
(3)该课外兴趣小组对实验制得的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入稀硫酸,加热至40~50℃。冷却后再向其中加入20.00mL0.100 溶液,充分混合。
溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复3次,平均消耗样品溶液50.00mL。
(NaNO2与KMnO4反应的关系式为2KMnO4~5NaNO2)
①整个测定过程的操作应迅速,不宜耗时过长,否则样品的纯度将___________ (“偏大”、“偏小”或“无影响”),原因是___________ 。
②通过计算,该样品中NaNO2的质量分数为___________ 。
(4)该课外兴趣小组将NaNO2溶液逐滴加入含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是___________ 。

已知:I.
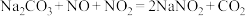 ;
;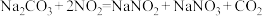 。
。II.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是
(2)若使“吸收”步骤中的NOx完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为
(3)该课外兴趣小组对实验制得的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入稀硫酸,加热至40~50℃。冷却后再向其中加入20.00mL0.100
 溶液,充分混合。
溶液,充分混合。c.最后用待测的样品溶液与之恰好完全反应,重复3次,平均消耗样品溶液50.00mL。
(NaNO2与KMnO4反应的关系式为2KMnO4~5NaNO2)
①整个测定过程的操作应迅速,不宜耗时过长,否则样品的纯度将
②通过计算,该样品中NaNO2的质量分数为
(4)该课外兴趣小组将NaNO2溶液逐滴加入含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是
您最近一年使用:0次
名校
解题方法
10 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积[V(NO)](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
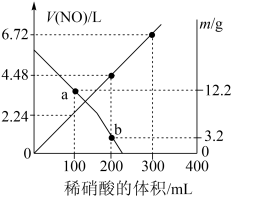

| A.稀硝酸的浓度为0.4mol·L-1 |
| B.a点时,100mL稀硝酸中溶解了Fe和Cu共8.4g |
| C.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+、Cu2+ |
| D.加入稀硝酸至400mL时,收集到的V(NO)约为6.91L |
您最近一年使用:0次
2022-05-03更新
|
3564次组卷
|
14卷引用:山西省长治市2021-2022学年高一下学期期末联合考化学试题
山西省长治市2021-2022学年高一下学期期末联合考化学试题湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题江西省重点2021-2022学年高一下学期5月联考化学试题湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题(已下线)微专题23 金属与硝酸反应的规律与计算-备战2023年高考化学一轮复习考点微专题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期第一次验收考试化学试题江西省上饶市民校考试联盟2022—2023学年高一下学期阶段测试(四)化学试题新疆维吾尔自治区和田地区策勒县2022-2023学年高三上学期11月期中考试化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题



