名校
1 . 汽车剧烈碰撞时,安全气囊中发生反应:NaN3+KNO3→K2O+Na2O+N2↑(未配平)。对上述反应的描述错误的是
| A.NaN3是还原剂,KNO3是氧化剂 |
| B.该反应中只有1种元素的化合价发生变化 |
| C.配平后物质的化学计量数依次为10、2、1、5、16 |
| D.生成N2的个数与转移电子个数之比为4:5 |
您最近一年使用:0次
2024-03-22更新
|
105次组卷
|
2卷引用:山西省运城市康杰中学2023-2024学年高一下学期化学试题
2 . 目前支原体肺炎流行,及时消毒有利于降低感染几率。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂等,其中含氯消毒剂的家族最庞大、应用最广泛。
(1)次氯酸钠( )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为___________ 。
(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是___________ ,若生成标况下44.8L的 ,转移电子的数目为
,转移电子的数目为___________ 。
(3)如果在不同温度、浓度的条件下, 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,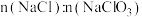 为
为___________ ,整个过程,参加反应所需 与氯气的物质的量之比为
与氯气的物质的量之比为___________ 。
若将 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:
(4) 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法___________ 。
A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
亚氯酸钠( )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。 在发生器中发生
在发生器中发生________ (氧化或还原)反应,该反应的还原产物为_________ ,吸收塔中温度不宜过高,否则会导致 产率下降,原因是
产率下降,原因是___________ 。
(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为___________ 。(保留两位小数)。
(1)次氯酸钠(
 )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是
 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是 ,转移电子的数目为
,转移电子的数目为(3)如果在不同温度、浓度的条件下,
 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,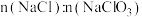 为
为 与氯气的物质的量之比为
与氯气的物质的量之比为若将
 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:(4)
 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
A. amol amol | B. amol amol | C. amol amol | D.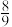 amol amol |
亚氯酸钠(
 )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。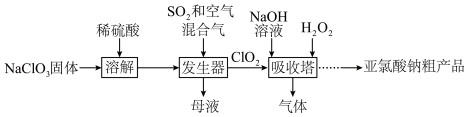
 在发生器中发生
在发生器中发生 产率下降,原因是
产率下降,原因是(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克
 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2024-02-02更新
|
0次组卷
|
2卷引用:山西省运城市景胜中学2023-2024学年高一下学期3月月考化学试题
解题方法
3 . 高铁酸钾(K2FeO4)是一种高效多功能的绿色消毒剂,某兴趣小组欲利用废铁屑(主要成分为Fe,还含有少量 和
和 )制取高铁酸钾,其工艺流程图如下。
)制取高铁酸钾,其工艺流程图如下。
(1)“滤渣”的主要成分为___________ 。
(2)“操作1”所需的玻璃仪器包括___________ 。
(3)写出 的电子式
的电子式___________ 。
(4)加入饱和 溶液时发生反应
溶液时发生反应 ,试解释该反应能发生的原因
,试解释该反应能发生的原因___________ 。
(5) 处理水时,不仅能杀菌消毒,还能形成
处理水时,不仅能杀菌消毒,还能形成___________ (填化学式)吸附水中悬浮杂质而净化水。
(6)高铁酸钾在碱性条件下稳定,在中性潮湿环境中会产生红褐色的物质,并释放出一种能使带火星的木条复燃的气体。试写出高铁酸钾溶解在中性溶液中与水反应的离子方程式___________ 。
(7)若生成 的反应原理可表示为:
的反应原理可表示为: ,当反应中转移电子总数为
,当反应中转移电子总数为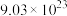 时,生成
时,生成 的物质的量为
的物质的量为___________  。
。
 和
和 )制取高铁酸钾,其工艺流程图如下。
)制取高铁酸钾,其工艺流程图如下。
(1)“滤渣”的主要成分为
(2)“操作1”所需的玻璃仪器包括
(3)写出
 的电子式
的电子式(4)加入饱和
 溶液时发生反应
溶液时发生反应 ,试解释该反应能发生的原因
,试解释该反应能发生的原因(5)
 处理水时,不仅能杀菌消毒,还能形成
处理水时,不仅能杀菌消毒,还能形成(6)高铁酸钾在碱性条件下稳定,在中性潮湿环境中会产生红褐色的物质,并释放出一种能使带火星的木条复燃的气体。试写出高铁酸钾溶解在中性溶液中与水反应的离子方程式
(7)若生成
 的反应原理可表示为:
的反应原理可表示为: ,当反应中转移电子总数为
,当反应中转移电子总数为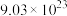 时,生成
时,生成 的物质的量为
的物质的量为 。
。
您最近一年使用:0次
2024-01-06更新
|
108次组卷
|
2卷引用:山西运城盐湖五中2023-2024学年高三上学期期末考试化学试题
4 . Cu和 在工农业生产中用途广泛,用黄铜矿(主要成分为
在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取Cu和
,其中Cu为+2价、Fe为+2价)制取Cu和 的工艺流程如图所示:
的工艺流程如图所示:
(1)“高温焙烧”时发生的反应是 ,该反应的氧化产物是
,该反应的氧化产物是___________ (填化学式), 参加反应时,反应转移电子
参加反应时,反应转移电子___________ mol。
(2)向滤液A中通入 的目的是
的目的是___________ 。
(3)由滤渣“焙烧”得到 的化学方程式为
的化学方程式为___________ 。
(4)某同学想用酸性 溶液检验溶液B中是否还有
溶液检验溶液B中是否还有 ,你认为是否合适?
,你认为是否合适?___________ (填“是”或“否”),请简述理由:___________ 。
(5)流程中产生的 尾气可以与
尾气可以与 尾气反应得到单质硫,实现变废为宝。两尾气相互反应后,硫元素是否可以全部回收利用?
尾气反应得到单质硫,实现变废为宝。两尾气相互反应后,硫元素是否可以全部回收利用?___________ (填“是”或“否”),请简述理由:___________ 。
 在工农业生产中用途广泛,用黄铜矿(主要成分为
在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取Cu和
,其中Cu为+2价、Fe为+2价)制取Cu和 的工艺流程如图所示:
的工艺流程如图所示: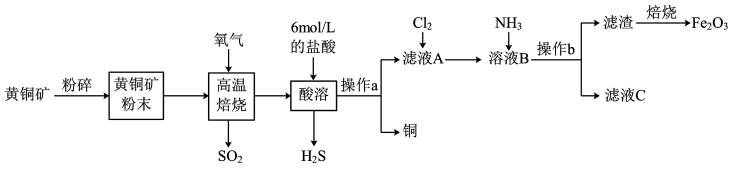

(1)“高温焙烧”时发生的反应是
 ,该反应的氧化产物是
,该反应的氧化产物是 参加反应时,反应转移电子
参加反应时,反应转移电子(2)向滤液A中通入
 的目的是
的目的是(3)由滤渣“焙烧”得到
 的化学方程式为
的化学方程式为(4)某同学想用酸性
 溶液检验溶液B中是否还有
溶液检验溶液B中是否还有 ,你认为是否合适?
,你认为是否合适?(5)流程中产生的
 尾气可以与
尾气可以与 尾气反应得到单质硫,实现变废为宝。两尾气相互反应后,硫元素是否可以全部回收利用?
尾气反应得到单质硫,实现变废为宝。两尾气相互反应后,硫元素是否可以全部回收利用?
您最近一年使用:0次
2023-12-23更新
|
126次组卷
|
2卷引用:山西运城盐湖五中2023-2024学年高一上学期期末检测化学模拟试卷
名校
解题方法
5 . 在一定条件下,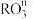 和
和 可发生如下反应:
可发生如下反应: ,从而可知在
,从而可知在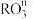 中,元素R的化合价是
中,元素R的化合价是
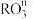 和
和 可发生如下反应:
可发生如下反应: ,从而可知在
,从而可知在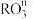 中,元素R的化合价是
中,元素R的化合价是| A.+7价 | B.+4价 | C.+5价 | D.+6价 |
您最近一年使用:0次
2023-12-23更新
|
406次组卷
|
153卷引用:山西省运城中学、芮城中学2017-2018学年高一上学期期中联考化学试题
山西省运城中学、芮城中学2017-2018学年高一上学期期中联考化学试题山西省运城市新绛中学、河津中学等校2020-2021学年高一上学期10月联考化学试题山西省运城市稷山中学2022届高三上学期月考(一)化学试题(已下线)2010年辽宁省沈阳四校联合体高一上学期期中考试化学卷(已下线)2010年黑龙江牡丹江一中高一上学期期中考试化学试卷(已下线)2010年江苏省海安县南莫中学高一上学期期中考试化学试卷(已下线)2011-2012年浙江省金华一中高一上学期期中考试化学试卷(已下线)2011-2012年黑龙江哈九中高一上学期期中考试化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高一上学期期中考试化学试卷(已下线)2011-2012学年山东省微山一中高一上学期期中考试化学试卷(已下线)2011-2012学年山东济宁梁山二中高一12月月考化学试卷(已下线)2011-2012学年武汉二中高一上学期期中考试化学试卷(已下线)2012届陕西省西安市第一中学高三上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高一上学期期末考试化学试卷(已下线)2011-2012学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2012-2013学年江西省白鹭洲中学高一第一次月考化学试卷(已下线)2012-2013学年安徽六安新安中学高一上学期期中考试化学试卷(已下线)2012-2013学年河北省石家庄市第一中学高一上学期期中考试化学试卷(已下线)2013-2014学年广西北海市合浦县高一上学期期中考试化学试卷(已下线)2013-2014学年安徽省合肥一中高一上学期期中考试化学试卷(已下线)2013-2014学年重庆市重庆一中高一上学期期中考试化学试卷(已下线)2013-2014安徽省合肥一中高一上学期期中考试化学试卷(已下线)2014-2015河北保定某重点中学同步作业(必修1苏教版)2.2.3离子反应(已下线)2014-2015学年度河南省许昌市五校高一上期第一次联考化学试卷2014-2015辽宁省大连市高一上学期期末考试化学试卷2014-2015学年山东济南外国语学校高一上期中化学试卷2015-2016学年广东省广州培正中学高一上学期期中测试化学试卷2015-2016学年福建厦门双十中学高一上期中考试化学试卷2015-2016学年浙江省杭州二中高一上期末化学试卷2015-2016学年福建省莆田八中高一上学期第二次月考化学试卷2016-2017学年云南省云天化中学高一9月月考化学卷2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷2016-2017学年江西省上高二中高一上月考二化学卷2016-2017学年新疆生产建设兵团二中高一上期中化学卷2017届陕西省黄陵中学高三上学期第三次质检化学试卷2016-2017学年辽宁省六校协作体高一下学期期初化学试卷辽宁省葫芦岛市六校协作体2016-2017学年高一下学期期初考试化学试题安徽省蚌埠市第二中学2017-2018学年高二上学期开学考试化学试题河北省阜城中学2017-2018学年高一上学期第四次月考化学试题江西省抚州市临川实验学校2017-2018学年高一上学期期中考试化学试题高中化学人教版 必修1 第二章 化学物质及其变化 3.氧化还原反应 氧化还原反应安徽省濉溪县临涣中学2017-2018学年高一上学期第二次月考化学试题浙江省定海一中2017-2018学年高一第一学期期中考试化学试卷贵州省六盘水盘县四中2017-2018学年高一下学期期末考试化学试题【全国百强校】云南省云天化中学2018-2019学年高一上学期期中考试化学试题贵州省正安县一中2018-2019学年高一上学期期中考试化学试题【全国百强校】山东省菏泽第一中学八一路校区2018-2019学年高一上学期12月月考化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题江西省南康中学2017-2018学年高一上学期期中考试化学试题吉林省乾安县七中2017-2018学年高一上学期期中考试化学试卷吉林省吉林地区普通高中友好学校联合体第三十一届2019-2020学年高一上学期期中考试化学试题内蒙古自治区乌兰察布市集宁一中2019-2020学年高一上学期期中考试化学试题广东省北大附中深圳南山分校2020届高三上学期期中考试化学试题四川省雅安中学2019-2020学年高一上学期期中考试化学试题广西壮族自治区百色市田阳高中2019-2020学年高一上学期期中考试化学试题河南省漯河市实验高中2019-2020学年高一上学期期中考试化学试题宁夏青铜峡市高级中学2019-2020学年高一上学期期中考试化学试题北京市第二十二中学2019-2020学年高一上学期期中考试化学试题江西省南昌市新建县第一中学2020届高三上学期第一次月考化学试题(共建部)黑龙江省大庆市第四中学2019-2020学年高一上学期第二次月考化学试题河南省驻马店市正阳县高级中学2019-2020学年高一上学期第三次素质检测化学试题云南省马关县第二中学2019-2020学年高一上学期期末考试化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷青海省西宁市第十四中学2019-2020学年高二上学期期末考试化学试题贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高三上学期期末考试化学试题福建省福州市福建师范大学附属中学2017-2018学年高一下学期期中考试化学试题河北省石家庄市第二中学2018-2019学年高一上学期期末考试化学试题辽宁省营口市第二高级中学2019-2020学年高一上学期第一次月考化学试题(已下线)衔接点09 氧化还原反应的表示-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)衔接点08 氧化还原反应的一般规律-2020年【衔接教材·暑假作业】初高中衔接化学山西省朔州市怀仁市第一中学云东校区2019-2020学年高一期末考试化学试题(已下线)3.2.3 离子反应练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)第2章 总结与检测(2)——《高中新教材同步备课》(鲁科版 必修第一册)河南省平顶山市舞钢市第一高级中学2021届高三9月月考化学试题吉林省白城市洮南市第一中学2021届高三上学期第一次月考化学试题江苏省南京外国语学校2018-2019学年高一上学期期中考试化学试题黑龙江省绥化市安达市第七中学2020-2021学年高一上学期9月月考化学试题河南省新乡市2020-2021学年高一阶段测试化学试题广西玉林师院附中、玉林市育才中学、玉林十一中、玉林市田家炳中学2019-2020学年高一上学期期中考试化学试题(已下线)【浙江新东方】21(已下线)【浙江新东方】14(已下线)【浙江新东方】15江苏省南京师范大学附属中学2020-2021学年高一上学期期中考试化学试题湖南省长沙市南雅中学2020—2021学年高一上学期第一次月考化学试题湖北省荆门市沙洋县沙洋中学2020-2021学年高一上学期10月月考化学试题湖南省常德市第一中学2020-2021学年高一上学期期中考试化学试题安徽省合肥瑶海区合肥市第十一中学2020-2021学年高一上学期期中考试化学试题吉林省榆树市第一高级中学2021届高三上学期第三次模拟考试化学试题吉林省大安市第六中学2020-2021学年高一上学期第二次月考化学试题甘肃省张掖市2020-2021学年高一上学期期末学业水平质量检测化学试题甘肃省镇原县第二中学2020-2021学年高一上学期期中考试化学试题陕西省宝鸡市渭滨区2020-2021学年高一上学期期末考试化学试题江苏省苏州市西安交通大学苏州附属中学2020-2021学年高一上学期期中考试化学试卷黑龙江省伊春市伊美区第二中学2020-2021学年高一上学期第三次月考化学试题吉林省长春市第一五一中学2020-2021学年高一上学期期中考试化学试题(已下线)衔接点08 氧化还原反应的一般规律-2021年初升高化学无忧衔接(已下线)衔接点09 氧化还原反应的表示-2021年初升高化学无忧衔接河北师范大学附属实验中学2020~2021学年高一上学期10月月考化学试题吉林省白城市第一中学2021-2022学年高一上学期第一次阶段考试化学试题陕西省榆林市绥德中学2020-2021学年高一下学期第一次阶段性测试化学试卷黑龙江省双鸭山市第一中学2021-2022学年高一上学期第一次月考化学试题广东省名校2021-2022学年高一上学期第一次月考化学试卷广西桂林市第十八中学2021-2022学年高一上学期开学考试化学试题河北省石家庄市师范大学附属实验中学2021-2022高一上学期10月月考化学试卷宁夏银川唐徕回民中学2021-2022学年高一11月月考化学试题陕西省西安市第一中学2022届高三上学期期中考试化学试题北京师范大学附属中学2021-2022学年高一上学期期中考试化学试题湖北省巴东一中2020-2021学年高一上学期第三次月考化学试题江西省吉安市遂川中学2021-2022学年高一上学期第一次月考化学(B卷)试题湖南省长郡中学2021-2022学年高一上学期期末考试化学试题(已下线)衔接点13 氧化还原反应的规律和表示方法-2022年初升高化学无忧衔接?吉林省长春市东北师范大学附属中学2022-2023学年高一上学期阶段考试化学试题北京市丰台区丰台第二中学2022-2023学年上学期高三10月月考化学试题新疆生产建设兵团第一师高级中学2022-2023学年高一上学期第一次月考化学试题黑龙江省鸡西市英桥高级中学2021-2022学年高二下学期期末考试化学试题湖北省襄阳四中2021-2022学年高一上学期10月考试化学试题陕西省西安市铁一中2022-2023学年高一上学期第一次月考化学试题湖南省邵阳市武冈市2020-2021学年高一上学期期中考试化学试题北京市第一七一中学2022-2023学年高一上学期期中考试化学试题辽宁省锦州市渤海大学附属高级中学2022-2023学年高一上学期期中考试化学试题安徽省六安中学2021-2022学年高一上学期期中考试化学试题云南省昆明市禄劝彝族苗族自治县第一中学2021-2022学年高一网络班10月月考化学试题安徽省阜阳第一中学2022-2023学年高一上学期第三次月考化学试题河北省唐山市乐亭第二中学2022-2023学年高一上学期期末考试化学试题重庆实验外国语学校2022-2023学年高一上学期1月期末考试化学试题(已下线)第二章 物质的量化学实验基本技能 第8练 化学计算的常用方法福建省莆田锦江中学2022-2023学年高一上学期期末质检化学试题广东省河源市龙川县第一中学2022-2023学年高一上学期期末考试化学试题云南省玉溪第一中学2022-2023学年高一上学期第一月考化学试题 微专题(四) 氧化还原反应的简单规律及应用甘肃省天水市甘谷县2023-2024学年高三上学期第一次检测化学试题河南省河南中原名校联考2023-2024学年高一上学期9月月考化学试题广西贵港市名校2023-2024学年高一上学期入学联考化学试题陕西省西安高新第一中学2023-2024学年高一上学期第一次月考化学试题辽宁省鞍山市普通高中2023-2024学年高一上学期10月月考化学(A卷)试题新疆乌鲁木齐第八中学2023-2024学年高一上学期第一次月考化学试题云南省昆明市第八中学2023-2024学年高一上学期9月月考化学试卷题吉林省长春市新解放学校2022-2023学年高一上学期11月期中化学试题湖南省株洲市第二中学2023-2024学年高一上学期第一次适应性检测化学试题 天津市双菱中学2023-2024学年高一上学期期中考试化学试卷湖南省洞口县第九中学2023-2024学年高一上学期第一次月考化学试题辽宁省大连保税区第一高级中学2023-2024学年高一上学期10月月考化学(A)试题江西省景德镇市乐平市第三中学2023-2024学年高一上学期10月月考化学试题湖南省岳阳县第一中学2023-2024学年高一上学期第一次月考化学试题 辽宁省阜新市第二高级中学2023-2024学年高一上学期第一次考试化学试卷河南省濮阳市第一高级中学2023-2024学年高一上学期第一次质量检测化学试题四川省内江市威远中学2023-2024学年高一上学期期中考试化学试题黑龙江省实验中学2023-2024学年高一上学期期中测试化学试题河南省开封市五县联考2023-2024学年高一上学期12月月考化学试题北京市第三十五中学2021-2022学年高一上学期期中考试化学试题湖南省永州市祁阳县第四中学2023-2024学年高一上学期期中考试化学试题北京市第一六一中学2023-2024学年高一上学期期中考试化学试题四川省泸州市泸县第五中学2023-2024学年高一上学期1月期末化学试题
6 . 不是所有的火灾都适合使用 灭火器,比如金属镁失火,应该用沙土灭火而不是
灭火器,比如金属镁失火,应该用沙土灭火而不是 灭火器。原因是镁可以在
灭火器。原因是镁可以在 中燃烧,发生反应
中燃烧,发生反应  。判断正确的是
。判断正确的是
 灭火器,比如金属镁失火,应该用沙土灭火而不是
灭火器,比如金属镁失火,应该用沙土灭火而不是 灭火器。原因是镁可以在
灭火器。原因是镁可以在 中燃烧,发生反应
中燃烧,发生反应  。判断正确的是
。判断正确的是A. 是氧化剂,表现出氧化性,发生氧化反应 是氧化剂,表现出氧化性,发生氧化反应 |
B.由此反应可以判断该反应条件下,氧化性  > > ,还原性 ,还原性  > > |
C. 原子失去电子的总数目与 原子失去电子的总数目与 原子得到电子的总数目之比为 1:2 原子得到电子的总数目之比为 1:2 |
D.每消耗1mol 转移电子的数目为4NA 转移电子的数目为4NA |
您最近一年使用:0次
2023-11-17更新
|
124次组卷
|
4卷引用:山西省运城市盐湖区第五高级中学2023-2024学年高一上学期化学期末练兵卷(二)
7 . 氮元素在地球上含量丰富,氮及其化合物在工农业生产和生活中有着重要作用,氮氧化物也是主要的大气污染物。
(1)含有NO和 的工业尾气可以利用NaOH溶液吸收处理。主要反应为
的工业尾气可以利用NaOH溶液吸收处理。主要反应为 、
、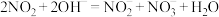 。
。
①下列措施不能提高尾气中NO和 去除率的有
去除率的有___________ (填标号)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气的过程中定期补加适量NaOH溶液
②若将2.24L(已换算成标准状况下的体积)由NO和 组成的混合气体通入
组成的混合气体通入 溶液中,充分反应(气体完全被吸收),吸收后的溶液经浓缩、结晶、过滤、洗涤、干燥后,得到晶体7.22g,则原混合气体中NO和
溶液中,充分反应(气体完全被吸收),吸收后的溶液经浓缩、结晶、过滤、洗涤、干燥后,得到晶体7.22g,则原混合气体中NO和 的物质的量之比为
的物质的量之比为___________ 。
(2)用NaClO溶液也可以吸收工业尾气中的NO。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 和
和 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高,其原因是___________ 。
(3)以亚硝酸钠( )溶液为研究对象,探究
)溶液为研究对象,探究 的性质。现取三份
的性质。现取三份 溶液,分别进行以下实验:
溶液,分别进行以下实验:
(1)含有NO和
 的工业尾气可以利用NaOH溶液吸收处理。主要反应为
的工业尾气可以利用NaOH溶液吸收处理。主要反应为 、
、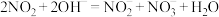 。
。①下列措施不能提高尾气中NO和
 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气的过程中定期补加适量NaOH溶液
②若将2.24L(已换算成标准状况下的体积)由NO和
 组成的混合气体通入
组成的混合气体通入 溶液中,充分反应(气体完全被吸收),吸收后的溶液经浓缩、结晶、过滤、洗涤、干燥后,得到晶体7.22g,则原混合气体中NO和
溶液中,充分反应(气体完全被吸收),吸收后的溶液经浓缩、结晶、过滤、洗涤、干燥后,得到晶体7.22g,则原混合气体中NO和 的物质的量之比为
的物质的量之比为(2)用NaClO溶液也可以吸收工业尾气中的NO。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
 和
和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高,其原因是
(3)以亚硝酸钠(
 )溶液为研究对象,探究
)溶液为研究对象,探究 的性质。现取三份
的性质。现取三份 溶液,分别进行以下实验:
溶液,分别进行以下实验:
| 操作和现象 | 结论 |
| 实验1:滴加稀硫酸,产生红综色气体。 | 写出产生此现象的离子方程式:① | |
实验2:滴入 溶液,开始仍为紫红色,再向溶液中滴加稀硫酸后,紫色褪去。 溶液,开始仍为紫红色,再向溶液中滴加稀硫酸后,紫色褪去。 | 写出产生此观象的离子方程式:② | |
实验3:滴入5滴 溶液再加入 溶液再加入 溶液和足量HCl,振荡,产生白色沉淀。 溶液和足量HCl,振荡,产生白色沉淀。 | 可推断 ,具有③ ,具有③ |
您最近一年使用:0次
2023-11-15更新
|
163次组卷
|
2卷引用:山西省运城市景胜中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
8 . 已知:5R2O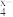 +2MnO
+2MnO +
+ H+→10RO2+2Mn2++
H+→10RO2+2Mn2++ H2O(未配平),则R2O
H2O(未配平),则R2O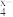 中x的值为
中x的值为
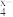 +2MnO
+2MnO +
+ H+→10RO2+2Mn2++
H+→10RO2+2Mn2++ H2O(未配平),则R2O
H2O(未配平),则R2O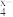 中x的值为
中x的值为| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2023-10-11更新
|
318次组卷
|
3卷引用:山西省运城市2023-2024学年高一上学期10月月考化学试题
名校
解题方法
9 . KMnO4是实验室常见的氧化剂,实验室用MnO2等作原料制取少量KMnO4的实验流程如图:
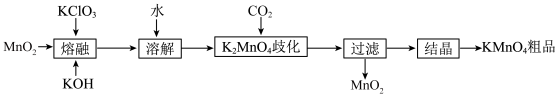
下列说法正确的是

下列说法正确的是
| A.“熔融”过程中氧化剂是KClO3,还原剂是MnO2 |
B.“溶解”后的溶液中存在大量的K+、Cl-、MnO |
| C.“K2MnO4歧化”时氧化剂与还原剂的分子个数比为1∶2 |
| D.为了得到更多的晶体,结晶时应大火蒸干 |
您最近一年使用:0次
2023-10-11更新
|
173次组卷
|
3卷引用:山西省运城市2023-2024学年高一上学期10月月考化学试题
10 . 在焊接铜器时常用NH4Cl溶液除去铜器表面的氧化铜,其反应为CuO+NH4Cl→Cu+CuCl2+N2+H2O(未配平)。下列说法正确的是
| A.该反应中NH4Cl被氧化,发生还原反应 |
| B.该反应中氧化剂和还原剂的个数之比为2:1 |
| C.该反应中产生1个氮气分子时,转移3个电子 |
D.该反应中被还原的CuO占参与反应的CuO的 |
您最近一年使用:0次
2023-10-11更新
|
190次组卷
|
2卷引用:山西省运城市2023-2024学年高一上学期10月月考化学试题




