名校
解题方法
1 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅等的氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示。下列说法正确的是
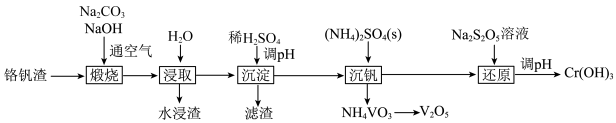
已知:①“煅烧”时铬、铝和硅的氧化物均转化为可溶性钠盐:
② 。
。

已知:①“煅烧”时铬、铝和硅的氧化物均转化为可溶性钠盐:
②
 。
。A.“煅烧”后的含铬化合物是 |
B.“滤渣”中只含有 |
C.“沉钒”时 固体可增大 固体可增大 的浓度,有利于沉淀的生成 的浓度,有利于沉淀的生成 |
D.“还原”工序中氧化剂和还原剂的物质的量之比为 |
您最近一年使用:0次
2023-12-03更新
|
371次组卷
|
2卷引用:辽宁省沈阳市第一二0中学2023-2024学年高三上学期第五次质量监测化学试题
名校
解题方法
2 . 关于反应 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A. 既是氧化剂又是还原剂 既是氧化剂又是还原剂 | B.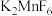 是氧化产物 是氧化产物 |
| C.氧化剂与还原剂的物质的量之比为3:2 | D.生成1mol ,转移2mol电子 ,转移2mol电子 |
您最近一年使用:0次
2023-12-02更新
|
111次组卷
|
3卷引用:辽宁省丹东市凤城市第一中学2023-2024学年高三上学期10月测试化学试题
名校
解题方法
3 . 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:下列说法正确的是


| A.反应Ⅰ中元素As被氧化 |
B.反应Ⅱ中,只有 是氧化产物 是氧化产物 |
C.反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ>Ⅱ :Ⅰ>Ⅱ |
D.反应Ⅰ、Ⅱ中,氧化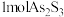 消耗 消耗 的物质的量之比为 的物质的量之比为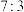 |
您最近一年使用:0次
2023-12-01更新
|
68次组卷
|
3卷引用:湖南衡阳名校2024届高三一轮复习12月第2周周练 化学试题
名校
解题方法
4 . 氮化硅( )陶瓷材料可应用于原子反应堆。氮化硅可由下列反应制得:
)陶瓷材料可应用于原子反应堆。氮化硅可由下列反应制得: 。已知:
。已知: 中
中 元素的化合价为-3。
元素的化合价为-3。
回答下列问题:
(1)上述反应涉及的物质中属于氧化物的是___________ (填化学式)。碳元素存在多种单质,其中金刚石和石墨是应用最广泛的两种,它们互为___________ 。
(2)该反应的氧化剂是___________ (填化学式,下同),被氧化的物质是___________ ,氧化产物与还原产物的质量之比为___________ 。
(3)用双线桥法标出上述反应中电子转移的方向和数目:___________ 。
(4)若生成标准状况下 ,则反应过程中转移
,则反应过程中转移___________ 电子。
 )陶瓷材料可应用于原子反应堆。氮化硅可由下列反应制得:
)陶瓷材料可应用于原子反应堆。氮化硅可由下列反应制得: 。已知:
。已知: 中
中 元素的化合价为-3。
元素的化合价为-3。回答下列问题:
(1)上述反应涉及的物质中属于氧化物的是
(2)该反应的氧化剂是
(3)用双线桥法标出上述反应中电子转移的方向和数目:
(4)若生成标准状况下
 ,则反应过程中转移
,则反应过程中转移
您最近一年使用:0次
2023-11-28更新
|
113次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
名校
5 . 2019年起,新型冠状病毒肺炎疫情在全球多地爆发,“84消毒液”是大规模环境消毒剂。已知某84消毒液瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)下列说法不正确的是___________
(2)该“84消毒液”的物质的量浓度约为___________  (保留一位小数)
(保留一位小数)
(3)该同学参阅该“84消毒液”的配方,欲用 固体配制
固体配制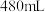 含
含 质量分数为25%的消毒液。需用托盘天平称取
质量分数为25%的消毒液。需用托盘天平称取 固体
固体___________ g
(4)请将下列各操作按正确的顺序将字母代号填写在横线上___________
A.用托盘天平称取 固体
固体
B.塞好瓶塞。反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的 固体置于烧杯中,加适量蒸馏水溶解完全
固体置于烧杯中,加适量蒸馏水溶解完全
(5)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是___________。
(6)已知 常温下为黄色气体,易溶于水,其水溶液类似于
常温下为黄色气体,易溶于水,其水溶液类似于 具有强氧化性,故也可作为一种广谱杀菌剂。一种有效成分为
具有强氧化性,故也可作为一种广谱杀菌剂。一种有效成分为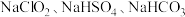 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,产生“气泡”的化学方程式为
溶液。上述过程中,产生“气泡”的化学方程式为___________ ;生成 的反应属于歧化反应,
的反应属于歧化反应,  在酸性条件下生成的另外一种含氮物质为
在酸性条件下生成的另外一种含氮物质为 ,则每消耗
,则每消耗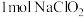 ,生成的
,生成的 分子数为
分子数为___________
| 84消毒液 (有效成分)  (规格) 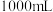 (质量分数)25% (密度)  |
A.“84消毒液”的有效成分是 |
| B.“洁厕灵”(主要成分为盐酸)与“84消毒液”混用效果更好 |
C.检验该消毒液中是否含有 的原理为: 的原理为: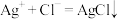 |
| D.盛装“84消毒液”的瓶子瓶盖忘盖,长时间后可能失效 |
 (保留一位小数)
(保留一位小数)(3)该同学参阅该“84消毒液”的配方,欲用
 固体配制
固体配制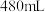 含
含 质量分数为25%的消毒液。需用托盘天平称取
质量分数为25%的消毒液。需用托盘天平称取 固体
固体(4)请将下列各操作按正确的顺序将字母代号填写在横线上
A.用托盘天平称取
 固体
固体B.塞好瓶塞。反复颠倒摇匀,装瓶,贴标签
C.加蒸馏水至离容量瓶瓶颈刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线
D.用适量蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液一并转入容量瓶,并轻摇容量瓶使其混匀
E.待溶液冷却至室温,再将溶液转入容量瓶
F.将已称量的
 固体置于烧杯中,加适量蒸馏水溶解完全
固体置于烧杯中,加适量蒸馏水溶解完全(5)若所配制的次氯酸钠溶液的物质的量浓度偏小,则下列可能的原因分析中正确的是___________。
| A.配制前,容量瓶中有少量蒸馏水 | B.洗涤液未转移到容量瓶中 |
| C.未经冷却立即转液 | D.定容时,仰视溶液的凹液面 |
 常温下为黄色气体,易溶于水,其水溶液类似于
常温下为黄色气体,易溶于水,其水溶液类似于 具有强氧化性,故也可作为一种广谱杀菌剂。一种有效成分为
具有强氧化性,故也可作为一种广谱杀菌剂。一种有效成分为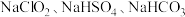 的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到
的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到 溶液。上述过程中,产生“气泡”的化学方程式为
溶液。上述过程中,产生“气泡”的化学方程式为 的反应属于歧化反应,
的反应属于歧化反应,  在酸性条件下生成的另外一种含氮物质为
在酸性条件下生成的另外一种含氮物质为 ,则每消耗
,则每消耗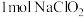 ,生成的
,生成的 分子数为
分子数为
您最近一年使用:0次
6 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
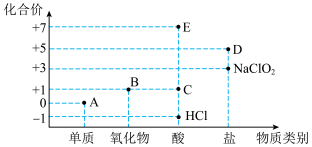
(1)物质E的化学式为___________
(2)A、B、C、D(钾盐)四种物质中,属于电解质的是___________ (填化学式)
(3)A与水反应的离子方程式为___________
(4)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为___________
(5)已知A与氢氧化钠溶液反应生成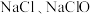 和
和 的混合物,若
的混合物,若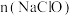 与
与 之比为2:3,则氧化剂与还原剂的物质的量之比为
之比为2:3,则氧化剂与还原剂的物质的量之比为___________
(6)已知二氧化氯( )为高效无毒的消毒剂,实际消毒效果比物质A要好。在室温及标准大气压的条件下,等物质的量的
)为高效无毒的消毒剂,实际消毒效果比物质A要好。在室温及标准大气压的条件下,等物质的量的 和物质A比较,所含的原子总数之比为
和物质A比较,所含的原子总数之比为___________ ,电子数目之比为___________ 。
(7)氯碱工业指的是工业上用电解饱和食盐水的方法,制取氯气和烧碱等主要产品,在国民经济和国防建设中占有重要地位。请写出氯化钠溶液在通电条件下,发生反应的离子方程式___________ 。

(1)物质E的化学式为
(2)A、B、C、D(钾盐)四种物质中,属于电解质的是
(3)A与水反应的离子方程式为
(4)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为
(5)已知A与氢氧化钠溶液反应生成
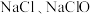 和
和 的混合物,若
的混合物,若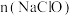 与
与 之比为2:3,则氧化剂与还原剂的物质的量之比为
之比为2:3,则氧化剂与还原剂的物质的量之比为(6)已知二氧化氯(
 )为高效无毒的消毒剂,实际消毒效果比物质A要好。在室温及标准大气压的条件下,等物质的量的
)为高效无毒的消毒剂,实际消毒效果比物质A要好。在室温及标准大气压的条件下,等物质的量的 和物质A比较,所含的原子总数之比为
和物质A比较,所含的原子总数之比为(7)氯碱工业指的是工业上用电解饱和食盐水的方法,制取氯气和烧碱等主要产品,在国民经济和国防建设中占有重要地位。请写出氯化钠溶液在通电条件下,发生反应的离子方程式
您最近一年使用:0次
7 . 次氯酸钠具有强氧化性,强碱性溶液中可将Fe3+氧化为一种常见的高效水处理剂,离子方程式为2Fe(OH)3+3ClO−+4OH−=2FeO +3Cl−+5H2O。下列说法中
+3Cl−+5H2O。下列说法中错误 的是
 +3Cl−+5H2O。下列说法中
+3Cl−+5H2O。下列说法中| A.还原性:Fe(OH)3>Cl− |
| B.由反应可知每2molFe(OH)3完全反应时,反应中转移6mol电子 |
| C.Na2FeO4能杀菌消毒,是由于它有强氧化性 |
| D.反应中氧化剂与还原剂的物质的量之比为2:3 |
您最近一年使用:0次
2023-11-16更新
|
766次组卷
|
7卷引用:辽宁省辽东南协作校2023-2024学年高三上学期12月月考化学(A卷)试题
解题方法
8 . 油画中使用的无机颜料雄黄(As2S3)在不同空气湿度和光照条件下会发生褪色,主要发生以下两种化学反应:

(1)紫外光照射下,被氧化的元素是___________ (填元素符号),每生成 ,转移电子的物质的量为
,转移电子的物质的量为___________ mol。
(2)自然光照射下发生反应的化学方程式:___________ 。
(3)氧化等量 时,紫外光与自然光照射下消耗
时,紫外光与自然光照射下消耗 的物质的量之比为
的物质的量之比为___________ 。
(4) 和
和 按物质的量之比为2:1混合后加热,向溶液中通入
按物质的量之比为2:1混合后加热,向溶液中通入 即可获得
即可获得 和
和 ,该反应的离子方程式:
,该反应的离子方程式:___________ 。上述过程一般在碱性环境下进行,若在酸性条件下由于生成副产物___________ 导致产品会发黄。
(5)芯片制造工业中利用 与
与 反应,将As氧化为+5价,该反应的氧化剂与还原剂物质的量之比为
反应,将As氧化为+5价,该反应的氧化剂与还原剂物质的量之比为___________ 。

(1)紫外光照射下,被氧化的元素是
 ,转移电子的物质的量为
,转移电子的物质的量为(2)自然光照射下发生反应的化学方程式:
(3)氧化等量
 时,紫外光与自然光照射下消耗
时,紫外光与自然光照射下消耗 的物质的量之比为
的物质的量之比为(4)
 和
和 按物质的量之比为2:1混合后加热,向溶液中通入
按物质的量之比为2:1混合后加热,向溶液中通入 即可获得
即可获得 和
和 ,该反应的离子方程式:
,该反应的离子方程式:(5)芯片制造工业中利用
 与
与 反应,将As氧化为+5价,该反应的氧化剂与还原剂物质的量之比为
反应,将As氧化为+5价,该反应的氧化剂与还原剂物质的量之比为
您最近一年使用:0次
名校
9 . 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为Fe(OH)3胶体,制备高铁酸钾流程如下图所示,下列叙述不正确 的是


| A.铁屑在干燥的氯气中发生反应 Ⅰ 时,若铁屑过量,可能生成FeCl2 |
| B.反应 Ⅱ 中氧化剂和还原剂的物质的量之比为3 : 2 |
| C.该条件下,物质的溶解性:Na2FeO4 K2FeO4 |
| D.用K2FeO4 对饮用水杀菌消毒的同时,生成的 Fe(OH)3 胶体可吸附杂质净化水 |
您最近一年使用:0次
2023-11-11更新
|
612次组卷
|
4卷引用:辽宁省沈阳市第十五中学2023-2024学年高一上学期12月月考化学试题
名校
10 . 请回答下列问题
(1)用单线桥表示下列反应的电子转移_______

(2)配平下列反应
①_______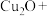 _______
_______ _______
_______ _______
_______ _______
_______ ;
;_______
②_______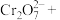 _______
_______ _______
_______ _______
_______ _______
_______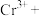 _______
_______ ;
;_____
③湿法制备高铁酸钾的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
。碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_______
(3)某消毒小组人员用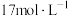 的浓硫酸配制
的浓硫酸配制 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为_______ mL;所配溶液中的 的物质的量浓度为
的物质的量浓度为_______ 。
(4)如图所示,气缸的总体积一定,内部被活塞隔成Ⅰ、Ⅱ两部分,活塞可以自由移动,也可以固定。0℃时向Ⅰ中充入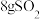 ,Ⅱ中充入
,Ⅱ中充入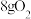 ,则当活塞不再移动时,Ⅰ、Ⅱ两部分体积比为
,则当活塞不再移动时,Ⅰ、Ⅱ两部分体积比为_______ 。

(1)用单线桥表示下列反应的电子转移

(2)配平下列反应
①_______
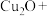 _______
_______ _______
_______ _______
_______ _______
_______ ;
;②_______
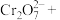 _______
_______ _______
_______ _______
_______ _______
_______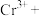 _______
_______ ;
;③湿法制备高铁酸钾的反应体系中有六种微粒:
 、
、 、
、 、
、 、
、 、
、 。碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
。碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:(3)某消毒小组人员用
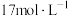 的浓硫酸配制
的浓硫酸配制 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为 的物质的量浓度为
的物质的量浓度为(4)如图所示,气缸的总体积一定,内部被活塞隔成Ⅰ、Ⅱ两部分,活塞可以自由移动,也可以固定。0℃时向Ⅰ中充入
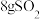 ,Ⅱ中充入
,Ⅱ中充入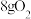 ,则当活塞不再移动时,Ⅰ、Ⅱ两部分体积比为
,则当活塞不再移动时,Ⅰ、Ⅱ两部分体积比为
您最近一年使用:0次



