名校
解题方法
1 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
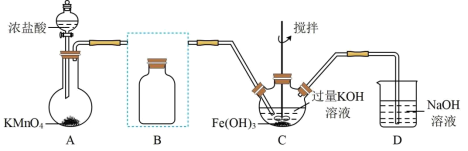
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近半年使用:0次
名校
2 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
I.制备 (夹持装置略)
(夹持装置略)
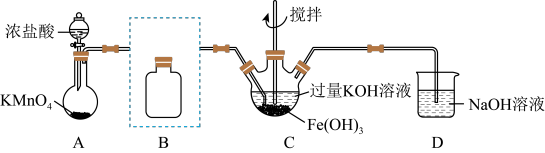
(1)A为氯气发生装置。 中反应的离子方程式是
中反应的离子方程式是_______
(2)B装置盛有饱和 溶液,
溶液, 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中制备高铁酸钾的化学反应方程式为
中制备高铁酸钾的化学反应方程式为_______
II.探究 的性质
的性质
(3)取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。
。
为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
由方案Ⅰ可知 中含有
中含有 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由_______ 产生,(用离子方程式表示)。
(4)根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是_______ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。I.制备
 (夹持装置略)
(夹持装置略)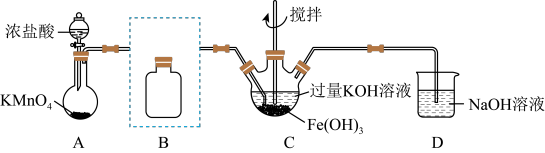
(1)A为氯气发生装置。
 中反应的离子方程式是
中反应的离子方程式是(2)B装置盛有饱和
 溶液,
溶液, 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中制备高铁酸钾的化学反应方程式为
中制备高铁酸钾的化学反应方程式为II.探究
 的性质
的性质(3)取
 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。
。为证明是否
 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,经过检验溶液中含有 。 。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。 产生。 |
 中含有
中含有 离子,但该离子的产生不能判断一定是
离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由(4)根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因可能是
的氧化性强弱关系相反,原因可能是
您最近半年使用:0次
2023-01-22更新
|
583次组卷
|
3卷引用:吉林省长春市东北师大附属中学2022-2023学年高一上学期期末考试化学试题
名校
3 . 高铁酸钾 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
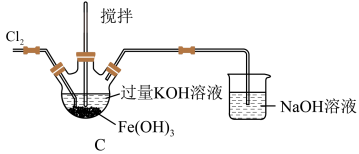
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为___________ (并用双线桥表示电子转移),C中 发生的反应还有
发生的反应还有___________ 。(用离子方程式表示)
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:
方案一:取少量a,经测定含有
方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。
①由方案一中可知a中含有 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由___________ 产生(文字描述)。
②方案二中要用KOH溶液充分洗涤所得固体的原因是___________ 。
③根据 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是___________ 。
(3)高铁酸钾水处理原理如图所示。
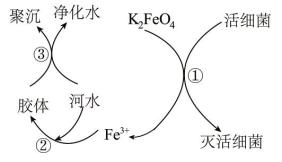
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了___________ (填“氧化”或“还原”)性,该过程的还原产物是___________ (填离子符号);过程③属于___________ (填“物理”或“化学”)变化。
②根据上述原理分析,作水处理剂时, 的作用有
的作用有___________ 。(填两个)
 是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
是一种高效多功能的新型绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 :
:
(1)C中得到紫色固体和溶液,写出得到紫色固体的化学方程式为
 发生的反应还有
发生的反应还有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:方案一:取少量a,经测定含有

方案二:用KOH溶液充分洗涤C中所得固体,再用KOH溶液将
 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。
产生。①由方案一中可知a中含有
 ,但该离子的产生不能判断一定是
,但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由②方案二中要用KOH溶液充分洗涤所得固体的原因是
③根据
 的制备实验得出:氧化性
的制备实验得出:氧化性 大于
大于 ,而方案二实验中
,而方案二实验中 和
和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是(3)高铁酸钾水处理原理如图所示。

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
①过程①中活细菌表现了
②根据上述原理分析,作水处理剂时,
 的作用有
的作用有
您最近半年使用:0次
4 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
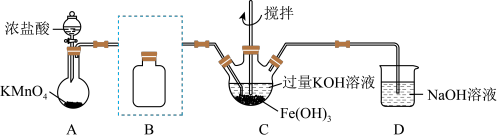
①A为氯气发生装置,写出A中反应的离子反应方程式,并用单线桥表示电子转移_______ 。
②将除杂装置B补充完整;并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中 发生的反应有
发生的反应有_______ 、_______ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案I中溶液变红可知a中含有_______ 离子,但该离子的产生不能判断一定 将
将 氧化,还可能由
氧化,还可能由_______ 产生(用离子方程式表示)。
ii.方案II可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是_______ 。
根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>””或“<”),而方案II实验表明,
(填“>””或“<”),而方案II实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
①A为氯气发生装置,写出A中反应的离子反应方程式,并用单线桥表示电子转移
②将除杂装置B补充完整;并标明所用试剂
③C中得到紫色固体和溶液。C中
 发生的反应有
发生的反应有(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案I | 取少量a,滴加 溶液至过量,溶液呈红色 溶液至过量,溶液呈红色 |
| 方案II | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 溶出,得到紫色溶液b,取少量b,滴加盐酸,有 产生。 产生。 |
 将
将 氧化,还可能由
氧化,还可能由ii.方案II可证明
 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>””或“<”),而方案II实验表明,
(填“>””或“<”),而方案II实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近半年使用:0次
5 . 利用图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为______ ;丁属于______ (“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是_____ (填化学式);根据氯元素的化合价判断,乙物质的性质______ (填标号)。
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为:甲+H2O 己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是_____ 。
(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为_____ 。NaClO溶液中显碱性原因:______ (用离子方程式表示)。
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为______ 。

(1)丙的化学式为
(2)图中甲、乙、丁、戊中,属于电解质的是
a.只有氧化性 b.既有氧化性又有还原性 c.只有还原性
(3)物质己的化学式为HClO4,电解甲溶液制备己的化学反应为:甲+H2O
 己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是
己+H2↑(未配平),配平后参与反应的甲与H2O的微粒个数之比是(4)庚是家庭中常用消毒液的有效成分NaClO,用乙制取庚的化学方程式为
(5)辛在MnO2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e-的个数为
您最近半年使用:0次
解题方法
6 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)实验室制Cl2的反应中,浓盐酸所起的作用有_______ (填序号)。
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为_______ (用离子方程式表示,)。
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
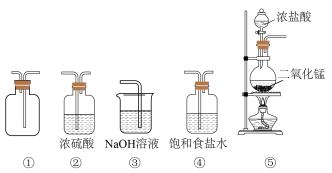
A.上述仪器的正确顺序(用序号表示):_______ ;
B.②装置中,浓硫酸的作用是_______ ;
C.⑤装置中发生反应的离子方程式为:_______ 。
(1)实验室制Cl2的反应中,浓盐酸所起的作用有
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:

A.上述仪器的正确顺序(用序号表示):
B.②装置中,浓硫酸的作用是
C.⑤装置中发生反应的离子方程式为:
您最近半年使用:0次
2023-02-10更新
|
62次组卷
|
2卷引用:新疆可克达拉镇江高级中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
7 . 高铁酸钾 为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备
为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
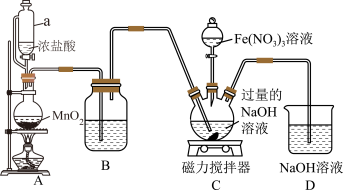
(1)装置A为 的发生装置,写出发生反应的离子方程式:
的发生装置,写出发生反应的离子方程式:________ 。
(2)装置B中盛装的液体是________ ,其作用为________ 。
(3)先向装置C的三颈烧瓶中通入一段时间的 制备NaClO,再滴加
制备NaClO,再滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为________ 。
(4)向装置C中通入的 不能过量,原因是
不能过量,原因是________ 。
(5)写出D中发生反应的离子方程式:________ 。
(6)高铁酸钾 是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成
是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成 胶体,高铁酸钾用作水处理剂的理由是
胶体,高铁酸钾用作水处理剂的理由是________ 。
 为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备
为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,易溶于水,在KOH浓溶液中溶解度较低,在酸性或中性溶液中不稳定,在碱性溶液中较稳定且碱性越强越稳定。某实验小组设计如图装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(1)装置A为
 的发生装置,写出发生反应的离子方程式:
的发生装置,写出发生反应的离子方程式:(2)装置B中盛装的液体是
(3)先向装置C的三颈烧瓶中通入一段时间的
 制备NaClO,再滴加
制备NaClO,再滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为(4)向装置C中通入的
 不能过量,原因是
不能过量,原因是(5)写出D中发生反应的离子方程式:
(6)高铁酸钾
 是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成
是一种新型综合型的水处理剂。高铁酸钾具有强氧化性,在净水过程中可生成 胶体,高铁酸钾用作水处理剂的理由是
胶体,高铁酸钾用作水处理剂的理由是
您最近半年使用:0次
名校
解题方法
8 . 氯气在工业生产中有重要的用途。某课外活动小组利用下列装置在实验室中制备氯气,并进行有关氯气性质的研究。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集干燥纯净的氯气。
①写出实验室制氯气的化学方程式:____ ;浓盐酸在反应中体现了____ (填编号)的性质。
A.酸性 B.氧化性 C.还原性 D.不稳定性
②选择装置,将各仪器按先后顺序连接起来,应该是a接_____,_____接_____,_____接_____,_____接h(用导管口处的字母表示)。____
(2)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。

①G中的现象是_____ ,原因是_____ (用化学方程式表示)。
②H中的现象是____ ,I中发生的离子反应方程式为____ 。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集干燥纯净的氯气。
①写出实验室制氯气的化学方程式:
A.酸性 B.氧化性 C.还原性 D.不稳定性
②选择装置,将各仪器按先后顺序连接起来,应该是a接_____,_____接_____,_____接_____,_____接h(用导管口处的字母表示)。
(2)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。

①G中的现象是
②H中的现象是
您最近半年使用:0次
解题方法
9 .  溶液和84消毒液是生活中常用的两种消毒剂。请回答下列问题:
溶液和84消毒液是生活中常用的两种消毒剂。请回答下列问题:
(1)某同学设计如下实验研究 的性质:
的性质:
①理论上 既有氧化性又有还原性,具有还原性的原因是
既有氧化性又有还原性,具有还原性的原因是_______ 。
②能证明 具有还原性的是实验
具有还原性的是实验_______ (填序号)。
(2)84消毒液的有效成分为 。
。
①NaClO中Cl元素的化合价是_______ 。
②84消毒液不能用于钢制器具的消毒,原因是 具有
具有_______ 性。
③84消毒液吸收空气中的 ,其消毒杀菌能力增强,该过程中发生反应的化学方程式为
,其消毒杀菌能力增强,该过程中发生反应的化学方程式为_______ 。
(3)漂白粉在社会生活、工业生产中用途广泛。漂白粉除了具有漂白作用外,还能杀菌、消毒。
已知漂白粉溶于水后加入少量的酸能增强漂白效果。某同学据此将少量漂白粉溶于水后,再加入浓盐酸,观察到有黄绿色气体生成。回答下列问题:
①生成黄绿色气体的化学方程式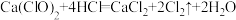 ,用双线桥表示反应电子转移方向和数目:
,用双线桥表示反应电子转移方向和数目:_______ 。
②家庭生活中常使用“84”消毒液进行消毒。这种消毒液和某品牌洁厕净(主要成分为盐酸)_______ (填“能”或“不能”)同时使用,其原因是_______ 。
 溶液和84消毒液是生活中常用的两种消毒剂。请回答下列问题:
溶液和84消毒液是生活中常用的两种消毒剂。请回答下列问题:(1)某同学设计如下实验研究
 的性质:
的性质:| 实验 | 操作 | 现象 |
| i | 向5% 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ii | 向5% 溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 既有氧化性又有还原性,具有还原性的原因是
既有氧化性又有还原性,具有还原性的原因是②能证明
 具有还原性的是实验
具有还原性的是实验(2)84消毒液的有效成分为
 。
。①NaClO中Cl元素的化合价是
②84消毒液不能用于钢制器具的消毒,原因是
 具有
具有③84消毒液吸收空气中的
 ,其消毒杀菌能力增强,该过程中发生反应的化学方程式为
,其消毒杀菌能力增强,该过程中发生反应的化学方程式为(3)漂白粉在社会生活、工业生产中用途广泛。漂白粉除了具有漂白作用外,还能杀菌、消毒。
已知漂白粉溶于水后加入少量的酸能增强漂白效果。某同学据此将少量漂白粉溶于水后,再加入浓盐酸,观察到有黄绿色气体生成。回答下列问题:
①生成黄绿色气体的化学方程式
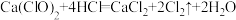 ,用双线桥表示反应电子转移方向和数目:
,用双线桥表示反应电子转移方向和数目:②家庭生活中常使用“84”消毒液进行消毒。这种消毒液和某品牌洁厕净(主要成分为盐酸)
您最近半年使用:0次
名校
解题方法
10 . 瑞典化学家舍勒是最早发现氯气的人,他在研究软锰矿矿石(主要成分是二氧化锰)时,把浓盐酸和软锰矿矿石混合加热,意外地得到了氯气。至今,实验室中还用这种方法制取氯气,装置如图所示,化学反应方程式为: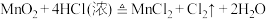
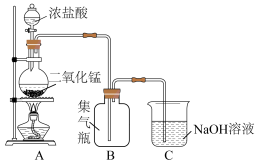
回答下列问题:
(1)实验室制取 的反应中,浓盐酸表现
的反应中,浓盐酸表现_________ (填“氧化性”、“还原性”或“酸性”)。
(2)请用单线桥表示该反应中电子转移的方向和数目_________ 。
(3)标况下,若生成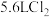 ,则转移电子的数目为
,则转移电子的数目为_________ 。
(4)装置C可吸收多余的 ,生成
,生成 和
和 ,写出离子方程式
,写出离子方程式_________ 。所用 溶液一般为
溶液一般为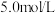 ,用
,用 固体配制
固体配制 该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、
该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、_________ 。
(5) 有强氧化性,某实验小组为探究
有强氧化性,某实验小组为探究 、
、 、
、 在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下
在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下 、
、 、
、 的氧化性由弱到强的顺序是
的氧化性由弱到强的顺序是_________ 。
(6)装置C中也可能生成 ,
, 和浓盐酸也可以制备
和浓盐酸也可以制备 ,试写出离子方程式
,试写出离子方程式_________ 。
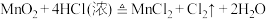

回答下列问题:
(1)实验室制取
 的反应中,浓盐酸表现
的反应中,浓盐酸表现(2)请用单线桥表示该反应中电子转移的方向和数目
(3)标况下,若生成
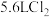 ,则转移电子的数目为
,则转移电子的数目为(4)装置C可吸收多余的
 ,生成
,生成 和
和 ,写出离子方程式
,写出离子方程式 溶液一般为
溶液一般为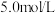 ,用
,用 固体配制
固体配制 该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、
该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、(5)
 有强氧化性,某实验小组为探究
有强氧化性,某实验小组为探究 、
、 、
、 在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下
在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下 、
、 、
、 的氧化性由弱到强的顺序是
的氧化性由弱到强的顺序是(6)装置C中也可能生成
 ,
, 和浓盐酸也可以制备
和浓盐酸也可以制备 ,试写出离子方程式
,试写出离子方程式
您最近半年使用:0次



