1 . 已知分解1molH2O2放出热最98kJ,在含少量I-的溶液中,H2O2分解的机理为:
反应Ⅰ:H2O2(aq)+I-(aq)→H2O(l)+IO-(aq) 慢反应 ΔH1
反应Ⅱ:H2O2(aq)+IO-(aq)→H2O(l)+O2(g)+I-(aq) 快反应 ΔH2
下列有关该反应的说法正确的是( )
反应Ⅰ:H2O2(aq)+I-(aq)→H2O(l)+IO-(aq) 慢反应 ΔH1
反应Ⅱ:H2O2(aq)+IO-(aq)→H2O(l)+O2(g)+I-(aq) 快反应 ΔH2
下列有关该反应的说法正确的是( )
| A.H2O2分解产生O2的速率反应Ⅱ决定 |
| B.I-和IO-在反应过程中充当催化剂 |
| C.ΔH1+ΔH2=−196 kJ·mol−1 |
| D.反应Ⅰ活化能Ea1与反应Ⅱ活化能Ea2数值上相差98kJ/mol |
您最近一年使用:0次
2020-04-06更新
|
646次组卷
|
7卷引用:浙江省宁波十校2020届高三3月联考化学试题
浙江省宁波十校2020届高三3月联考化学试题(已下线)第八单元 化学反应与能量测试题-2021年高考化学一轮复习名师精讲练河北省保定市定州市第二中学2023-2024学年高二上学期2月期末化学试题(已下线)2022年湖南卷高考真题变式题(1-10)浙江省宁波五校2022-2023学年高二上学期11月期中考试化学试题河北省保定市定州中学2023-2024学年高二上学期9月月考化学试题浙江省嘉兴八校2023-2024学年高二上学期11月期中联考化学试题
名校
2 . 低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是一个重要研究方向, 既可变废为宝,又可减少碳的排放。工业上可用CO2和H2制备被誉为“21世纪的清洁燃料”二甲醚(CH3OCH3):
如在500℃时,在密闭容器中将炼焦中的CO2转化为二甲醚,其相关反应为:
主反应I:2CO2 (g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH1
CH3OCH3(g)+3H2O(g) ΔH1
副反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
(1)已知:①CO(g)+2H2(g)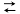 CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol
②2CH3OH(g)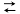 CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
③CO(g)+H2O(g)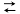 CO2(g)+H2(g) H= -41.0kJ/mol
CO2(g)+H2(g) H= -41.0kJ/mol
则主反应I的ΔH1=______ 。
(2)在一定温度下某密闭容器中按CO2和H2的浓度比为1∶3投料进行反应,测得不同时间段部分物质的浓度如下表:
①10-20min内,CH3OCH3的平均反应速率v(CH3OCH3)=_______ 。
②根据以上数据计算主反应I的平衡常数K=______ (列式,代入数据,不计算结果)。
(3)欲提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是_______ 。
(4)对于反应II,温度对CO2的转化率及催化剂的效率影响如图所示:下列有关说法不正确的是_______ 。
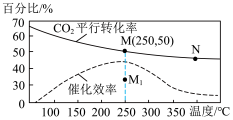
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于Ml
B.温度低于250°C时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化
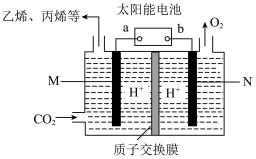
(5)利用太阳能电池将CO2转化为乙烯、丙烯等有机化工原料,其工作原理如图所示。则a为太阳能电池的_______ 极,写M极上生成丙烯的电极反应式为_________ 。
如在500℃时,在密闭容器中将炼焦中的CO2转化为二甲醚,其相关反应为:
主反应I:2CO2 (g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH1
CH3OCH3(g)+3H2O(g) ΔH1副反应II:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2(1)已知:①CO(g)+2H2(g)
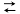 CH3OH(g) ΔH=-90.1kJ/mol
CH3OH(g) ΔH=-90.1kJ/mol②2CH3OH(g)
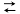 CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-24.5kJ/mol③CO(g)+H2O(g)
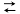 CO2(g)+H2(g) H= -41.0kJ/mol
CO2(g)+H2(g) H= -41.0kJ/mol则主反应I的ΔH1=
(2)在一定温度下某密闭容器中按CO2和H2的浓度比为1∶3投料进行反应,测得不同时间段部分物质的浓度如下表:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| H2 | 1.00mol/L | 0.68 mol/L | 0.40 mol/L | 0.30 mol/L | 0.30 mol/L |
| CH3OCH3 | 0 mol/L | 0.05 mol/L | 0.08 mol/L | 0.10 mol/L | 0.10 mol/L |
①10-20min内,CH3OCH3的平均反应速率v(CH3OCH3)=
②根据以上数据计算主反应I的平衡常数K=
(3)欲提高CH3OCH3产率的关键的因素是选用合适的催化剂,其原因是
(4)对于反应II,温度对CO2的转化率及催化剂的效率影响如图所示:下列有关说法不正确的是

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于Ml
B.温度低于250°C时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化
(5)利用太阳能电池将CO2转化为乙烯、丙烯等有机化工原料,其工作原理如图所示。则a为太阳能电池的

您最近一年使用:0次
2020-04-01更新
|
271次组卷
|
4卷引用:广东省中山市2019-2020学年高三上学期期末统考化学试题
广东省中山市2019-2020学年高三上学期期末统考化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(七)天津地区2021届高三上学期期中考试模拟测化学试题陕西省西安中学2022届高三下学期第五次模拟考试理科综合化学试题
11-12高三上·上海长宁·期末
解题方法
3 . 多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
(1)SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为_____________________________________ 。
(2)SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为
4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为___ kg。
(3)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4→ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O据此,从下列所给仪器装置中选择制备并收集H2的装置
MnCl2+Cl2↑+2H2O据此,从下列所给仪器装置中选择制备并收集H2的装置_______ (填代号)和制备并收集干燥、纯净Cl2的装置_________ (填代号)。
可选用制备气体的装置:

(4)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气______ 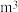 (标准状况)。(忽略可能存在的其他反应)
(标准状况)。(忽略可能存在的其他反应)
(1)SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
(2)SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3 SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为
4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为(3)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4→ZnSO4+H2↑;MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O据此,从下列所给仪器装置中选择制备并收集H2的装置
MnCl2+Cl2↑+2H2O据此,从下列所给仪器装置中选择制备并收集H2的装置可选用制备气体的装置:

(4)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
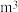 (标准状况)。(忽略可能存在的其他反应)
(标准状况)。(忽略可能存在的其他反应)
您最近一年使用:0次
名校
解题方法
4 . (1)写出COS的电子式__________________ ,C与O形成共价键时,共用电子对会偏向__________ 原子,判断依据是___________ 。
(2)已知COS(g)+H2O(g) H2S(g)+CO2(g) △H1=-34kJ/mol
H2S(g)+CO2(g) △H1=-34kJ/mol
CO(g)+H2O(g) H2(g)+CO2(g) △H2=-41kJ/mol
H2(g)+CO2(g) △H2=-41kJ/mol
写出H2S与CO反应生成COS的热化学方程式__________________________________ 。
100℃时将CO与H2S按物质的量比为1∶1充入反应器中,达平衡后CO的转化率α=33.3%,此时反应的平衡常数k=________________________ 。
(3)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。
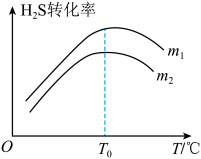
①m1________ m2(填>、<或=)
②温度高于T0时,H2S转化率减小的可能原因为_________
a.反应停止了 b.反应的△H变大
c.反应达到平衡 d.催化剂活性降低
(2)已知COS(g)+H2O(g)
 H2S(g)+CO2(g) △H1=-34kJ/mol
H2S(g)+CO2(g) △H1=-34kJ/molCO(g)+H2O(g)
 H2(g)+CO2(g) △H2=-41kJ/mol
H2(g)+CO2(g) △H2=-41kJ/mol 写出H2S与CO反应生成COS的热化学方程式
100℃时将CO与H2S按物质的量比为1∶1充入反应器中,达平衡后CO的转化率α=33.3%,此时反应的平衡常数k=
(3)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。

①m1
②温度高于T0时,H2S转化率减小的可能原因为
a.反应停止了 b.反应的△H变大
c.反应达到平衡 d.催化剂活性降低
您最近一年使用:0次
2020-03-28更新
|
808次组卷
|
2卷引用:北京市平谷区2020届高三第一次模拟考试化学试题
名校
解题方法
5 . 氨气是一种重要的化工产品。
(1)工业中用氯气和氢气在一定条件下合成氨气,有关方程式如下: 3H2 (g)+N2(g)⇌2NH3 (g) + 92.4 kJ
①对于该反应:要使反应物尽可能快的转化为氨气,可采用的反应条件是__________ ,要使反应物尽可能多的转化为氨气,可采用的反应条件是__________ :(均选填字母)
A.较高温度B.较低温度C.较高压强 D.较低压强 E.使用合适的催化剂
工业上对合成氨适宜反应条件选择,是综合考虑了化学反应速率、化学平衡和设备材料等的影响。
②该反应达到平衡后,只改变其中一个因素,以下分析中不正确的是_______ :(选填字母)
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小生成物浓度,对逆反应的反应速率影响更大
③某化工厂为了综合利用生产过程中副产品CaSO4,和相邻的合成氨厂联合设计了制备(NH4)2SO4的工艺流程(如图),该流程中:

向沉淀池中通入足量的氨气的目的是______________________________ ,可以循环使用的X是_______________ 。(填化学式)
(2)实验室中可以用铵盐与强碱共热得到氨气。有关的离子方程式为_____________________ 。
①0.01 mol/L硝酸铵溶液0.5L,与足量的氢氧化钠溶液共热,可产生氨气_____ L(标准状态)。
②若有硝酸铵和硫酸铵的混合溶液0.5L,与足量的氢氧化钠溶液共热,可产生氨气0.025mol;在反应后的溶液中加入足量的氯化钡溶液,产生0.01 mol 白色沉淀,则原混合液中,硝酸铵的浓度为_______ mol/L。
③现有硝酸铵、氯化铵和硫酸铵的混合溶液V L,将混合溶液分成两等分:一份溶液与足量的氢氧化钠溶液共热,共产生氨气A mol;另一份溶液中慢慢滴入C mol/L的氯化钡溶液B L,溶液中SO42-恰好全部沉淀;将沉淀过滤后,在滤液中继续滴入硝酸银溶液至过量,又产生D mol沉淀。则原混合溶液中,氯化铵的浓度为________ mol/L,硝酸铵的浓度为_______ mol/L。(用含有字母的代数式表示)
(1)工业中用氯气和氢气在一定条件下合成氨气,有关方程式如下: 3H2 (g)+N2(g)⇌2NH3 (g) + 92.4 kJ
①对于该反应:要使反应物尽可能快的转化为氨气,可采用的反应条件是
A.较高温度B.较低温度C.较高压强 D.较低压强 E.使用合适的催化剂
工业上对合成氨适宜反应条件选择,是综合考虑了化学反应速率、化学平衡和设备材料等的影响。
②该反应达到平衡后,只改变其中一个因素,以下分析中不正确的是
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小生成物浓度,对逆反应的反应速率影响更大
③某化工厂为了综合利用生产过程中副产品CaSO4,和相邻的合成氨厂联合设计了制备(NH4)2SO4的工艺流程(如图),该流程中:

向沉淀池中通入足量的氨气的目的是
(2)实验室中可以用铵盐与强碱共热得到氨气。有关的离子方程式为
①0.01 mol/L硝酸铵溶液0.5L,与足量的氢氧化钠溶液共热,可产生氨气
②若有硝酸铵和硫酸铵的混合溶液0.5L,与足量的氢氧化钠溶液共热,可产生氨气0.025mol;在反应后的溶液中加入足量的氯化钡溶液,产生0.01 mol 白色沉淀,则原混合液中,硝酸铵的浓度为
③现有硝酸铵、氯化铵和硫酸铵的混合溶液V L,将混合溶液分成两等分:一份溶液与足量的氢氧化钠溶液共热,共产生氨气A mol;另一份溶液中慢慢滴入C mol/L的氯化钡溶液B L,溶液中SO42-恰好全部沉淀;将沉淀过滤后,在滤液中继续滴入硝酸银溶液至过量,又产生D mol沉淀。则原混合溶液中,氯化铵的浓度为
您最近一年使用:0次
名校
解题方法
6 . 在接触法制硫酸和合成氨工业的生产过程中,下列说法错误的是
| A.硫铁矿在燃烧前要粉碎,目的是使硫铁矿充分燃烧,加快反应速率 |
| B.二氧化硫的催化氧化反应的温度控制在450度左右,主要考虑到催化剂V2O5的活性温度 |
| C.吸收塔中用98.3%的浓硫酸代替水吸收SO3,以提高效率 |
| D.工业上为提高反应物N2、H2的转化率和NH3的产量和反应速率,常在合成氨反应达到平衡后再分离氨气 |
您最近一年使用:0次
14-15高三上·上海嘉定·期末
7 . 在工业常用三酸的生产中,共同点是
| A.都发生氧化还原反应 | B.都用廉价的空气作为一种原料 |
| C.都用了催化剂 | D.酸中的氢元素都直接来自于水 |
您最近一年使用:0次
8 .  的生产、应用是一个国家化工水平的重要标志。
的生产、应用是一个国家化工水平的重要标志。
(1)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢 的反应历程如下图所示:
的反应历程如下图所示:
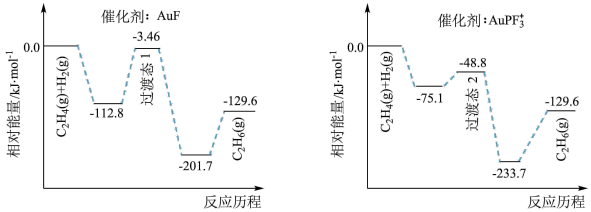
则
____________ ,催化乙烯加氢效果较好的催化剂是________ (选填“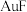 ”或“
”或“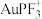 ”)。
”)。
(2) 经催化加氢合成乙烯:
经催化加氢合成乙烯: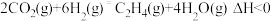 。恒容条件下,按
。恒容条件下,按 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:
①指出图中曲线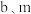 分别表示
分别表示_______ 、________ 的浓度。
②升高温度,平衡常数
_________ (“减小”“增大”或“不变”)。 点,
点,
______ (用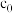 表示)。写出能提高乙烯平衡产率的措施
表示)。写出能提高乙烯平衡产率的措施__________ (任举两种)。
(3)加州理工学院Theodor Agape等在强碱环境下,实现了电催化 制
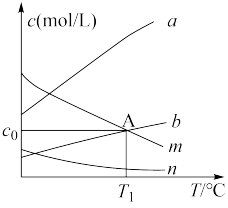
制 ,产物的选择性高达
,产物的选择性高达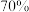 ,
, 转化为
转化为 的电极反应式为
的电极反应式为___________________ 。
 的生产、应用是一个国家化工水平的重要标志。
的生产、应用是一个国家化工水平的重要标志。(1)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢
 的反应历程如下图所示:
的反应历程如下图所示:
则

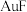 ”或“
”或“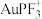 ”)。
”)。(2)
 经催化加氢合成乙烯:
经催化加氢合成乙烯: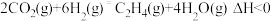 。恒容条件下,按
。恒容条件下,按 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:①指出图中曲线
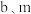 分别表示
分别表示②升高温度,平衡常数

 点,
点,
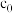 表示)。写出能提高乙烯平衡产率的措施
表示)。写出能提高乙烯平衡产率的措施
(3)加州理工学院Theodor Agape等在强碱环境下,实现了电催化
 制
制 ,产物的选择性高达
,产物的选择性高达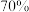 ,
, 转化为
转化为 的电极反应式为
的电极反应式为
您最近一年使用:0次
2020-03-18更新
|
408次组卷
|
3卷引用:湖南省常德市2019-2020学年高三上学期检测考试化学试题
湖南省常德市2019-2020学年高三上学期检测考试化学试题沪科版化学高二拓展性课程3《化学中的平衡》测试题(已下线)本册综合检测(一)——2020-2021学年高二化学选修四同步单元AB卷(人教版)
9 . 用 和
和 的混合溶液可提取废旧印刷电路板中的铜,其热化学方程式为
的混合溶液可提取废旧印刷电路板中的铜,其热化学方程式为 已知:
已知:
①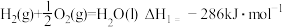
②
③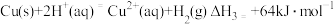
下列说法不正确的是( )
 和
和 的混合溶液可提取废旧印刷电路板中的铜,其热化学方程式为
的混合溶液可提取废旧印刷电路板中的铜,其热化学方程式为 已知:
已知:①
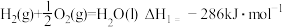
②

③
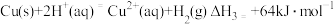
下列说法不正确的是( )
A. |
| B.反应②在任何条件下都能自发进行 |
C.反应③可通过铜作电极电解稀 实现 实现 |
D.已知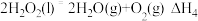 ,则 ,则 |
您最近一年使用:0次
解题方法
10 . 国际社会发出落实《巴黎协定》,推动绿色低碳转型,构建人类命运共同体的积极信号。生态工业和循环经济成为综合解决人类资源、环境和经济发展的一条有效途径。
(1)水是“生命之基质”,是“永远值得探究的物质”。
以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是__ 。
②制备H2O2的总反应方程式是__ 。
(2)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2kJ·mol−1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol−1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性= ×100%
×100%
①温度高于300℃,CO2平衡转化率随温度升高而上升的原因是__ 。
②220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有__ 。
废物再利用。如图装置加以必要的导线连接后达到利用粗铜精炼目的。

①A烧杯是__ (填“电解池”或“原电池”)。
②其中Zn接B烧杯中的__ ,(填“粗铜”或“纯铜”),B烧杯中应该盛__ 溶液。
③分别写出石墨棒和纯铜棒的电极反应式
石墨棒:___ ,
纯铜棒:__ 。
(1)水是“生命之基质”,是“永远值得探究的物质”。
以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是
②制备H2O2的总反应方程式是
(2)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2kJ·mol−1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol−1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=
 ×100%
×100%①温度高于300℃,CO2平衡转化率随温度升高而上升的原因是
②220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
废物再利用。如图装置加以必要的导线连接后达到利用粗铜精炼目的。

①A烧杯是
②其中Zn接B烧杯中的
③分别写出石墨棒和纯铜棒的电极反应式
石墨棒:
纯铜棒:
您最近一年使用:0次



