1 . 氨是重要的化工原料,也是潜在的储氢材料。回答下列问题:
(1)氨的沸点为 ,易液化,工业上常用于做制冷剂,其易液化的主要原因是
,易液化,工业上常用于做制冷剂,其易液化的主要原因是___________ 。
(2)在液氨中制备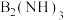 的有机反应如下:
的有机反应如下:
① ;
;
② ;
;
③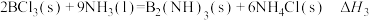 。
。
上述反应中, 、
、 、
、 之间等式关系为
之间等式关系为___________ 。
(3)氨分解制备氢气,反应历程如图所示。

① 的键能为
的键能为___________  。
。
②写出 分解总反应的热化学方程式:
分解总反应的热化学方程式:___________ 。
(4)化学上,把反应物消耗一半所用时间叫作“半衰期”。在恒容密闭容器中充入适量钨和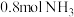 ,实验测得在钨表面氨气分解反应半衰期与温度(
,实验测得在钨表面氨气分解反应半衰期与温度( )、初始压强(
)、初始压强( )的关系如图所示。
)的关系如图所示。


___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 温度下,反应进行到
温度下,反应进行到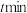 时容器内反应体系总压强为
时容器内反应体系总压强为___________  。
。
(5)一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,合成氨气。
,合成氨气。 的平衡体积分数与投料比
的平衡体积分数与投料比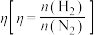 关系如图所示。
关系如图所示。
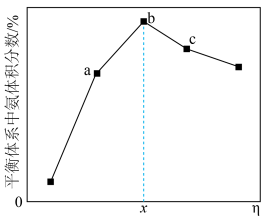
①在 、
、 、
、 点中,
点中, 的平衡转化率最大的是
的平衡转化率最大的是___________ (填字母)。
②若 点对应体系中,
点对应体系中, 体积分数为
体积分数为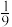 ,则该温度下,平衡常数
,则该温度下,平衡常数 为
为___________  (只列计算式)。
(只列计算式)。
(1)氨的沸点为
 ,易液化,工业上常用于做制冷剂,其易液化的主要原因是
,易液化,工业上常用于做制冷剂,其易液化的主要原因是(2)在液氨中制备
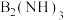 的有机反应如下:
的有机反应如下:①
 ;
;②
 ;
;③
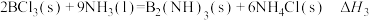 。
。上述反应中,
 、
、 、
、 之间等式关系为
之间等式关系为(3)氨分解制备氢气,反应历程如图所示。

①
 的键能为
的键能为 。
。②写出
 分解总反应的热化学方程式:
分解总反应的热化学方程式:(4)化学上,把反应物消耗一半所用时间叫作“半衰期”。在恒容密闭容器中充入适量钨和
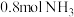 ,实验测得在钨表面氨气分解反应半衰期与温度(
,实验测得在钨表面氨气分解反应半衰期与温度( )、初始压强(
)、初始压强( )的关系如图所示。
)的关系如图所示。

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 温度下,反应进行到
温度下,反应进行到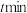 时容器内反应体系总压强为
时容器内反应体系总压强为 。
。(5)一定温度下,向
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,合成氨气。
,合成氨气。 的平衡体积分数与投料比
的平衡体积分数与投料比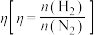 关系如图所示。
关系如图所示。
①在
 、
、 、
、 点中,
点中, 的平衡转化率最大的是
的平衡转化率最大的是②若
 点对应体系中,
点对应体系中, 体积分数为
体积分数为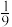 ,则该温度下,平衡常数
,则该温度下,平衡常数 为
为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
2 . 苯乙烯是用于生产苯乙烯系列树脂、丁苯橡胶、离子交换树脂及医药品的原料之一,可通过乙苯的分解制备。
(1)标准状态时,由指定单质生成1mol物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用 表示。规定
表示。规定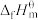 (C,石墨)和
(C,石墨)和
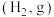 为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如表:
为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如表:
乙苯分解反应 的
的
_______  ,该反应在
,该反应在_______ (填标号)下有利于自发进行。
a.高温B.低温C.任何温度
(2)向密闭容器中充入1mol气态乙苯发生反应 ,其平衡转化率随温度和压强变化的情况如图所示。
,其平衡转化率随温度和压强变化的情况如图所示。
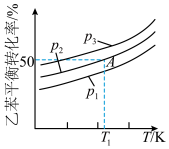
① ,
, ,
, 由大到小的顺序是
由大到小的顺序是_______ ,理由是_______ 。
②A点对应的条件下, 的体积分数为
的体积分数为_______ (保留三位有效数字)%, ,
, 下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数=某组分的物质的量÷总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]
下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数=某组分的物质的量÷总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]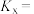
_______ ; 与压强平衡常数
与压强平衡常数 (以分压表示,分压=总压×物质的量分数,
(以分压表示,分压=总压×物质的量分数, 表示总压)的关系为
表示总压)的关系为
_______  。
。
③向A点平衡体系中加入 可提高平衡转化率,欲将平衡转化率提高至80%,需要向反应器中充入
可提高平衡转化率,欲将平衡转化率提高至80%,需要向反应器中充入_______ 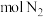 作为稀释气。
作为稀释气。
(1)标准状态时,由指定单质生成1mol物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用
 表示。规定
表示。规定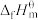 (C,石墨)和
(C,石墨)和
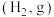 为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如表:
为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如表:| 物质 |  |  |
 | +29.8 | +147.5 |
 的
的
 ,该反应在
,该反应在a.高温B.低温C.任何温度
(2)向密闭容器中充入1mol气态乙苯发生反应
 ,其平衡转化率随温度和压强变化的情况如图所示。
,其平衡转化率随温度和压强变化的情况如图所示。
①
 ,
, ,
, 由大到小的顺序是
由大到小的顺序是②A点对应的条件下,
 的体积分数为
的体积分数为 ,
, 下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数=某组分的物质的量÷总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]
下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数=某组分的物质的量÷总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]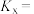
 与压强平衡常数
与压强平衡常数 (以分压表示,分压=总压×物质的量分数,
(以分压表示,分压=总压×物质的量分数, 表示总压)的关系为
表示总压)的关系为
 。
。③向A点平衡体系中加入
 可提高平衡转化率,欲将平衡转化率提高至80%,需要向反应器中充入
可提高平衡转化率,欲将平衡转化率提高至80%,需要向反应器中充入 作为稀释气。
作为稀释气。
您最近一年使用:0次
2023-12-12更新
|
99次组卷
|
3卷引用:吉林省白山市抚松县第一中学2023-2024学年高二上学期12月月考化学试题
解题方法
3 . 我国科研团队发现了一种具有超高稳定性的一维钯银合金纳米线催化剂,能高选择性、高稳定性地将CO2还原成甲酸(HCOOH)。化学反应为CO2(g) +H2(g)  HCOOH(g) ΔH。
HCOOH(g) ΔH。
(1)已知:①2HCOOH(g) +O2(g)=2CO2(g) +2H2O(g) ΔH1= -a kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH2= -bkJ·mol-1 (a>2b >0) ;
O2(g)=H2O(g) ΔH2= -bkJ·mol-1 (a>2b >0) ;
CO2(g)+ H2(g) HCOOH(g) ΔH=
HCOOH(g) ΔH=___________ kJ·mol-1
(2)在某催化剂作用下,CO2(g) + H2(g) HCOOH(g)的速率方程为v正=k正c(CO2)·c(H2),v逆=k逆 c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。若在某温度下,k正= 4k逆,则该反应的平衡常数K=
HCOOH(g)的速率方程为v正=k正c(CO2)·c(H2),v逆=k逆 c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。若在某温度下,k正= 4k逆,则该反应的平衡常数K=___________ 。加入催化剂,k正 增大的倍数___________ (填“大于”、 “小于”或“等于”)k逆增大的倍数。
(3)CO2催化氢化制甲酸的反应历程图(M为过渡金属)如图1所示。

上述循环中,M(CO)4PR3是___________ (填“催化剂”或“中间产物”)。
(4)在反应器中充入CO2和H2,发生上述反应。化学反应速率随时间的变化关系如图2所示。

若仅改变一个外界条件,t2时刻改变的条件可能是___________ 。在I、II、III三次平衡中,___________ (填“ 能”或“不能”)判断CO2转化率的大小排序,理由为___________ 。
(5)在某催化剂作用下,向恒容密闭反应器中充入1 mol CO2和3 mol H2,发生如下反应:
反应一:CO2(g) + H2(g) HCOOH(g)
HCOOH(g)
反应二:CO2 (g) +3H2(g) CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
测得CO2的平衡转化率CH3OH的选择性(注明:CH3OH的选择性等于CH3OH的物质的量与CO2转化的物质的量之比)与温度的关系如图3所示。

①其他条件不变,升高温度,CO2的平衡转化率增大的原因是___________ 。
②已知F点对应的总压强为36.8 kPa,则CO2(g)+H2(g) HCOOH(g)在F点对应的温度下,压强平衡常数Kp=
HCOOH(g)在F点对应的温度下,压强平衡常数Kp=___________ (结果保留 2位有效数字)kPa-1。
 HCOOH(g) ΔH。
HCOOH(g) ΔH。(1)已知:①2HCOOH(g) +O2(g)=2CO2(g) +2H2O(g) ΔH1= -a kJ·mol-1
②H2(g)+
 O2(g)=H2O(g) ΔH2= -bkJ·mol-1 (a>2b >0) ;
O2(g)=H2O(g) ΔH2= -bkJ·mol-1 (a>2b >0) ;CO2(g)+ H2(g)
 HCOOH(g) ΔH=
HCOOH(g) ΔH=(2)在某催化剂作用下,CO2(g) + H2(g)
 HCOOH(g)的速率方程为v正=k正c(CO2)·c(H2),v逆=k逆 c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。若在某温度下,k正= 4k逆,则该反应的平衡常数K=
HCOOH(g)的速率方程为v正=k正c(CO2)·c(H2),v逆=k逆 c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。若在某温度下,k正= 4k逆,则该反应的平衡常数K=(3)CO2催化氢化制甲酸的反应历程图(M为过渡金属)如图1所示。

上述循环中,M(CO)4PR3是
(4)在反应器中充入CO2和H2,发生上述反应。化学反应速率随时间的变化关系如图2所示。

若仅改变一个外界条件,t2时刻改变的条件可能是
(5)在某催化剂作用下,向恒容密闭反应器中充入1 mol CO2和3 mol H2,发生如下反应:
反应一:CO2(g) + H2(g)
 HCOOH(g)
HCOOH(g)反应二:CO2 (g) +3H2(g)
 CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0测得CO2的平衡转化率CH3OH的选择性(注明:CH3OH的选择性等于CH3OH的物质的量与CO2转化的物质的量之比)与温度的关系如图3所示。

①其他条件不变,升高温度,CO2的平衡转化率增大的原因是
②已知F点对应的总压强为36.8 kPa,则CO2(g)+H2(g)
 HCOOH(g)在F点对应的温度下,压强平衡常数Kp=
HCOOH(g)在F点对应的温度下,压强平衡常数Kp=
您最近一年使用:0次
4 . “节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。
I.目前工业上有一种方法是用CO2来生产燃料甲醇。
已知:H2(g)的燃烧热 ΔH= 一285.8 kJ·mol-1、CO(g)的燃烧热 ΔH=- 283.0 kJ·mol-1
反应①:CO(g) +2H2(g) CH3OH(g) ΔH1= -90.8 kJ·mol-1
CH3OH(g) ΔH1= -90.8 kJ·mol-1
反应②: H2O(l)=H2O(g) ΔH2= +44.0 kJ·mol-1
反应③:CO2(g)+ 3H2(g) CH3OH(g) +H2O(g) ΔH3
CH3OH(g) +H2O(g) ΔH3
(1)ΔH3=_______ , 反应③的ΔS_______ (填“>”或“<”)0,反应③在 _______ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)恒温条件下,在某恒容密闭容器中;按照n(CO2) : n(H2) =1:3投料仪发生反应③,起始气体总压强为p0,测得CO2(g)的浓度随时间变化如图所示。
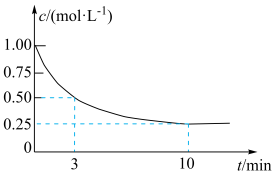
①从反应开始到3 min,H2的平均反应速率v(H2)=_______ mol·L-1·min-1;试在图中绘制出CH3OH(g) 的浓度随时间变化的图像_______ 。
②该反应的平衡常数Kp=_______ (填含 p0的表达式)。
(3)恒温条件下,在某恒压密闭容器中仅发生反应①,当反应达到平衡后,
I.降低温度,CO的平衡转化率_______ (填“不变”、“减小”或“增大”);
II.向平衡体系中通入惰性气体,平衡_______ (填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
I.目前工业上有一种方法是用CO2来生产燃料甲醇。
已知:H2(g)的燃烧热 ΔH= 一285.8 kJ·mol-1、CO(g)的燃烧热 ΔH=- 283.0 kJ·mol-1
反应①:CO(g) +2H2(g)
 CH3OH(g) ΔH1= -90.8 kJ·mol-1
CH3OH(g) ΔH1= -90.8 kJ·mol-1反应②: H2O(l)=H2O(g) ΔH2= +44.0 kJ·mol-1
反应③:CO2(g)+ 3H2(g)
 CH3OH(g) +H2O(g) ΔH3
CH3OH(g) +H2O(g) ΔH3(1)ΔH3=
(2)恒温条件下,在某恒容密闭容器中;按照n(CO2) : n(H2) =1:3投料仪发生反应③,起始气体总压强为p0,测得CO2(g)的浓度随时间变化如图所示。

①从反应开始到3 min,H2的平均反应速率v(H2)=
②该反应的平衡常数Kp=
(3)恒温条件下,在某恒压密闭容器中仅发生反应①,当反应达到平衡后,
I.降低温度,CO的平衡转化率
II.向平衡体系中通入惰性气体,平衡
您最近一年使用:0次
2023-05-10更新
|
273次组卷
|
4卷引用:吉林省白山市2023届高三下学期五模联考理综化学试题
吉林省白山市2023届高三下学期五模联考理综化学试题广西桂林、北海市2023届高三下学期二模理综化学试题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)期中考试模拟试题(一)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
5 . 随着时代的进步,人类对能源的需求量与日俱增,我国全球首套焦炉气化学合成法生产无水乙醇的工业示范项目打通全流程实现,项目投产成功。
(1)3CO(g)+6H2(g) CH3CH2OH(g)+CH3OH(g)+H2O(g) ΔH=
CH3CH2OH(g)+CH3OH(g)+H2O(g) ΔH=_______ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
已知:i.2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH1
CH3OCH3(g)+H2O(g) ΔH1
ii.CH3OCH3(g)+CO(g) CH3COOCH3(g) ΔH2
CH3COOCH3(g) ΔH2
iii.CH3COOCH3(g)+2H2(g) CH3CH2OH(g)+CH3OH(g) ΔH3
CH3CH2OH(g)+CH3OH(g) ΔH3
在恒温恒容密闭容器中充入3molCO(g)和7molH2(g)仅发生反应3CO(g)+6H2(g) CH3CH2OH(g)+CH3OH(g)+H2O(g),下列叙述正确的是
CH3CH2OH(g)+CH3OH(g)+H2O(g),下列叙述正确的是_______ (填标号)。
A.混合气体总压强不随时间变化时,反应达到平衡状态
B.反应达到平衡时,CH3CH2OH体积分数可能为25%
C.反应达到平衡后,再充入少量CO,CO的平衡转化率增大
D.反应达到平衡后,再加入高效催化剂,乙醇产率保持不变
(2)醋酸酯加氢制乙醇是一个乙酰基产物制备乙醇的路线。
①醋酸酯加氢的催化效能如表所示:
上述实验中,催化效能最好的为实验_______ (填序号),与之对比,实验3中,醋酸酯平衡转化率较低的主要原因可能是________ (从表中所给条件的角度分析)。
②醋酸甲酯加氢历程一般认为可分为如下步骤(*代表催化剂位点,已知:CH3CO*+H·→CH3CHO):
a.CH3COOCH3→CH3CO·+CH3O·
b.CH3CO·+*→CH3CO*(慢)
c.CH3O·+*→CH3O*(快)
d.CH3CO*+3H·→CH3CH2OH
e.CH3O*+H·→CH3OH
……
其中,在b和c的步骤中,活化能较小的是_______ (填标号,下同),控制总反应速率的步骤是_______ ,分析上述步骤,副产物除CH3OH外,还可能有_______ (写一种即可)。
(3)甲醇也是新能源的重要组成部分。
以CO2、H2为原料合成CH3OH涉及的反应如下:
iv.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH4<0
CH3OH(g)+H2O(g) ΔH4<0
v.CO2(g)+H2(g) CO(g)+H2O(g) ΔH5>0
CO(g)+H2O(g) ΔH5>0
vi.CO(g)+2H2(g) CH3OH(g) ΔH6<0
CH3OH(g) ΔH6<0
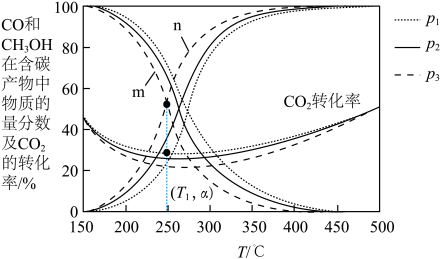
在不同压强下、按照n(CO2)∶n(H2)=1∶3进行投料,在容器中发生上述3个反应,平衡时,CO和CH3OH在含碳产物(即CH3OH和CO)中物质的量分数及CO2的转化率随温度的变化如图,压强p1、p2、p3由大到小的顺序为_______ ,曲线_______ (填“m”或“n”)代表CH3OH在含碳产物中物质的量分数,在T1℃下,压强为p3时,反应v的浓度平衡常数Kc=_______ (填含α的表达式)。
(1)3CO(g)+6H2(g)
 CH3CH2OH(g)+CH3OH(g)+H2O(g) ΔH=
CH3CH2OH(g)+CH3OH(g)+H2O(g) ΔH=已知:i.2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g) ΔH1
CH3OCH3(g)+H2O(g) ΔH1ii.CH3OCH3(g)+CO(g)
 CH3COOCH3(g) ΔH2
CH3COOCH3(g) ΔH2iii.CH3COOCH3(g)+2H2(g)
 CH3CH2OH(g)+CH3OH(g) ΔH3
CH3CH2OH(g)+CH3OH(g) ΔH3在恒温恒容密闭容器中充入3molCO(g)和7molH2(g)仅发生反应3CO(g)+6H2(g)
 CH3CH2OH(g)+CH3OH(g)+H2O(g),下列叙述正确的是
CH3CH2OH(g)+CH3OH(g)+H2O(g),下列叙述正确的是A.混合气体总压强不随时间变化时,反应达到平衡状态
B.反应达到平衡时,CH3CH2OH体积分数可能为25%
C.反应达到平衡后,再充入少量CO,CO的平衡转化率增大
D.反应达到平衡后,再加入高效催化剂,乙醇产率保持不变
(2)醋酸酯加氢制乙醇是一个乙酰基产物制备乙醇的路线。
①醋酸酯加氢的催化效能如表所示:
| 实验组 | 催化剂 | 原料 | 反应条件 | 反应性能 | ||
| 温度/°C | 压力/MPa | 转化率/% | 选择性/% | |||
| 1 | Cu/SiO2 | 醋酸甲酯 | 190 | 28 | 96.1 | 99.0 |
| 2 | Cu-Cr | 醋酸乙酯 | 250 | 2.8 | 接近完全 | 93.8 |
| 3 | Cu/ZnO | 醋酸乙酯 | 185 | 1 | 56 | 99.0 |
| 4 | Cu/SiO2 | 醋酸乙酯 | 280 | 4.0 | 94.6 | 96.6 |
②醋酸甲酯加氢历程一般认为可分为如下步骤(*代表催化剂位点,已知:CH3CO*+H·→CH3CHO):
a.CH3COOCH3→CH3CO·+CH3O·
b.CH3CO·+*→CH3CO*(慢)
c.CH3O·+*→CH3O*(快)
d.CH3CO*+3H·→CH3CH2OH
e.CH3O*+H·→CH3OH
……
其中,在b和c的步骤中,活化能较小的是
(3)甲醇也是新能源的重要组成部分。
以CO2、H2为原料合成CH3OH涉及的反应如下:
iv.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH4<0
CH3OH(g)+H2O(g) ΔH4<0v.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH5>0
CO(g)+H2O(g) ΔH5>0vi.CO(g)+2H2(g)
 CH3OH(g) ΔH6<0
CH3OH(g) ΔH6<0在不同压强下、按照n(CO2)∶n(H2)=1∶3进行投料,在容器中发生上述3个反应,平衡时,CO和CH3OH在含碳产物(即CH3OH和CO)中物质的量分数及CO2的转化率随温度的变化如图,压强p1、p2、p3由大到小的顺序为

您最近一年使用:0次
2023-03-13更新
|
613次组卷
|
4卷引用:吉林省白山市2023届高三下学期三模理综化学试题
名校
6 . 在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应①: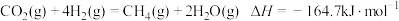
反应②:
反应③:
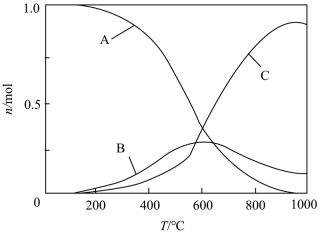
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是
反应①:
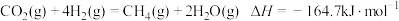
反应②:

反应③:

向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法正确的是

A.反应①的平衡常数可表示为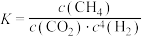 |
B.图中曲线C表示 的物质的量随温度的变化 的物质的量随温度的变化 |
| C.提高CO2转化为CH4的转化率,需要研发在高温区高效的催化剂 |
D. 的 的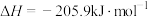 |
您最近一年使用:0次
2022-08-11更新
|
322次组卷
|
2卷引用:吉林省白山市抚松县第一中学2023-2024学年高二上学期11月月考化学试题
解题方法
7 . 我国拥有众多非物质文化遗产,如建窑建盏烧制技艺、浦城剪纸、武夷岩茶(大红袍)制作技艺等。
I.建盏的魅力斑纹是由釉面里面由内至外呈现的,三维立体,栩栩如生,主要因建阳水吉附近的南方红壤土中蕴含大量的铁,通过高温烧制控制进入的氧气量,把坯体铁析晶和釉水铁析晶呈现出来,这些表现在建盏的釉色当中,该过程会形成不同形态的铁(如Fe2O3、FeO、,Fe3O4等)。以下是烧制过程中可能发生反应的热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=akJ·mol-1
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH2=bkJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=ckJ·mol-1
(1)写出CO气体还原Fe2O3固体得到Fe3O4固体和CO2气体的热化学方程式:________ 。
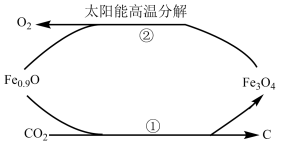
(2)在太阳能的作用下,缺铁氧化物(如Fe0.9O)能催化分解CO2,其过程如图所示。过程①的化学方程式是___________ ,过程②能量转化的主要形式为___________ 。
II.一种以CO2为碳源,在催化剂作用下催化加氢制备可再生能源甲醇的反应如下:
反应i:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH4=-49.1kJ·mol-1
反应ii:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH5=+41.1kJ·mol-1
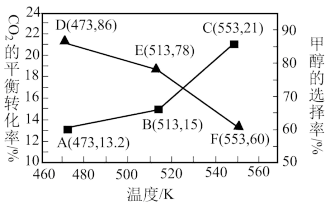
(3)往恒容密闭容器中按n(CO2):n(H2)=1:3(总量为a mol)充入反应物,在合适催化剂作用下,发生反应i、ii,CO2的平衡转化率和甲醇的选择率(转化为甲醇的CO2物质的量与参加反应的CO2总物质的量之比)如图所示。在513K达平衡时,甲醇的物质的量为________ (列出计算式)mol。随着温度的升高,CO2的平衡转化率升高但甲醇的选择率降低的原因是_______ 。
(4)现向恒温恒压(0.1MPa)的密闭容器中充入1molCO2、3molH2和6molHe,选择合适的催化剂使其仅按反应i进行,上述反应达平衡时,测得CO2的转化率为20%,则该反应的Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果精确到0.1)MPa-2。CO2制备CH3OH的过程中,往往伴随着反应ii,从而导致CH3OH的选择率下降,有研究表明,在原料气中掺入适量CO,能提高CH3OH的选择率,试说明其可能的原因:___________ 。
I.建盏的魅力斑纹是由釉面里面由内至外呈现的,三维立体,栩栩如生,主要因建阳水吉附近的南方红壤土中蕴含大量的铁,通过高温烧制控制进入的氧气量,把坯体铁析晶和釉水铁析晶呈现出来,这些表现在建盏的釉色当中,该过程会形成不同形态的铁(如Fe2O3、FeO、,Fe3O4等)。以下是烧制过程中可能发生反应的热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=akJ·mol-1
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH2=bkJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=ckJ·mol-1
(1)写出CO气体还原Fe2O3固体得到Fe3O4固体和CO2气体的热化学方程式:

(2)在太阳能的作用下,缺铁氧化物(如Fe0.9O)能催化分解CO2,其过程如图所示。过程①的化学方程式是
II.一种以CO2为碳源,在催化剂作用下催化加氢制备可再生能源甲醇的反应如下:
反应i:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH4=-49.1kJ·mol-1
反应ii:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH5=+41.1kJ·mol-1
(3)往恒容密闭容器中按n(CO2):n(H2)=1:3(总量为a mol)充入反应物,在合适催化剂作用下,发生反应i、ii,CO2的平衡转化率和甲醇的选择率(转化为甲醇的CO2物质的量与参加反应的CO2总物质的量之比)如图所示。在513K达平衡时,甲醇的物质的量为

(4)现向恒温恒压(0.1MPa)的密闭容器中充入1molCO2、3molH2和6molHe,选择合适的催化剂使其仅按反应i进行,上述反应达平衡时,测得CO2的转化率为20%,则该反应的Kp=
您最近一年使用:0次
2022-01-11更新
|
1296次组卷
|
6卷引用:吉林省白山市2021-2022学年高三上学期期末考试化学试题
8 . 通过以下反应均可制备H2:
①煤炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH1=+131.3kJ·mol-1
②甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
③太阳光催化分解水制氢:2H2O(g)=2H2(g)+O2(g) ΔH3=+483.6kJ·mol-1
下列有关说法错误的是
①煤炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH1=+131.3kJ·mol-1
②甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
③太阳光催化分解水制氢:2H2O(g)=2H2(g)+O2(g) ΔH3=+483.6kJ·mol-1
下列有关说法错误的是
| A.若反应②使用催化剂则ΔH2减小 | B.通过反应①可以将煤转化为清洁燃料 |
| C.反应③在高温下可以自发进行 | D.反应 C(s)+ O2(g)=CO(g) ΔH=-110.5kJ·mol-1 O2(g)=CO(g) ΔH=-110.5kJ·mol-1 |
您最近一年使用:0次
2022-01-08更新
|
192次组卷
|
2卷引用:吉林省白山市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
9 . 已知H2O(g)=H2O(1) ΔH=-Q1kJ•mol-1,
C2H5OH(g)=C2H5OH(1) ΔH=-Q2kJ•mol-1,
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q3kJ•mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 kJ
C2H5OH(g)=C2H5OH(1) ΔH=-Q2kJ•mol-1,
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q3kJ•mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 kJ
| A.Q1+Q2+Q3 | B.0.5(Q1+Q2+Q3) |
| C.0.5Q1-1.5Q2+0.5Q3 | D.1.5Q1-0.5Q2+0.5Q3 |
您最近一年使用:0次
2021-12-26更新
|
2053次组卷
|
31卷引用:吉林省白山市抚松县第一中学2021-2022学年高二上学期开学考试验收化学试题
吉林省白山市抚松县第一中学2021-2022学年高二上学期开学考试验收化学试题(已下线)2011届山西省汾阳中学高三上学期第二次月考化学卷(已下线)2011届福建省三明一中高三上学期期中考试化学卷(已下线)2011-2012学年安徽省安工大附中、红星中学高二3月联考化学试卷(已下线)2011-2012学年浙江省嘉兴一中高二下学期期中考试化学试卷(已下线)2011-2012学年江西省白鹭洲中学高一下学期期中考试化学试卷(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷高二人教版选修4 第一章 第三节 化学反应热的计算吉林省白城市通榆县第一中学2019-2020学年高二上学期第一次月考化学试题吉林省吉林地区普通高中友好学校联合体第三十一届2019-2020学年高二上学期期中考试化学试题湖南省娄底市娄星区2019-2020学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第1节 化学反应的热效应吉林省长春汽车经济技术开发区第六中学2019-2020学年高一下学期期末考试化学试题内蒙古赤峰学院附属中学2020-2021学年高二上学期期中考试化学试题甘肃省会宁县第一中学2020-2021学年高二上学期期中考试化学(理)试题广东省台山市华侨中学2020-2021学年高二上学期第一次月考化学试题(已下线)【浙江新东方】高中化学20210304-004四川省南充高级中学2020-2021学年高一下学期期中考试化学试题重庆市第八中学2020-2021学年高一下学期期中考试化学试题(已下线)第1章 化学反应与能量(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)广西百色中学2021-2022学年高二上学期第一次月考化学试题河南省范县第一中学2021-2022学年高二上学期第一次月考检测化学试题(已下线)1.2 反应热的计算(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题第一章 化学反应的热效应(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山东省烟台招远市第二中学2022-2023学年高三9月月考化学试题河南省南阳市第一中学校2022-2023学年高二上学期第一次月考化学试题广东省汕头市潮南区龙岭中英文学校2023-2024学年高二上学期10月月考化学试题广西钦州市第四中学2023-2024学年高二上学期9月考试化学试卷江西省宜春市丰城市东煌学校2023-2024学年高二上学期1月期末化学试题山东省菏泽市鄄城县第一中学2023-2024学年高一下学期4月月考化学试题
10 . 回答下列问题:
(1)已知:25℃、101kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5kJ/mol,C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol。试回答下列问题:CO(g)+1/2O2(g)=CO2(g) ΔH=___________ kJ/mol。
(2)在25℃时,将0.2molNO2充入2L的密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH=-56.9kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1mol。试回答下列问题:
N2O4(g) ΔH=-56.9kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1mol。试回答下列问题:
①能说明上述反应达到平衡状态的是___________ (填字母,下同)。
A.反应中NO2与N2O4的物质的量浓度之比为2∶1 B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化 D.2v正(NO2)=v逆(N2O4)
②该反应的平衡常数K=___________ 。
(3)将除锈后的铁钉用饱和食盐水浸泡一下,放入如图所示的具支试管中。

①几分钟后,可观察到导管中的水柱___________ ;
A.升高 B.降低 C.不变
②该电化学腐蚀的正极反应式为:___________ 。
(1)已知:25℃、101kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5kJ/mol,C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol。试回答下列问题:CO(g)+1/2O2(g)=CO2(g) ΔH=
(2)在25℃时,将0.2molNO2充入2L的密闭容器中,发生反应:2NO2(g)
 N2O4(g) ΔH=-56.9kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1mol。试回答下列问题:
N2O4(g) ΔH=-56.9kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1mol。试回答下列问题:①能说明上述反应达到平衡状态的是
A.反应中NO2与N2O4的物质的量浓度之比为2∶1 B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化 D.2v正(NO2)=v逆(N2O4)
②该反应的平衡常数K=
(3)将除锈后的铁钉用饱和食盐水浸泡一下,放入如图所示的具支试管中。

①几分钟后,可观察到导管中的水柱
A.升高 B.降低 C.不变
②该电化学腐蚀的正极反应式为:
您最近一年使用:0次



