名校
解题方法
1 . 氮是地球上含量丰富的一种元素,氮及其化合物对我们的生产、生活有重要的影响。请回答下列问题:
I.利用化学原理对氮氧化物进行处理。
(1) 还原法消除氮氧化物,已知:
还原法消除氮氧化物,已知: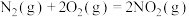
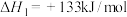 ,
, 的燃烧热
的燃烧热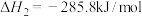 ,在催化剂存在下,
,在催化剂存在下, 还原
还原 生成液态水和氮气的热化学方程式为
生成液态水和氮气的热化学方程式为___________ 。
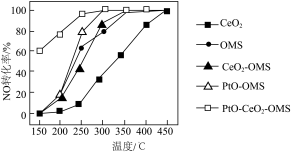
(2)汽车中的三元催化器能使尾气中的NO和CO发生反应转化为无污染的气体,主要反应的化学方程式为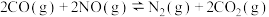 。下图为相同时间内不同温度下汽车尾气中NO的转化率的变化情况。该反应最佳的催化剂与温度为
。下图为相同时间内不同温度下汽车尾气中NO的转化率的变化情况。该反应最佳的催化剂与温度为___________ 、___________ 。
Ⅱ.某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
a.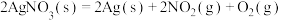
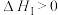
b.
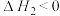
(3) 温度时,在2L的恒容密闭容器中投入0.05mol
温度时,在2L的恒容密闭容器中投入0.05mol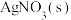 并完全分解,5分钟时反应达到平衡,测得混合气体的总物质的量为0.06mol:
并完全分解,5分钟时反应达到平衡,测得混合气体的总物质的量为0.06mol:
①下列情况能说明体系达到平衡状态的是___________ (填字母)。
A.混合气体的平均相对分子质量不再改变 B. 的质量不再改变
的质量不再改变
C.混合气体的密度不再改变 D. 的浓度不再改变
的浓度不再改变
②若达到平衡时,混合气体的总压强 ,反应开始到5min内
,反应开始到5min内 的平均反应速率为
的平均反应速率为___________ 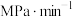 。在该温度下
。在该温度下 的平衡常数
的平衡常数
___________  (结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数
(结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数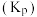 ,组分的分压
,组分的分压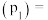 平衡时总压
平衡时总压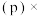 该组分的体积分数
该组分的体积分数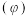 ]。
]。
③实验测得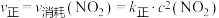 ,
,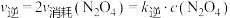 ,
, 、
、 为速率常数且只受温度影响。则化学平衡常数K与速率常数
为速率常数且只受温度影响。则化学平衡常数K与速率常数 、
、 的数学关系是
的数学关系是
___________ 。若将容器的温度改变为 时,其
时,其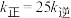 ,则
,则
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
I.利用化学原理对氮氧化物进行处理。
(1)
 还原法消除氮氧化物,已知:
还原法消除氮氧化物,已知: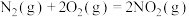
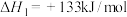 ,
, 的燃烧热
的燃烧热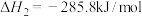 ,在催化剂存在下,
,在催化剂存在下, 还原
还原 生成液态水和氮气的热化学方程式为
生成液态水和氮气的热化学方程式为(2)汽车中的三元催化器能使尾气中的NO和CO发生反应转化为无污染的气体,主要反应的化学方程式为
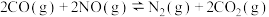 。下图为相同时间内不同温度下汽车尾气中NO的转化率的变化情况。该反应最佳的催化剂与温度为
。下图为相同时间内不同温度下汽车尾气中NO的转化率的变化情况。该反应最佳的催化剂与温度为
Ⅱ.某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
a.
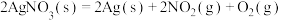
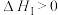
b.

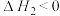
(3)
 温度时,在2L的恒容密闭容器中投入0.05mol
温度时,在2L的恒容密闭容器中投入0.05mol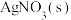 并完全分解,5分钟时反应达到平衡,测得混合气体的总物质的量为0.06mol:
并完全分解,5分钟时反应达到平衡,测得混合气体的总物质的量为0.06mol:①下列情况能说明体系达到平衡状态的是
A.混合气体的平均相对分子质量不再改变 B.
 的质量不再改变
的质量不再改变C.混合气体的密度不再改变 D.
 的浓度不再改变
的浓度不再改变②若达到平衡时,混合气体的总压强
 ,反应开始到5min内
,反应开始到5min内 的平均反应速率为
的平均反应速率为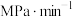 。在该温度下
。在该温度下 的平衡常数
的平衡常数
 (结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数
(结果保留3位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数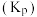 ,组分的分压
,组分的分压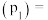 平衡时总压
平衡时总压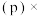 该组分的体积分数
该组分的体积分数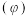 ]。
]。③实验测得
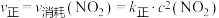 ,
,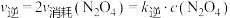 ,
, 、
、 为速率常数且只受温度影响。则化学平衡常数K与速率常数
为速率常数且只受温度影响。则化学平衡常数K与速率常数 、
、 的数学关系是
的数学关系是
 时,其
时,其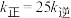 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。
(1)已知: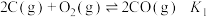 ,
,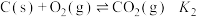 ,
,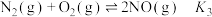 ,则反应
,则反应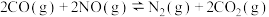 的
的
___________ 。(用 、
、 、
、 表示)
表示)
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应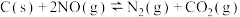 ,NO和
,NO和 的物质的量变化如下表所示。
的物质的量变化如下表所示。
①0~5min内,以 表示的该反应速率
表示的该反应速率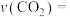
___________ ,最终达平衡时NO的转化率
___________ ,该温度T℃下的平衡常数
___________ 。
②保持温度T℃不变,向该2L密闭容器中加入该四种反应混合物各2mol,该时刻,正、逆反应速率的大小关系为: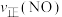
___________ 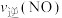 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)已知下列反应在298K时的反应焓变:
①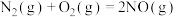
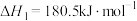
②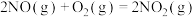
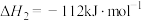
③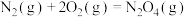
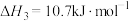
写出 转化为
转化为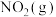 的热化学方程式:
的热化学方程式:___________ 。
(1)已知:
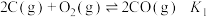 ,
,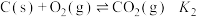 ,
,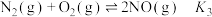 ,则反应
,则反应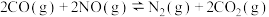 的
的
 、
、 、
、 表示)
表示)(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应
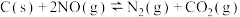 ,NO和
,NO和 的物质的量变化如下表所示。
的物质的量变化如下表所示。| 条件 | 保持温度为T/℃ | ||||||
| 时间 | 0min | 5min | 10min | 15min | 20min | 25min | 30min |
| NO物质的量/mol |  |  | 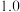 | 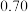 | 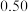 |  |  |
 物质的量/mol 物质的量/mol | 0 |  | 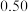 |  |  | 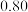 | 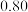 |
 表示的该反应速率
表示的该反应速率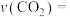


②保持温度T℃不变,向该2L密闭容器中加入该四种反应混合物各2mol,该时刻,正、逆反应速率的大小关系为:
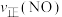
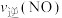 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)已知下列反应在298K时的反应焓变:
①
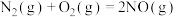
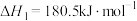
②
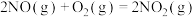
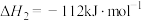
③
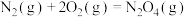
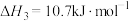
写出
 转化为
转化为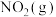 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 二氧化碳催化加氢制甲醇有利于减少温室气体排放。涉及的主要反应如下:
Ⅰ.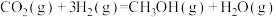

Ⅱ.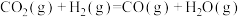
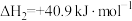
Ⅲ.
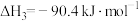
(1)
_______  ,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是_______ (填标号)。
A.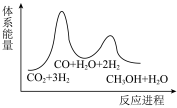 B.
B.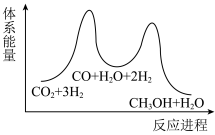
C.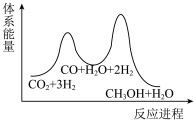 D.
D.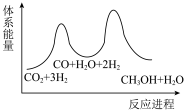
(2)一定条件下,恒容密闭容器中 和
和 发生上述反应。下列说法正确的是_______。
发生上述反应。下列说法正确的是_______。
(3)不同压强下,按照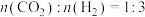 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
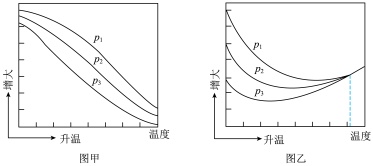
已知: 的平衡转化率
的平衡转化率
 的平衡产率
的平衡产率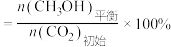
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图_______ (填“甲”或“乙”),压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ ,图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是_______ 。
(4)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。热化学方程式为:C2H4(g)+H2O(g) CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
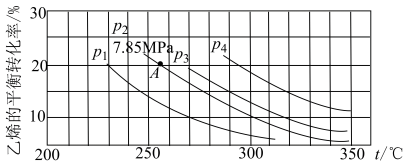
计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅰ.
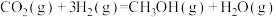

Ⅱ.
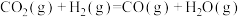
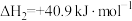
Ⅲ.

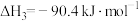
(1)

 ,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是A.
 B.
B.
C.
 D.
D.
(2)一定条件下,恒容密闭容器中
 和
和 发生上述反应。下列说法正确的是_______。
发生上述反应。下列说法正确的是_______。| A.当混合气体密度不变时说明体系达到平衡状态 |
| B.反应达到平衡状态后通入氦气,体系压强增大,反应速率不变,平衡不移动 |
| C.使用高效催化剂,可提高甲醇的生产效率,但不能改变甲醇的平衡产率 |
| D.实际生产中温度越低越有利于甲醇的合成 |
(3)不同压强下,按照
 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知:
 的平衡转化率
的平衡转化率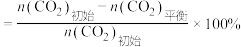
 的平衡产率
的平衡产率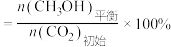
其中纵坐标表示
 平衡转化率的是图
平衡转化率的是图 、
、 、
、 由大到小的顺序为
由大到小的顺序为 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是(4)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。热化学方程式为:C2H4(g)+H2O(g)
 CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=
您最近一年使用:0次
名校
4 . 完成下列问题。
(1)实验测得16g甲醇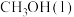 在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:
在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:___________ 。
(2)合成氨反应
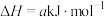 ,能量变化如图所示:
,能量变化如图所示:

①该反应通常用铁作催化剂,加催化剂会使图中
___________ (填“变大”“变小”或“不变”)。
②有关键能数据如下:
试根据表中所列键能数据计算a为___________ 。
(3)现根据下列的3个热化学反应方程式:
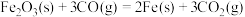

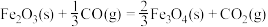
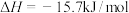

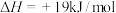
试写出CO气体还原FeO固体得到Fe固体和 气体的热化学反应方程式:
气体的热化学反应方程式:___________ 。
(1)实验测得16g甲醇
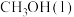 在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:
在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇完全燃烧的热化学方程式:(2)合成氨反应

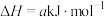 ,能量变化如图所示:
,能量变化如图所示:
①该反应通常用铁作催化剂,加催化剂会使图中

②有关键能数据如下:
| 化学键 | H-H | N-H | N≡N |
键能( ) ) | 436 | 391 | 945 |
(3)现根据下列的3个热化学反应方程式:
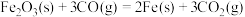

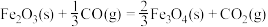
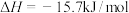

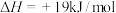
试写出CO气体还原FeO固体得到Fe固体和
 气体的热化学反应方程式:
气体的热化学反应方程式:
您最近一年使用:0次
5 . 甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。
(1)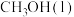 ,
,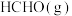 燃烧热
燃烧热 分别
分别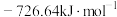 和
和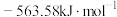 ,则
,则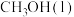 与
与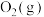 反应生成
反应生成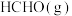 和
和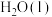 热化学反应方程式:
热化学反应方程式:___________ 。
(2)利用工业废气中的CO2可制取甲醇,其反应为: 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
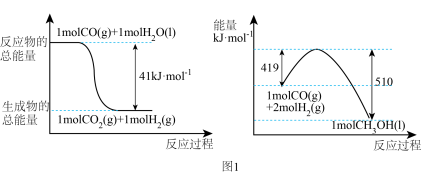
写出由二氧化碳和氢气制备甲醇的热化学方程式:___________ 。
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为___________ 。
②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象);阳极上收集到氧气的物质的量为___________ mol。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
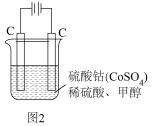
写出阳极电极反应式:___________ 。
(1)
 ,
,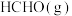 燃烧热
燃烧热 分别
分别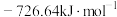 和
和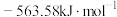 ,则
,则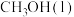 与
与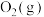 反应生成
反应生成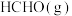 和
和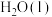 热化学反应方程式:
热化学反应方程式:(2)利用工业废气中的CO2可制取甲醇,其反应为:
 常温常压下已知下列反应的能量变化如图1所示:
常温常压下已知下列反应的能量变化如图1所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
(3)①为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了
 的
的 晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应式为
离子。电池工作时正极反应式为②若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
| 离子 | 铜离子 | 氢离子 | 氯离子 | 硫酸根离子 |
 | 1 | 4 | 4 | 1 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将
 氧化成
氧化成 ,然后以
,然后以 作氧化剂把水中的甲醇氧化成
作氧化剂把水中的甲醇氧化成 而净化。实验室用图2装置模拟上述过程:
而净化。实验室用图2装置模拟上述过程:
写出阳极电极反应式:
您最近一年使用:0次
6 . 化学反应过程伴随有热量的变化。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:
反应Ⅱ: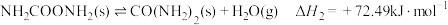
总反应: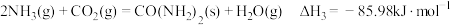
则反应I的
___________  。
。
(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
则

___________ 。(用a、b、c、d表示)
②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
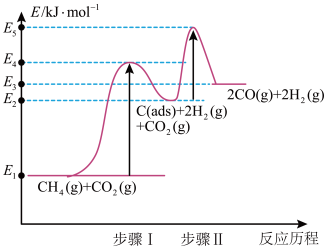
步骤1反应的焓变 为
为___________ kJ/mol(选用E1~E5的关系式表示)。
③反应 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
___________  (填“>”或“<)。
(填“>”或“<)。
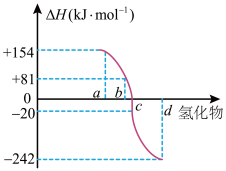
(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热( )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为___________ 。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:

反应Ⅱ:
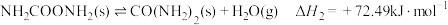
总反应:
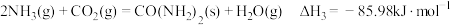
则反应I的

 。
。(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
| 化学键 | H—H | C=C | C—C | C—H |
| E(kJ/mol) | a | b | c | d |


②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

步骤1反应的焓变
 为
为③反应
 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
 (填“>”或“<)。
(填“>”或“<)。(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(
 )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 甲醇是重要的工业原料。
(1)已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
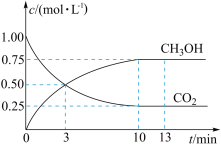
①T℃时,计算该反应的平衡常数为_______ (结果保留3位有效数字)。
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正_______ v逆(填“>”、“<”或=)。
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=_______ 。
(2)已知:(Ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
(Ⅱ)CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1
(Ⅲ)2H2(g)+CO(g) CH3OH(g) △H3
CH3OH(g) △H3
①△H3=_______ kJ/mol。
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=________ (用K1、K2表示)。
(1)已知CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
①T℃时,计算该反应的平衡常数为
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=
| 物质 | CO2 | H2 | CH3OH | H2O |
| 总键能/kJ•mol | 1620 | a | 2047 | 930 |
 CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1(Ⅱ)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1(Ⅲ)2H2(g)+CO(g)
 CH3OH(g) △H3
CH3OH(g) △H3①△H3=
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=
您最近一年使用:0次
8 . 化学反应原理对化学反应的研究具有指导意义。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
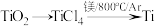
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______ 。
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2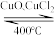 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.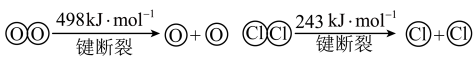
(2)写出该条件下,反应A的热化学方程式为_______ 。
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为_______ kJ。
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
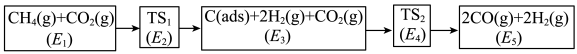
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的 可表示为
可表示为_______ kJ·mol-1。
(5)若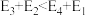 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为_______ 。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
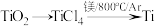
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2
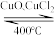 2Cl2+2H2O
2Cl2+2H2O已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.
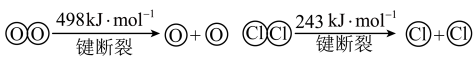
(2)写出该条件下,反应A的热化学方程式为
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
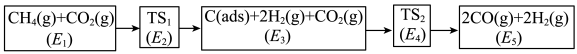
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的
 可表示为
可表示为(5)若
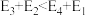 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 研究二氧化碳合成甲醇对实现“碳中和”具有重要意义,二氧化碳加氢制甲醇的过程一般含有以下三个反应:
Ⅰ.


Ⅱ.
 kJ·mol
kJ·mol

Ⅲ.
 kJ·mol
kJ·mol

(1)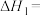
______ ;反应Ⅰ在______ (填“高温”、“低温”或“任意温度”)下可自发进行。
(2)一定温度下,向盛有催化剂的恒容密闭容器中按初始进料比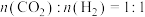 投入反应物,发生反应I。下列不能说明该反应一定处于平衡状态的是
投入反应物,发生反应I。下列不能说明该反应一定处于平衡状态的是______ (填字母)。
a.容器内气体的压强不再发生改变
b. 的体积分数不再变化
的体积分数不再变化
c.1 mol H-H键断裂的同时1 mol C-H键断裂
d.反应的焓变 不再变化
不再变化
(3)向恒容密闭容器中按初始进料比 投入反应物,只发生反应Ⅰ和Ⅱ。在不同温度下达到平衡,体系中
投入反应物,只发生反应Ⅰ和Ⅱ。在不同温度下达到平衡,体系中 、CO的选择性和
、CO的选择性和 的平衡转化率
的平衡转化率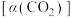 与温度的关系如图所示。
与温度的关系如图所示。
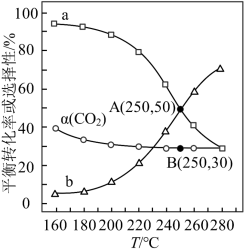
(已知: 的选择性
的选择性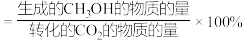 )
)
①图中表示 选择性变化的曲线是
选择性变化的曲线是______ (填“a”或“b”),其原因是_______________ 。
②当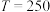 ℃,平衡时
℃,平衡时 的体积分数
的体积分数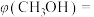
__________ (答案保留两位有效数字)。
(4)500℃时,已知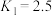 ,
, ,则
,则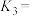
______ 。该温度下,往2 L恒容密闭容器中充入1 mol CO和2 mol  发生反应Ⅲ。测得某时刻
发生反应Ⅲ。测得某时刻 ,CO的转化率为50%,则此时该反应的v(正)
,CO的转化率为50%,则此时该反应的v(正)______ v(逆)(填“>”、“<”或“=”)。
Ⅰ.



Ⅱ.

 kJ·mol
kJ·mol

Ⅲ.

 kJ·mol
kJ·mol

(1)
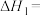
(2)一定温度下,向盛有催化剂的恒容密闭容器中按初始进料比
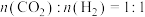 投入反应物,发生反应I。下列不能说明该反应一定处于平衡状态的是
投入反应物,发生反应I。下列不能说明该反应一定处于平衡状态的是a.容器内气体的压强不再发生改变
b.
 的体积分数不再变化
的体积分数不再变化c.1 mol H-H键断裂的同时1 mol C-H键断裂
d.反应的焓变
 不再变化
不再变化(3)向恒容密闭容器中按初始进料比
 投入反应物,只发生反应Ⅰ和Ⅱ。在不同温度下达到平衡,体系中
投入反应物,只发生反应Ⅰ和Ⅱ。在不同温度下达到平衡,体系中 、CO的选择性和
、CO的选择性和 的平衡转化率
的平衡转化率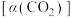 与温度的关系如图所示。
与温度的关系如图所示。
(已知:
 的选择性
的选择性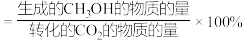 )
)①图中表示
 选择性变化的曲线是
选择性变化的曲线是②当
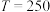 ℃,平衡时
℃,平衡时 的体积分数
的体积分数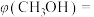
(4)500℃时,已知
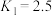 ,
, ,则
,则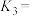
 发生反应Ⅲ。测得某时刻
发生反应Ⅲ。测得某时刻 ,CO的转化率为50%,则此时该反应的v(正)
,CO的转化率为50%,则此时该反应的v(正)
您最近一年使用:0次
2023-08-31更新
|
498次组卷
|
2卷引用:福建省福州延安中学2023-2024学年高二上学期12月月考化学试卷
解题方法
10 . 通过以下两步反应可实现NH4Cl分解产物的分离。
NH4Cl(s)+MgO(s)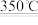 NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1
NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1
Mg(OH)Cl(s) HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1
HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1
下列说法不正确的是
NH4Cl(s)+MgO(s)
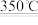 NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1
NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1Mg(OH)Cl(s)
 HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1
HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1下列说法不正确的是
| A.反应NH4Cl(s)=NH3(g)+HCl(g)的ΔH=+158.84kJ·mol-1 |
| B.两步反应的ΔS均大于0 |
| C.Mg(OH)Cl是NH4Cl分解反应的催化剂 |
| D.5.35gNH4Cl完全分解理论上可获得标准状况下的HCl约2.24L |
您最近一年使用:0次



