解题方法
1 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。工业合成氨生产示意图如图所示。

(1)下列有关合成氨工业的说法正确的是_________
(2)循环利用的Y是氮气和氢气,目的是__________________ 。
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有_________ (填编号)。
①使用催化剂 ②恒温恒容,增大原料气 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体 使压强增大
使压强增大
(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分 值。
值。
分析数据可知:
①在 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻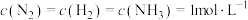 ,此时
,此时
_________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②人类不适合大规模模拟大气固氮的原因是__________________ 。
(5)为获得合成氨的原料气氢气,某科研小组以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下。
的过程如下。
已知: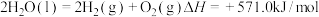 。
。
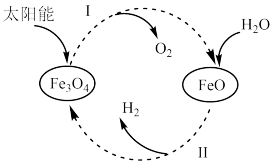
过程Ⅰ: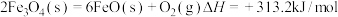
过程Ⅱ:……
过程Ⅱ的热化学方程式为_________ 。

(1)下列有关合成氨工业的说法正确的是_________
| A.工业合成氨的反应是熵减小的放热反应,在低温或常温时可自发进行 |
| B.合成氨反应中,反应物的总键能小于产物的总键能 |
C.合成氨厂一般采用的压强为 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有
①使用催化剂 ②恒温恒容,增大原料气
 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体
 使压强增大
使压强增大(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分
 值。
值。| 反应 | 大气固氮 | 工业固氮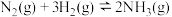 | |||
温度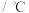 | 27 | 2000 | 25 | 400 | 450 |
 |  | 0.1 | 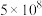 | 0.507 | 0.152 |
①在
 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻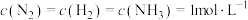 ,此时
,此时
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②人类不适合大规模模拟大气固氮的原因是
(5)为获得合成氨的原料气氢气,某科研小组以太阳能为热源分解
 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下。
的过程如下。已知:
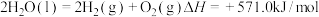 。
。
过程Ⅰ:
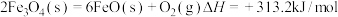
过程Ⅱ:……
过程Ⅱ的热化学方程式为
您最近一年使用:0次
2 . 能源是国民经济发展的重要基础。请根据所学知识回答下列问题:
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成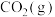 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。
(1)该气体的分子式为___________ 。该气体的燃烧热
___________ 。(保留一位小数)
Ⅱ.火箭发射时可以用肼( ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。
已知:
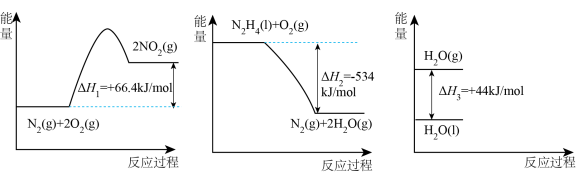
(2)请写出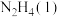 与
与 反应的热化学方程式
反应的热化学方程式___________ 。
(3)32g液态肼与足量 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是___________ kJ。
(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②___________ 。
Ⅲ.氢能是一种极具发展潜力的清洁能源。 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
已知:在25℃、101kPa下,
①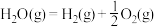
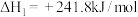
②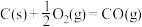
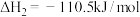
③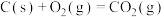

(5)25℃、101kPa下,CO与水蒸气反应转化为 和
和 的热化学方程式为
的热化学方程式为___________ 。
Ⅰ.在标准状况下,1.68L家用燃料(仅由C、H两种元素组成的某气体)质量为1.2g,在25℃和101kPa下完全燃烧生成
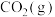 和
和 时,放出66.77kJ的热量。
时,放出66.77kJ的热量。(1)该气体的分子式为

Ⅱ.火箭发射时可以用肼(
 ,液态)作燃料,
,液态)作燃料, 作氧化剂,二者反应生成
作氧化剂,二者反应生成 和水蒸气。
和水蒸气。已知:

(2)请写出
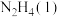 与
与 反应的热化学方程式
反应的热化学方程式(3)32g液态肼与足量
 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是(4)上述反应用于火箭推进器的原因:①能快速产生大量气体;②
Ⅲ.氢能是一种极具发展潜力的清洁能源。
 可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一
可用CO在高温下与水蒸气反应制得,是目前大规模制取氢气的方法之一已知:在25℃、101kPa下,
①
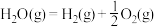
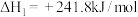
②
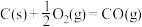
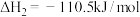
③
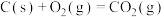

(5)25℃、101kPa下,CO与水蒸气反应转化为
 和
和 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
解题方法
3 . 氨的用途十分广泛,是现代工业、农业生产最基础的化工原料之一。
I.以氨为原料可生产尿素:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
①2NH3(g)+CO2(g) NH2COONH4(l) ΔH1=−117kJ·mol−1
NH2COONH4(l) ΔH1=−117kJ·mol−1
②NH2COONH4(l) CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
(1)生产尿素的决速步骤是第二步,可判断活化能较小的是_______ (填“①”或“②”)。
(2)总反应的ΔH=_______ 。
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
(3)上述反应在常温下_______ (填“能”或“不能”)自发进行。
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是_______(填标号)。
(5)科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入6mol N2和10mol H2,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
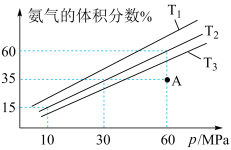
①T1、T2、T3由小到大的顺序为_______ 。
②在T2、60MPa条件下,平衡时N2的转化率为_______ %;平衡常数Kp=_______ (保留两位有效数字)。(用平衡分压代替平衡浓度,分压=总压x物质的量分数)
I.以氨为原料可生产尿素:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:
CO(NH2)2(l)+H2O(g) ΔH, 其反应分两步进行:①2NH3(g)+CO2(g)
 NH2COONH4(l) ΔH1=−117kJ·mol−1
NH2COONH4(l) ΔH1=−117kJ·mol−1②NH2COONH4(l)
 CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1
CO(NH2)2(l)+H2O(g) ΔH2=+15kJ·mol−1(1)生产尿素的决速步骤是第二步,可判断活化能较小的是
(2)总反应的ΔH=
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1
2NH3(g) ΔH=-92.4kJ·mol−1 ΔS=−200J·K−1·mol−1(3)上述反应在常温下
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是_______(填标号)。
| A.容器内气体的平均摩尔质量不变 | B.N2的体积分数不变 |
| C.混合气体的颜色不再改变 | D.3v正(NH3)=2v逆(H2) |

①T1、T2、T3由小到大的顺序为
②在T2、60MPa条件下,平衡时N2的转化率为
您最近一年使用:0次
4 . 烟气中的主要污染物是 、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:
、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:
Ⅰ.烟气经 预处理后用
预处理后用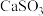 水悬浮液吸收,可减少烟气中
水悬浮液吸收,可减少烟气中 、NO的含量。
、NO的含量。
 氧化烟气中
氧化烟气中 、
、 ,的主要反应的热化学方程式为:
,的主要反应的热化学方程式为:
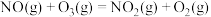
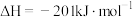
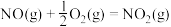
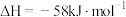
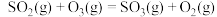
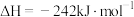
(1)反应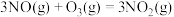 的
的
___________  。
。
(2)室温下,固定进入反应器的NO、 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中n(NO)、n(
的物质的量,反应一段时间后体系中n(NO)、n( )和n(
)和n( )随反应前n(
)随反应前n( ):n(NO)的变化见图:
):n(NO)的变化见图:
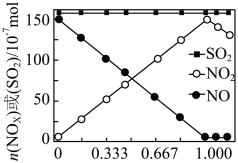
当n( ):n(NO)
):n(NO)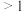 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是___________ ;增加n( ),
), 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是___________ 。
(3)当用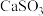 水悬浮液吸收经
水悬浮液吸收经 预处理的烟气时,清液(pH约为8)中
预处理的烟气时,清液(pH约为8)中 将
将 转化为
转化为 ,其离子方程式为
,其离子方程式为___________ 。
Ⅱ.NaClO溶液在不同温度下也可对烟气中的硫、硝脱除,一定时间内,其脱除率如下图所示。
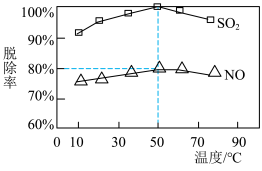
(4)烟气中 和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n(
和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n( ):n(
):n( )
)
___________ 。
Ⅲ.可利用CO为还原剂在催化剂作用下将NO脱除并转化为 和
和 。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下:
。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下:
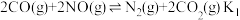

(5)下述情况能说明反应体系已达到平衡的是___________ 。
a.CO与NO转化率之比不再改变 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不变 d.v(CO):v( )
)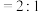
(6)若达到平衡时NO的转化率为80%, 的选择性为60%,则
的选择性为60%,则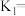
___________ 。( 的选择性
的选择性 )
)
 、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:
、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:Ⅰ.烟气经
 预处理后用
预处理后用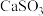 水悬浮液吸收,可减少烟气中
水悬浮液吸收,可减少烟气中 、NO的含量。
、NO的含量。 氧化烟气中
氧化烟气中 、
、 ,的主要反应的热化学方程式为:
,的主要反应的热化学方程式为: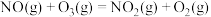
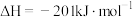
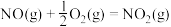
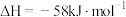
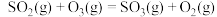
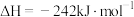
(1)反应
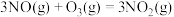 的
的
 。
。(2)室温下,固定进入反应器的NO、
 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中n(NO)、n(
的物质的量,反应一段时间后体系中n(NO)、n( )和n(
)和n( )随反应前n(
)随反应前n( ):n(NO)的变化见图:
):n(NO)的变化见图:
当n(
 ):n(NO)
):n(NO)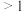 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是 ),
), 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是(3)当用
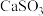 水悬浮液吸收经
水悬浮液吸收经 预处理的烟气时,清液(pH约为8)中
预处理的烟气时,清液(pH约为8)中 将
将 转化为
转化为 ,其离子方程式为
,其离子方程式为Ⅱ.NaClO溶液在不同温度下也可对烟气中的硫、硝脱除,一定时间内,其脱除率如下图所示。

(4)烟气中
 和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n(
和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n( ):n(
):n( )
)
Ⅲ.可利用CO为还原剂在催化剂作用下将NO脱除并转化为
 和
和 。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下:
。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下: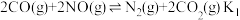

(5)下述情况能说明反应体系已达到平衡的是
a.CO与NO转化率之比不再改变 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不变 d.v(CO):v(
 )
)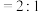
(6)若达到平衡时NO的转化率为80%,
 的选择性为60%,则
的选择性为60%,则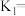
 的选择性
的选择性 )
)
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.“十四五”规划明确了“碳达峰、碳中和”工作的定位。某科研机构想利用CO2和H2合成燃料。已知:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2
③C(s)+2H2(g) CH4(g) ΔH3
CH4(g) ΔH3
④2CO(g) C(s)+CO2(g) ΔH4
C(s)+CO2(g) ΔH4
(1)试写出CO2与H2反应生成CH4和H2O(g)的热化学方程式为_______ 。
Ⅱ.CO2可用来生产燃料甲醇。CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得
CH3OH(g)+H2O(g) ΔH2=-49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得 的浓度随时间的变化如表所示:
的浓度随时间的变化如表所示:
(2)H2的平衡转化率=_______ 该条件下上述反应的平衡常数K=_______ 。
(3)下列措施中能使平衡体系中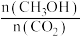 增大且不减慢化学反应速率的是_______。
增大且不减慢化学反应速率的是_______。
(4)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1_______ c2(填“>”、“<”或“=”)。
(5)要提高CO2的转化率,可以采取的措施是_______(填序号)。
(6)T℃时,向恒容密闭容器中充入CO2和H2,发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H。在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如下图所示。
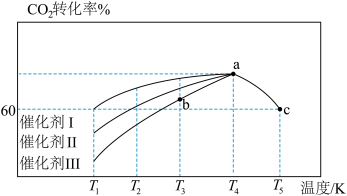
则催化效果最佳的是催化剂_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1②CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2③C(s)+2H2(g)
 CH4(g) ΔH3
CH4(g) ΔH3④2CO(g)
 C(s)+CO2(g) ΔH4
C(s)+CO2(g) ΔH4(1)试写出CO2与H2反应生成CH4和H2O(g)的热化学方程式为
Ⅱ.CO2可用来生产燃料甲醇。CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得
CH3OH(g)+H2O(g) ΔH2=-49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得 的浓度随时间的变化如表所示:
的浓度随时间的变化如表所示:| 时间/min | 0 | 3 | 5 | 10 | 15 |
| 浓度/mol/L | 0 | 0.3 | 0.45 | 0.5 | 0.5 |
(3)下列措施中能使平衡体系中
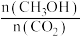 增大且不减慢化学反应速率的是_______。
增大且不减慢化学反应速率的是_______。| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.再充入1molH2 | D.将H2O(g)从体系中分离出去 |
(5)要提高CO2的转化率,可以采取的措施是_______(填序号)。
| A.加入催化剂 | B.增大CO2的浓度 | C.通入惰性气体 | D.通入H2 |

则催化效果最佳的是催化剂
您最近一年使用:0次
2023-03-29更新
|
138次组卷
|
2卷引用:湖北省老河口市高级中学2022-2023学年高二下学期期中考试化学试题
6 . 碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566kJ⋅mol-1
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ⋅mol-1
CO(g)+2H2(g)=CH3OH(g) △H3=-107kJ⋅mol-1
则2CO2(g)+4H2O(g)=2CH3OH(g)+3O2(g) △H=___________ kJ⋅mol-1
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
①在0~5min内容器中v(H2)=___________ 。
②反应过程中,下列各项指标能表明A容器中反应的v正<v逆的是___________ (填标号)。
a、体系内的压强增大
b、气体的平均相对分子质量减小
c、H2O(g)的物质的量增加
d、v正(CO2)=v逆(H2)
(3)T℃时,通入1.0molCO和3.0molH2于恒压容器(带可移动活塞)中,起始容积为2L,发生反应:CO(g)+2H2(g) CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
①该温度下上述反应的平衡常数K=___________ ;平衡时H2的转化率是___________ 。
②若达平衡后,再充入1.0molCO、4.0molH2、1.0molCH3OH,平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。新平衡时H2的转化率___________ (填“增大”、“不变”或“减小”)
(1)已知:2CO(g)+O2(g)=2CO2(g) △H1=-566kJ⋅mol-1
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ⋅mol-1
CO(g)+2H2(g)=CH3OH(g) △H3=-107kJ⋅mol-1
则2CO2(g)+4H2O(g)=2CH3OH(g)+3O2(g) △H=
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g) △H=50kJ⋅mol-1,5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:①在0~5min内容器中v(H2)=
②反应过程中,下列各项指标能表明A容器中反应的v正<v逆的是
a、体系内的压强增大
b、气体的平均相对分子质量减小
c、H2O(g)的物质的量增加
d、v正(CO2)=v逆(H2)
(3)T℃时,通入1.0molCO和3.0molH2于恒压容器(带可移动活塞)中,起始容积为2L,发生反应:CO(g)+2H2(g)
 CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:①该温度下上述反应的平衡常数K=
②若达平衡后,再充入1.0molCO、4.0molH2、1.0molCH3OH,平衡
您最近一年使用:0次
解题方法
7 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是_______(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得:2HCl(g)=H2(g)+Cl2(g) △H=_______ kJ/mol
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.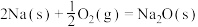
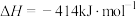
II.
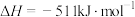
写出Na2O2与Na反应生成Na2O的热化学方程式:_______ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
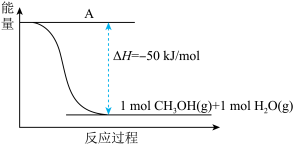
①补全上图:图中A处应填入_______ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H_______ (填“变大”“变小”或“不变”)。
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
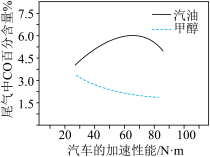
据图信息分析,与汽油相比,甲醇作为燃料的优点是_______ 。
(1)下列反应中,属于吸热反应的是_______(填字母)。
| A.NaHCO3与盐酸反应 | B.甲烷的燃烧反应 |
| C.Ba(OH)2·8H2O与氯化铵反应 | D.锌与盐酸反应 |
①通过化学键的键能计算。已知:
| 化学键种类 | H-H | Cl-Cl | H-Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.
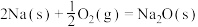
II.

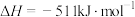
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

①补全上图:图中A处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

据图信息分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
2022-11-29更新
|
113次组卷
|
2卷引用:湖北省武汉市问津联合体2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
8 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与储存,过程如下:
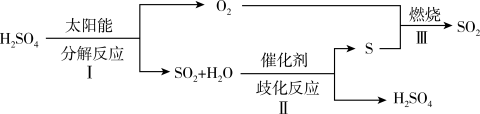
(1)反应I由两步反应完成:a. H2SO4(l) SO3(g)+H2O(g) △H1 = +177 kJ/mol
SO3(g)+H2O(g) △H1 = +177 kJ/mol
b. 2SO3(g) 2SO2(g) +O2(g) △H2 = +197 kJ/mol
2SO2(g) +O2(g) △H2 = +197 kJ/mol
①请写出反应I的热化学反应方程式:_________________________________ 。
②硫酸工业中可通过反应b的逆反应合成SO3,下表列出了不同温度、压强下SO2的平衡转化率:
在实际生产中,选定温度为400~500 ℃的原因是_________________ ;选定压强为常压的原因是_____________________ 。
(2) 可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
i.SO2+4I-+4H+= S↓+2I2+2H2O ii.
某实验小组为探究i、ii反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①请补全反应ii:___________________________________ 。
②比较A、B、C,可得出的结论是:______________________ 。
③D是A的对比实验,则a=__________ 。
④实验表明,SO2的歧化反应速率D>A,则反应速率:i____ ii(填“>”、“=”或“<”)。

(1)反应I由两步反应完成:a. H2SO4(l)
 SO3(g)+H2O(g) △H1 = +177 kJ/mol
SO3(g)+H2O(g) △H1 = +177 kJ/molb. 2SO3(g)
 2SO2(g) +O2(g) △H2 = +197 kJ/mol
2SO2(g) +O2(g) △H2 = +197 kJ/mol①请写出反应I的热化学反应方程式:
②硫酸工业中可通过反应b的逆反应合成SO3,下表列出了不同温度、压强下SO2的平衡转化率:
温度/℃ | SO2的平衡转化率/% | ||||
0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
在实际生产中,选定温度为400~500 ℃的原因是
(2)
 可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:i.SO2+4I-+4H+= S↓+2I2+2H2O ii.
某实验小组为探究i、ii反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
试剂组成 | 0.4 mol/L KI | 0.4 mol/L KI 0.2 mol/L H2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI a mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色成黄色,出现浑浊较A快 |
①请补全反应ii:
②比较A、B、C,可得出的结论是:
③D是A的对比实验,则a=
④实验表明,SO2的歧化反应速率D>A,则反应速率:i
您最近一年使用:0次
解题方法
9 . 研究 的捕集、回收、转化,对实现节能减排、资源利用、“碳中和”等目标具有重要意义。
的捕集、回收、转化,对实现节能减排、资源利用、“碳中和”等目标具有重要意义。
Ⅰ.将 还原成甲烷:
还原成甲烷:
ⅰ.Sabatier反应: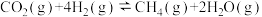

ⅱ.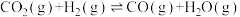
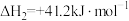
ⅲ.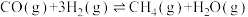
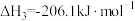
(1)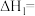
________ 。
(2)不同条件下按照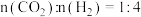 投料发生如上反应,
投料发生如上反应, 平衡转化率如图1所示。压强
平衡转化率如图1所示。压强 、
、 、
、 由小到大的顺序是
由小到大的顺序是________ ;压强为 时,随着温度升高,
时,随着温度升高, 的平衡转化率先减小后增大,解释温度高于600℃之后,随着温度升高
的平衡转化率先减小后增大,解释温度高于600℃之后,随着温度升高 转化率增大的原因是
转化率增大的原因是________ 。
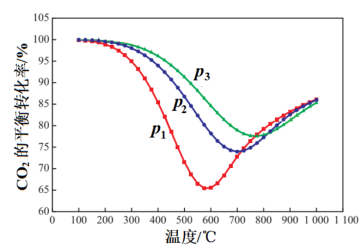
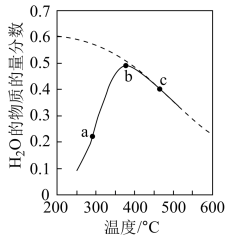
图1 图2
(3)按照 置于恒容密闭容器中发生如上反应,测得
置于恒容密闭容器中发生如上反应,测得 的物质的量分数与温度的关系如图2所示(虚线表示平衡曲线)。a、b、c三点的逆反应速率,
的物质的量分数与温度的关系如图2所示(虚线表示平衡曲线)。a、b、c三点的逆反应速率,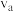 、
、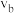 、
、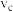 由大到小排序为
由大到小排序为________ ;高于380℃后, 的物质的量分数随温度升高而降低的原因是
的物质的量分数随温度升高而降低的原因是________________ 。
Ⅱ.将 还原成碳单质:Bosch反应:
还原成碳单质:Bosch反应: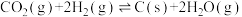
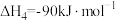
(4)Bosch反应自发进行,低温更有利于平衡正向移动,但是Bosch反应必须在高温下才能启动,原因是________________ 。
(5) 捕集和转化原理如图3所示。反应①完成之后,以
捕集和转化原理如图3所示。反应①完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图4所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图4所示。反应过程中始终未检测到 ,在催化剂上检测到有积炭。下列有关说法正确的是
,在催化剂上检测到有积炭。下列有关说法正确的是_________
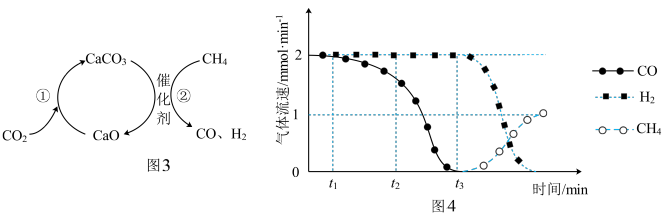
a.反应①为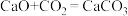 ;反应②为
;反应②为
b.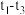 ,
, 比
比 多,且生成的
多,且生成的 速率不变,推测有副反应
速率不变,推测有副反应
c. 时刻,副反应生成
时刻,副反应生成 的速率大于反应②生成
的速率大于反应②生成 的速率
的速率
d. 之后,生成CO的速率为0,是因为反应②不再发生
之后,生成CO的速率为0,是因为反应②不再发生
 的捕集、回收、转化,对实现节能减排、资源利用、“碳中和”等目标具有重要意义。
的捕集、回收、转化,对实现节能减排、资源利用、“碳中和”等目标具有重要意义。Ⅰ.将
 还原成甲烷:
还原成甲烷:ⅰ.Sabatier反应:
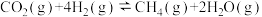

ⅱ.
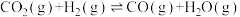
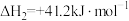
ⅲ.
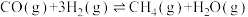
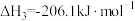
(1)
(2)不同条件下按照
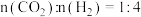 投料发生如上反应,
投料发生如上反应, 平衡转化率如图1所示。压强
平衡转化率如图1所示。压强 、
、 、
、 由小到大的顺序是
由小到大的顺序是 时,随着温度升高,
时,随着温度升高, 的平衡转化率先减小后增大,解释温度高于600℃之后,随着温度升高
的平衡转化率先减小后增大,解释温度高于600℃之后,随着温度升高 转化率增大的原因是
转化率增大的原因是

图1 图2
(3)按照
 置于恒容密闭容器中发生如上反应,测得
置于恒容密闭容器中发生如上反应,测得 的物质的量分数与温度的关系如图2所示(虚线表示平衡曲线)。a、b、c三点的逆反应速率,
的物质的量分数与温度的关系如图2所示(虚线表示平衡曲线)。a、b、c三点的逆反应速率, 、
、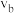 、
、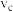 由大到小排序为
由大到小排序为 的物质的量分数随温度升高而降低的原因是
的物质的量分数随温度升高而降低的原因是Ⅱ.将
 还原成碳单质:Bosch反应:
还原成碳单质:Bosch反应: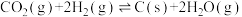
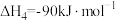
(4)Bosch反应自发进行,低温更有利于平衡正向移动,但是Bosch反应必须在高温下才能启动,原因是
(5)
 捕集和转化原理如图3所示。反应①完成之后,以
捕集和转化原理如图3所示。反应①完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图4所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图4所示。反应过程中始终未检测到 ,在催化剂上检测到有积炭。下列有关说法正确的是
,在催化剂上检测到有积炭。下列有关说法正确的是
a.反应①为
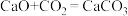 ;反应②为
;反应②为
b.
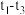 ,
, 比
比 多,且生成的
多,且生成的 速率不变,推测有副反应
速率不变,推测有副反应
c.
 时刻,副反应生成
时刻,副反应生成 的速率大于反应②生成
的速率大于反应②生成 的速率
的速率d.
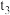 之后,生成CO的速率为0,是因为反应②不再发生
之后,生成CO的速率为0,是因为反应②不再发生
您最近一年使用:0次
解题方法
10 .  、
、 是主要的空气污染源,需要经过处理才能排放。回答下列问题:
是主要的空气污染源,需要经过处理才能排放。回答下列问题:
(1)二氧化硫在 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。
热化学方程式为: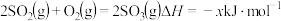 ,其催化机理如下:
,其催化机理如下:
第1步: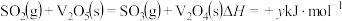
第2步: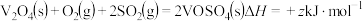
第3步:___________ 。(写热化学方程式,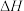 的值用x、y、z的代数式表示)。
的值用x、y、z的代数式表示)。
(2)燃煤发电厂常利用反应
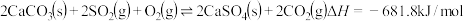 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①0~20min内平均反应速率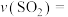
___________ 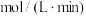
②请写出平衡常数表达式K=___________ 。
(3) 的排放主要自于汽车尾气,有人利用反应
的排放主要自于汽车尾气,有人利用反应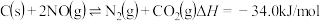 ,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示:
,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示:___________ ;在1100K时, 的体积分数为
的体积分数为___________ 。
(4)NO氧化反应: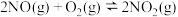 分两步进行,其反应过程能量变化示意图如图乙。
分两步进行,其反应过程能量变化示意图如图乙。
查阅资料知:
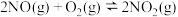 的反应历程分两步:
的反应历程分两步:
Ⅰ: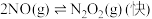 ,
,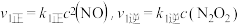
Ⅱ: ,
,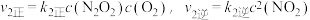
①决定NO氧化反应速率的步骤是___________ (填“Ⅰ”或“Ⅱ”)。
②升高温度绝大多数的化学反应速率增大,但是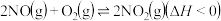 的速率却随温度的升高而减小,原因是
的速率却随温度的升高而减小,原因是___________ (填字母)
a、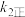 增大,
增大,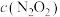 增大b、
增大b、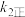 减小,
减小,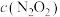 减小
减小
c、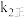 增大,
增大,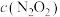 减小d、
减小d、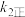 减小,
减小,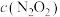 增大
增大
③由实验数据得到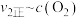 的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为
的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________ (填字母)。
 、
、 是主要的空气污染源,需要经过处理才能排放。回答下列问题:
是主要的空气污染源,需要经过处理才能排放。回答下列问题:(1)二氧化硫在
 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。热化学方程式为:
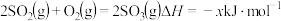 ,其催化机理如下:
,其催化机理如下:第1步:
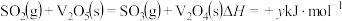
第2步:
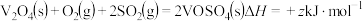
第3步:
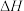 的值用x、y、z的代数式表示)。
的值用x、y、z的代数式表示)。(2)燃煤发电厂常利用反应
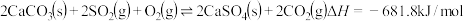 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:浓度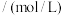 | 时间/min | |||||
| 0 | 10 | 20 | 30 | 40 | 50 | |
 | 1.00 | 0.79 | 0.60 | 0.56 | 0.56 | 0.56 |
 | 0 | 0.42 | 0.80 | 0.88 | 0.88 | 0.88 |
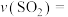
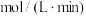
②请写出平衡常数表达式K=
(3)
 的排放主要自于汽车尾气,有人利用反应
的排放主要自于汽车尾气,有人利用反应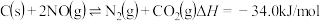 ,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示:
,用活性炭对NO进行处理。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图甲所示: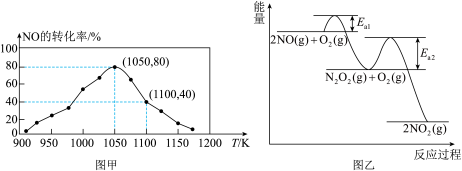
 的体积分数为
的体积分数为(4)NO氧化反应:
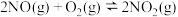 分两步进行,其反应过程能量变化示意图如图乙。
分两步进行,其反应过程能量变化示意图如图乙。查阅资料知:
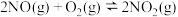 的反应历程分两步:
的反应历程分两步:Ⅰ:
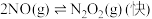 ,
,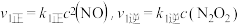
Ⅱ:
 ,
,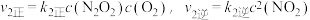
①决定NO氧化反应速率的步骤是
②升高温度绝大多数的化学反应速率增大,但是
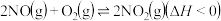 的速率却随温度的升高而减小,原因是
的速率却随温度的升高而减小,原因是a、
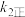 增大,
增大,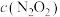 增大b、
增大b、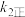 减小,
减小,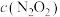 减小
减小c、
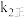 增大,
增大,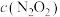 减小d、
减小d、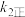 减小,
减小,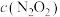 增大
增大③由实验数据得到
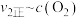 的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为
的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为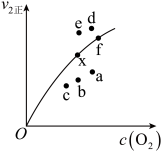
您最近一年使用:0次



