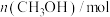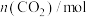1 . 乙醇水蒸气重整制氢是生物质制氢的重要方法,有关反应如下:
ⅰ.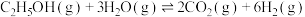
 (主反应)
(主反应)
ⅱ.

ⅲ.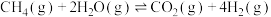

ⅳ.

(1)反应ⅳ的
_________  。
。
(2)A.Akande等研究了以Ni/ 为催化剂的乙醇水蒸气重整反应。下列说法正确的是
为催化剂的乙醇水蒸气重整反应。下列说法正确的是_________ (填标号)。
A.Ni/ 能改变重整反应的历程,增大活化分子百分数
能改变重整反应的历程,增大活化分子百分数
B.使用适宜的催化剂提高 的选择性,从而提高
的选择性,从而提高 的平衡产率
的平衡产率
C.Ni/ 能降低重整反应的活化能,大幅增大反应的速率常数
能降低重整反应的活化能,大幅增大反应的速率常数
(3)在2L刚性容器中,充入1mol (g)和若干
(g)和若干 (g),平衡时产生
(g),平衡时产生 物质的量与温度、水-乙醇比(水与乙醇物质的量比)的关系如图1所示(曲线上标注的数字为
物质的量与温度、水-乙醇比(水与乙醇物质的量比)的关系如图1所示(曲线上标注的数字为 物质的量/mol)。900K时,
物质的量/mol)。900K时,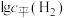 与
与 的关系如图2所示。
的关系如图2所示。_________________ 。水-乙醇比=7:1时,产生氢气的量随温度升高的变化趋势是_______________ 。
②降低温度,图2中Q点不可能变为点_________ (填“A”或“B”)。
③900K,在2L刚性容器中,充入1mo (g)和7mol
(g)和7mol  (g),以Ni/
(g),以Ni/ 为催化剂,40min达到平衡,测得
为催化剂,40min达到平衡,测得 ,且在含碳产物中的体积分数为b%,则反应ⅱ平衡常数=
,且在含碳产物中的体积分数为b%,则反应ⅱ平衡常数=__________ ,0~40min用 (g)表示的反应速率为
(g)表示的反应速率为_________  (用含a、b的式子表示,下同),
(用含a、b的式子表示,下同),
_________  。
。
ⅰ.
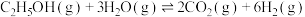
 (主反应)
(主反应)ⅱ.


ⅲ.
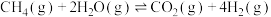

ⅳ.


(1)反应ⅳ的

 。
。(2)A.Akande等研究了以Ni/
 为催化剂的乙醇水蒸气重整反应。下列说法正确的是
为催化剂的乙醇水蒸气重整反应。下列说法正确的是A.Ni/
 能改变重整反应的历程,增大活化分子百分数
能改变重整反应的历程,增大活化分子百分数B.使用适宜的催化剂提高
 的选择性,从而提高
的选择性,从而提高 的平衡产率
的平衡产率C.Ni/
 能降低重整反应的活化能,大幅增大反应的速率常数
能降低重整反应的活化能,大幅增大反应的速率常数(3)在2L刚性容器中,充入1mol
 (g)和若干
(g)和若干 (g),平衡时产生
(g),平衡时产生 物质的量与温度、水-乙醇比(水与乙醇物质的量比)的关系如图1所示(曲线上标注的数字为
物质的量与温度、水-乙醇比(水与乙醇物质的量比)的关系如图1所示(曲线上标注的数字为 物质的量/mol)。900K时,
物质的量/mol)。900K时,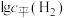 与
与 的关系如图2所示。
的关系如图2所示。
②降低温度,图2中Q点不可能变为点
③900K,在2L刚性容器中,充入1mo
 (g)和7mol
(g)和7mol  (g),以Ni/
(g),以Ni/ 为催化剂,40min达到平衡,测得
为催化剂,40min达到平衡,测得 ,且在含碳产物中的体积分数为b%,则反应ⅱ平衡常数=
,且在含碳产物中的体积分数为b%,则反应ⅱ平衡常数= (g)表示的反应速率为
(g)表示的反应速率为 (用含a、b的式子表示,下同),
(用含a、b的式子表示,下同),
 。
。
您最近一年使用:0次
2 . 一碳化学是化学反应过程中反应物只含一个碳原子的反应,一碳化学是从一碳氢化反应开始的,甲烷、一氧化碳是常见的一碳化学的原料。已知反应:
i.
ii.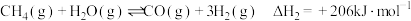
iii.
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解,该反应的热化学方程式为___________ ;反应i的正反应活化能为 ,则逆反应的活化能为
,则逆反应的活化能为___________  。
。
(2)向容积固定为 的密闭容器内充入
的密闭容器内充入 和
和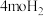 ,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:
,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:
①从开始到 时,以CO浓度变化表示的平均反应速率
时,以CO浓度变化表示的平均反应速率
___________ 。
②反应达到平衡的时间段是___________ (填“ ”或“
”或“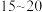 ”)min;该温度下,反应iii的平衡常数
”)min;该温度下,反应iii的平衡常数
___________ 。
③平衡后,下列措施中能使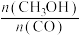 增大的有
增大的有___________ (填字母)。
a.升高温度 b.充入氦气 c.再充入 d.使用催化剂
d.使用催化剂
(3)电喷雾电离等方法得到的(
 、
、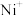 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成
反应能高选择性地生成 ,体系的能量随反应进程的变化如图所示:
,体系的能量随反应进程的变化如图所示: 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线___________ (填“a”或“b”)。
②若 与
与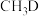 反应,生成的氘代甲醇有
反应,生成的氘代甲醇有___________ 种。
i.

ii.
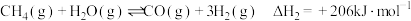
iii.

(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解,该反应的热化学方程式为
 ,则逆反应的活化能为
,则逆反应的活化能为 。
。(2)向容积固定为
 的密闭容器内充入
的密闭容器内充入 和
和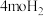 ,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:
,保持250℃发生反应iii,用压力计监测反应过程中容器内压强的变化如表:反应时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强 | p |  | 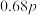 | x | 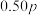 | 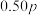 | 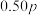 |
 时,以CO浓度变化表示的平均反应速率
时,以CO浓度变化表示的平均反应速率
②反应达到平衡的时间段是
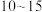 ”或“
”或“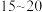 ”)min;该温度下,反应iii的平衡常数
”)min;该温度下,反应iii的平衡常数
③平衡后,下列措施中能使
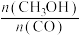 增大的有
增大的有a.升高温度 b.充入氦气 c.再充入
 d.使用催化剂
d.使用催化剂(3)电喷雾电离等方法得到的(

 、
、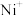 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成
反应能高选择性地生成 ,体系的能量随反应进程的变化如图所示:
,体系的能量随反应进程的变化如图所示: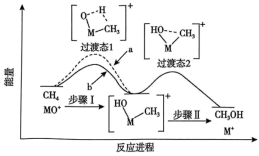
 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线②若
 与
与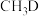 反应,生成的氘代甲醇有
反应,生成的氘代甲醇有
您最近一年使用:0次
名校
3 . 化学反应过程不仅发生了物质变化,还存在能量的变化,最主要的能量形式为热能和电能,根据题目要求回答以下问题:
(1)工业合成氨的反应 是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知断裂1mol相应化学键需要的能量如下,若反应生成1.5mol
是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知断裂1mol相应化学键需要的能量如下,若反应生成1.5mol  (g),可
(g),可___________ (填“吸收”或“放出”)热量___________ kJ。
(2)在100℃时,将0.4mol  放入2L的真空容器中发生反应:
放入2L的真空容器中发生反应: 。测得容器内气体的物质的量随时间变化如下表:
。测得容器内气体的物质的量随时间变化如下表:
①上述条件下。前20s内以 表示的平均化学反应速率为
表示的平均化学反应速率为___________ ;达到平衡状态时, 的转化率是
的转化率是___________ 。
②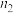
___________ 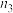 (填“>”、=”、“<”)。
(填“>”、=”、“<”)。
(3)铅蓄电池是常用的化学电源。汽车中的电瓶使用的就是铅酸电池,工作时电池总反应为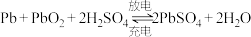 ,下列说法正确的是___________(请用相应字母填空)
,下列说法正确的是___________(请用相应字母填空)
(4)甲醇( )—空气燃料电池是一种高效能、轻污染的车载电池,以KOH为电解质溶液。通入氧气的电极为感料电池的
)—空气燃料电池是一种高效能、轻污染的车载电池,以KOH为电解质溶液。通入氧气的电极为感料电池的___________ (填“正”或“负”)极,负极发生的电极反应式为___________ 。
(1)工业合成氨的反应
 是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知断裂1mol相应化学键需要的能量如下,若反应生成1.5mol
是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂,已知断裂1mol相应化学键需要的能量如下,若反应生成1.5mol  (g),可
(g),可| 化学键 | H—H | N—H | N≡N |
| 能量 | 436kJ | 391kJ | 946kJ |
 放入2L的真空容器中发生反应:
放入2L的真空容器中发生反应: 。测得容器内气体的物质的量随时间变化如下表:
。测得容器内气体的物质的量随时间变化如下表:| 时间/s | 0 | 20 | 40 | 60 | 80 |
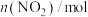 | 0.4 |  | 0.26 | 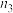 | 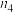 |
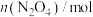 | 0 | 0.05 | 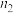 | 0.08 | 0.08 |
 表示的平均化学反应速率为
表示的平均化学反应速率为 的转化率是
的转化率是②
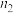
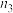 (填“>”、=”、“<”)。
(填“>”、=”、“<”)。(3)铅蓄电池是常用的化学电源。汽车中的电瓶使用的就是铅酸电池,工作时电池总反应为
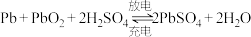 ,下列说法正确的是___________(请用相应字母填空)
,下列说法正确的是___________(请用相应字母填空)A.放电时,负极的电极反应式为: |
| B.放电时,正极附近溶液pH增大 |
| C.充电时,理论上每消耗30.3g硫酸铅,外电路中转移的电子为0.2mol |
| D.放电时,电池两电极的质量均增加 |
 )—空气燃料电池是一种高效能、轻污染的车载电池,以KOH为电解质溶液。通入氧气的电极为感料电池的
)—空气燃料电池是一种高效能、轻污染的车载电池,以KOH为电解质溶液。通入氧气的电极为感料电池的
您最近一年使用:0次
解题方法
4 . 利用 生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。
生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。
Ⅰ. 催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生如下反应:
催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生如下反应:
i
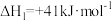
ii
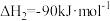
iii

回答下列问题:
(1)反应iii的
_______  。
。
(2)将 和
和 的混合气体充入一恒容密闭容器,加入催化剂发生反应。平衡时,
的混合气体充入一恒容密闭容器,加入催化剂发生反应。平衡时, 转化率、
转化率、 产率及
产率及 选择性随温度的变化如图。
选择性随温度的变化如图。
已知: 选择性
选择性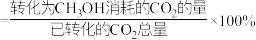
 平衡产率随温度变化的曲线为
平衡产率随温度变化的曲线为_______ (填“a”或“b”)。
②图中 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是_______ 。
③已知反应i的正反应速率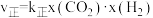 ,逆反应速率
,逆反应速率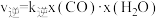 (
( 、
、 为速率常数,
为速率常数, 为物质的量分数)。
为物质的量分数)。 温度下,平衡时
温度下,平衡时 ,
, 温度下,平衡时
温度下,平衡时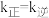 。由此推知,
。由此推知,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
④原料气的平均相对分子质量为26,270℃时, 平衡产率为12.5%,反应i的
平衡产率为12.5%,反应i的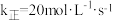 ,平衡时反应i的
,平衡时反应i的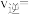
_______  (保留三位有效数字);反应ii的
(保留三位有效数字);反应ii的
_______ 。
Ⅱ. 催化加氢制备低碳烯烃(2~4个C的烯烃)
催化加氢制备低碳烯烃(2~4个C的烯烃)
某研究小组使用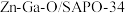 双功能催化剂实现了
双功能催化剂实现了 合成低碳烯烃,其可能的反应历程如图。
合成低碳烯烃,其可能的反应历程如图。 在
在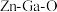 表面解离产生的
表面解离产生的 参与
参与 的还原过程,SAPO-34将催化生成的甲醇转化为低碳烯烃(
的还原过程,SAPO-34将催化生成的甲醇转化为低碳烯烃(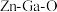 无催化活性,形成氧空位后有助于
无催化活性,形成氧空位后有助于 的活化)。
的活化)。
(3)理论上,反应历程中消耗的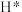 与
与 的物质的量之比为
的物质的量之比为_______ 。
(4)若原料气中 比例过低会减弱催化剂活性,原因是
比例过低会减弱催化剂活性,原因是_______ 。
 生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。
生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。Ⅰ.
 催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生如下反应:
催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生如下反应:i

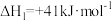
ii

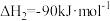
iii


回答下列问题:
(1)反应iii的

 。
。(2)将
 和
和 的混合气体充入一恒容密闭容器,加入催化剂发生反应。平衡时,
的混合气体充入一恒容密闭容器,加入催化剂发生反应。平衡时, 转化率、
转化率、 产率及
产率及 选择性随温度的变化如图。
选择性随温度的变化如图。已知:
 选择性
选择性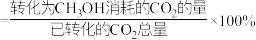

 平衡产率随温度变化的曲线为
平衡产率随温度变化的曲线为②图中
 转化率随温度升高而增大的原因可能是
转化率随温度升高而增大的原因可能是③已知反应i的正反应速率
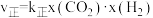 ,逆反应速率
,逆反应速率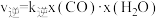 (
( 、
、 为速率常数,
为速率常数, 为物质的量分数)。
为物质的量分数)。 温度下,平衡时
温度下,平衡时 ,
, 温度下,平衡时
温度下,平衡时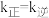 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。④原料气的平均相对分子质量为26,270℃时,
 平衡产率为12.5%,反应i的
平衡产率为12.5%,反应i的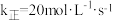 ,平衡时反应i的
,平衡时反应i的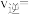
 (保留三位有效数字);反应ii的
(保留三位有效数字);反应ii的
Ⅱ.
 催化加氢制备低碳烯烃(2~4个C的烯烃)
催化加氢制备低碳烯烃(2~4个C的烯烃)某研究小组使用
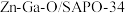 双功能催化剂实现了
双功能催化剂实现了 合成低碳烯烃,其可能的反应历程如图。
合成低碳烯烃,其可能的反应历程如图。 在
在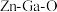 表面解离产生的
表面解离产生的 参与
参与 的还原过程,SAPO-34将催化生成的甲醇转化为低碳烯烃(
的还原过程,SAPO-34将催化生成的甲醇转化为低碳烯烃(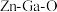 无催化活性,形成氧空位后有助于
无催化活性,形成氧空位后有助于 的活化)。
的活化)。
(3)理论上,反应历程中消耗的
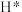 与
与 的物质的量之比为
的物质的量之比为(4)若原料气中
 比例过低会减弱催化剂活性,原因是
比例过低会减弱催化剂活性,原因是
您最近一年使用:0次
名校
5 . 回答下列问题:
I.硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是
 放热反应
放热反应
一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。 的平均反应速率为
的平均反应速率为_______ 。
(2)图中a点,正反应速率_______ 逆反应速率(填“>”“<”或“=”)。
(3)当反应达到平衡时, 的转化率为
的转化率为_______ %。
(4)下列能说明反应一定已达平衡的是_______(填标号)。
(5)下列说法错误的是_______(填标号)。
II.燃料电池能有效提高能源利用率。
(6)写出甲醇 空气燃料电池在碱性条件(KOH溶液)中的负极电极反应式
空气燃料电池在碱性条件(KOH溶液)中的负极电极反应式_______ 。
I.硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是
 放热反应
放热反应一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。

 的平均反应速率为
的平均反应速率为(2)图中a点,正反应速率
(3)当反应达到平衡时,
 的转化率为
的转化率为(4)下列能说明反应一定已达平衡的是_______(填标号)。
| A.混合气体的密度不再变化 | B. 质量保持不变 质量保持不变 |
C. | D. 、 、 和 和 的物质的量之比为2:1:2 的物质的量之比为2:1:2 |
(5)下列说法错误的是_______(填标号)。
| A.提高反应时的温度,正反应的速率加快,逆反应的速率减慢 |
B.提高反应时的温度,可以实现 的完全转化 的完全转化 |
| C.通过调控反应条件,可以提高该反应进行的程度 |
| D.使用催化剂是为了增大反应速率,提高生产效率 |
II.燃料电池能有效提高能源利用率。
(6)写出甲醇
 空气燃料电池在碱性条件(KOH溶液)中的负极电极反应式
空气燃料电池在碱性条件(KOH溶液)中的负极电极反应式
您最近一年使用:0次
6 . 甲醛释氢对氢能源和含甲醛污水处理有重要意义。
(1) 电催化释氢
电催化释氢
催化电解含较低浓度的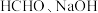 混合溶液,可获得
混合溶液,可获得 与
与 (如图所示)、其中电极b表面覆盖一种
(如图所示)、其中电极b表面覆盖一种 与P形成的化合物(晶胞结构如图所示)作催化剂。
与P形成的化合物(晶胞结构如图所示)作催化剂。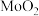 与
与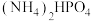 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为___________ 。
②电解时,电极b上同时产生 与
与 的物质的量之比为
的物质的量之比为 、则电极b上的电极反应式为
、则电极b上的电极反应式为___________ ,此种情况下,电解过程中每产生 ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为___________  。
。
(2) 水化释氧
水化释氧
45℃时,碱性条件下 作催化剂可将甲醛转化为
作催化剂可将甲醛转化为 ,反应的机理如图所示:
,反应的机理如图所示: 颗粒负载在
颗粒负载在 表面以防止纳米
表面以防止纳米 团聚,其他条件不变,反应相同时间,
团聚,其他条件不变,反应相同时间, 浓度对氢气产生快慢的影响如图所示:
浓度对氢气产生快慢的影响如图所示: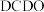 ,得到的氢气产物为
,得到的氢气产物为___________ (填化学式)。
②若 浓度过大,
浓度过大,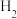 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是___________ 。
(3)氢气在化学工业中应用广泛,一定条件下,在某恒容密闭容器中,按投料比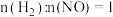 发生如下反应:
发生如下反应: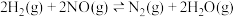
①下列能够说明该反应已达到化学平衡状态的是___________ (填标号)。
A. B.混合气体的密度不再变化
B.混合气体的密度不再变化
C.容器内总压强不再变化 D.混合气体的平均相对分子质量不再变化
②研究表明该反应速率方程式为 ,其中k为速率常数。与温度、活化能有关,若投料比
,其中k为速率常数。与温度、活化能有关,若投料比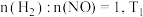 时的初始速率为
时的初始速率为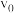 ,当
,当 转化率为
转化率为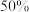 时,反应速率为
时,反应速率为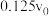 ,由此可知
,由此可知
___________ ;设此时反应的活化能为 ,不同温度
,不同温度 条件下对应的速率常数分别为
条件下对应的速率常数分别为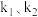 ,存在关系:
,存在关系: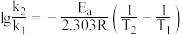 (R为常数),据此推测:升高一定温度,活化能越大,速率常数增大倍数
(R为常数),据此推测:升高一定温度,活化能越大,速率常数增大倍数___________ (填“越大”“越小”或“不变”)。
(1)
 电催化释氢
电催化释氢催化电解含较低浓度的
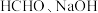 混合溶液,可获得
混合溶液,可获得 与
与 (如图所示)、其中电极b表面覆盖一种
(如图所示)、其中电极b表面覆盖一种 与P形成的化合物(晶胞结构如图所示)作催化剂。
与P形成的化合物(晶胞结构如图所示)作催化剂。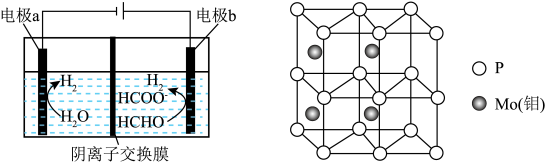
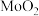 与
与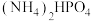 混合物与
混合物与 高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为
高温灼烧制得(反应中N元素化合价不变),该反应的化学方程式为②电解时,电极b上同时产生
 与
与 的物质的量之比为
的物质的量之比为 、则电极b上的电极反应式为
、则电极b上的电极反应式为 ,通过阴离子交换膜的
,通过阴离子交换膜的 为
为 。
。(2)
 水化释氧
水化释氧45℃时,碱性条件下
 作催化剂可将甲醛转化为
作催化剂可将甲醛转化为 ,反应的机理如图所示:
,反应的机理如图所示: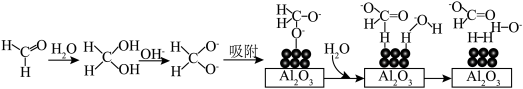
 颗粒负载在
颗粒负载在 表面以防止纳米
表面以防止纳米 团聚,其他条件不变,反应相同时间,
团聚,其他条件不变,反应相同时间, 浓度对氢气产生快慢的影响如图所示:
浓度对氢气产生快慢的影响如图所示: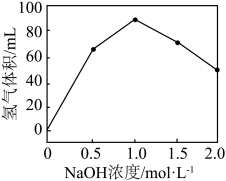
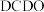 ,得到的氢气产物为
,得到的氢气产物为②若
 浓度过大,
浓度过大,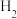 的产生迅速减慢的原因可能是
的产生迅速减慢的原因可能是(3)氢气在化学工业中应用广泛,一定条件下,在某恒容密闭容器中,按投料比
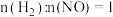 发生如下反应:
发生如下反应: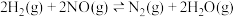
①下列能够说明该反应已达到化学平衡状态的是
A.
 B.混合气体的密度不再变化
B.混合气体的密度不再变化C.容器内总压强不再变化 D.混合气体的平均相对分子质量不再变化
②研究表明该反应速率方程式为
 ,其中k为速率常数。与温度、活化能有关,若投料比
,其中k为速率常数。与温度、活化能有关,若投料比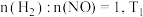 时的初始速率为
时的初始速率为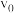 ,当
,当 转化率为
转化率为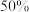 时,反应速率为
时,反应速率为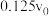 ,由此可知
,由此可知
 ,不同温度
,不同温度 条件下对应的速率常数分别为
条件下对应的速率常数分别为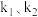 ,存在关系:
,存在关系: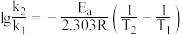 (R为常数),据此推测:升高一定温度,活化能越大,速率常数增大倍数
(R为常数),据此推测:升高一定温度,活化能越大,速率常数增大倍数
您最近一年使用:0次
7 .  具备高储氢密度和低成本优势,被认为是极具应用潜力的储氢材料。请回答:
具备高储氢密度和低成本优势,被认为是极具应用潜力的储氢材料。请回答:
(1) 通过水解反应可高效制氢,反应有:
通过水解反应可高效制氢,反应有:
反应1: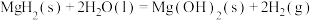
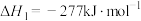
反应2: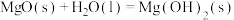
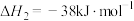
反应3:
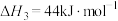
则: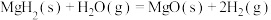

________ 
(2)等质量的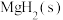 在不同环境下发生反应I的产氢率如下图所示:
在不同环境下发生反应I的产氢率如下图所示: 下发生水解,前3min放出
下发生水解,前3min放出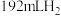 (已换算为标准状况),则水解反应中
(已换算为标准状况),则水解反应中 消耗速率为
消耗速率为________ 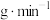 (计算结果保留3位小数)。
(计算结果保留3位小数)。
② 在
在 溶液中的产氢率明显快于纯水,已知该现象只与
溶液中的产氢率明显快于纯水,已知该现象只与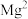 有关。
有关。 溶液能加快
溶液能加快 产氢速率的原因是
产氢速率的原因是________ 。
(3)在300-400℃和2.4~4MPa氢气压强下,Mg可与 反应:
反应: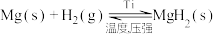 。
。
①恒容密闭容器中加入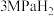 及足量
及足量 ,在四种温度下反应5min,
,在四种温度下反应5min, 的转化率如下表所示:
的转化率如下表所示:
400℃时,压强平衡常数
________  (
( 是用组分的平衡压强代替浓度而求得的平衡常数),下列说法正确的是
是用组分的平衡压强代替浓度而求得的平衡常数),下列说法正确的是________ (填序号)。
A.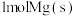 与
与 的总能量低于
的总能量低于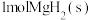 的能量
的能量
B.若在350℃下反应5min, 转化率大于50%
转化率大于50%
C.若360℃时反应持续至10min, 转化率增大
转化率增大
D.将 中的化学能转化为电能时,
中的化学能转化为电能时, 参与负极反应
参与负极反应
②贮氢合金中氢镁原子个数比为 ,当氢镁原子个数比为
,当氢镁原子个数比为 时恒温压缩容器,请画出气体压强p与x的变化曲线
时恒温压缩容器,请画出气体压强p与x的变化曲线_________ 。
 具备高储氢密度和低成本优势,被认为是极具应用潜力的储氢材料。请回答:
具备高储氢密度和低成本优势,被认为是极具应用潜力的储氢材料。请回答:(1)
 通过水解反应可高效制氢,反应有:
通过水解反应可高效制氢,反应有:反应1:
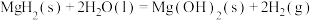
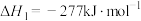
反应2:
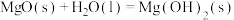
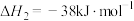
反应3:

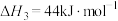
则:
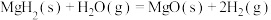


(2)等质量的
 在不同环境下发生反应I的产氢率如下图所示:
在不同环境下发生反应I的产氢率如下图所示: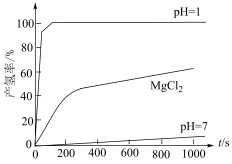
 下发生水解,前3min放出
下发生水解,前3min放出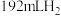 (已换算为标准状况),则水解反应中
(已换算为标准状况),则水解反应中 消耗速率为
消耗速率为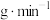 (计算结果保留3位小数)。
(计算结果保留3位小数)。②
 在
在 溶液中的产氢率明显快于纯水,已知该现象只与
溶液中的产氢率明显快于纯水,已知该现象只与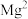 有关。
有关。 溶液能加快
溶液能加快 产氢速率的原因是
产氢速率的原因是(3)在300-400℃和2.4~4MPa氢气压强下,Mg可与
 反应:
反应: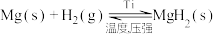 。
。①恒容密闭容器中加入
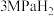 及足量
及足量 ,在四种温度下反应5min,
,在四种温度下反应5min, 的转化率如下表所示:
的转化率如下表所示:温度/℃ | 300 | 330 | 360 | 400 |
| 10% | 50% | 50% | 33.3% |

 (
( 是用组分的平衡压强代替浓度而求得的平衡常数),下列说法正确的是
是用组分的平衡压强代替浓度而求得的平衡常数),下列说法正确的是A.
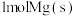 与
与 的总能量低于
的总能量低于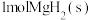 的能量
的能量B.若在350℃下反应5min,
 转化率大于50%
转化率大于50%C.若360℃时反应持续至10min,
 转化率增大
转化率增大D.将
 中的化学能转化为电能时,
中的化学能转化为电能时, 参与负极反应
参与负极反应②贮氢合金中氢镁原子个数比为
 ,当氢镁原子个数比为
,当氢镁原子个数比为 时恒温压缩容器,请画出气体压强p与x的变化曲线
时恒温压缩容器,请画出气体压强p与x的变化曲线
您最近一年使用:0次
8 . 完成下列问题:
(1)下图表示氢气燃烧生成水蒸气的物质及能量变化,已知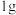 氢气完全燃烧生成水蒸气时放出热量
氢气完全燃烧生成水蒸气时放出热量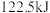 。
。________ 。
(2)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如图所示,________ 极(填“正”或“负”),电极反应式为________ 。
②该电池反应一段时间后,溶液中 变化为
变化为________ (填“增大”或“减小”或“不变”)。
(3)在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
①下列说法正确的是________ 。
A.反应达到平衡后,反应不再进行 B.使用催化剂可以增大反应速率,提高生产效率
C.改变条件, 可以
可以 转化为
转化为 D.通过调控反应条件,可以提高该反应进行的程度
D.通过调控反应条件,可以提高该反应进行的程度
② 内,
内,
________ 。第 时
时
________ (填“>”“<”或“=”)第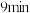 时
时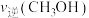 。
。
③为提高此反应的速率,下列措施可行的是________ (填字母)。
A.充入氦气 B.降低温度 C.使用适合催化剂 D.移出
(1)下图表示氢气燃烧生成水蒸气的物质及能量变化,已知
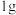 氢气完全燃烧生成水蒸气时放出热量
氢气完全燃烧生成水蒸气时放出热量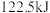 。
。
(2)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如图所示,

②该电池反应一段时间后,溶液中
 变化为
变化为(3)在容积为
 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。时间 |
|
|
|
|
|
| 0 | 0.50 | 0.65 | 0.75 | 0.75 |
| 1 | 0.50 | 0.35 | a | 0.25 |
A.反应达到平衡后,反应不再进行 B.使用催化剂可以增大反应速率,提高生产效率
C.改变条件,
 可以
可以 转化为
转化为 D.通过调控反应条件,可以提高该反应进行的程度
D.通过调控反应条件,可以提高该反应进行的程度②
 内,
内,
 时
时
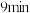 时
时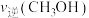 。
。③为提高此反应的速率,下列措施可行的是
A.充入氦气 B.降低温度 C.使用适合催化剂 D.移出

您最近一年使用:0次
解题方法
9 . 乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的75%以上,在国民经济中占有重要的地位。利用乙烷裂解制乙烯的反应为C2H6(g) C2H4(g)+H2(g)△H。
C2H4(g)+H2(g)△H。
(1)298K时,乙烷的裂解反应历程如图1所示,可能发生反应的平衡常数的对数值(lgK)与温度的倒数( )的关系如图2所示。
)的关系如图2所示。_____ (填“反应a”或“反应b”),乙烷裂解制乙烯的△H=_____ 。
②工业上一般选择温度在1000K左右裂解乙烷,可能的原因是_____ 。
(2)在恒温恒容条件下,下列情况表明反应C2H6(g) C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。
C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。
(3)在106kPa下,分别按照反应气组成n(C2H6):n(H2O)为1:1、1:4、1:9投料,C2H6的平衡转化率随反应温度的变化关系如图:_____ (填曲线标号)。
②图中Y点正反应速率和Z点逆反应速率的大小关系为v(Y)_____ (填“>”、“=”或“<”)v(Z)。
③在T4℃,按n(C2H6):n(H2O)=1:9投料时,若达到平衡所需要的时间为20min,则乙烷分压平均变化速率为_____ kPa/min,该反应的平衡常数Kp=_____ kPa(Kp为用分压表示的平衡常数,分压=总压×体积分数)。
 C2H4(g)+H2(g)△H。
C2H4(g)+H2(g)△H。(1)298K时,乙烷的裂解反应历程如图1所示,可能发生反应的平衡常数的对数值(lgK)与温度的倒数(
 )的关系如图2所示。
)的关系如图2所示。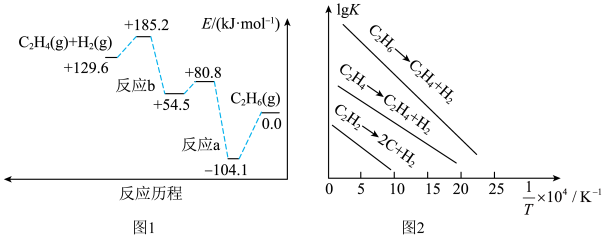
②工业上一般选择温度在1000K左右裂解乙烷,可能的原因是
(2)在恒温恒容条件下,下列情况表明反应C2H6(g)
 C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。
C2H4(g)+H2(g)达到平衡状态的是_____(填标号)。| A.混合气体密度保持不变 | B.气体总压强保持不变 |
| C.气体平均摩尔质量保持不变 | D.产物浓度之比保持不变 |
(3)在106kPa下,分别按照反应气组成n(C2H6):n(H2O)为1:1、1:4、1:9投料,C2H6的平衡转化率随反应温度的变化关系如图:
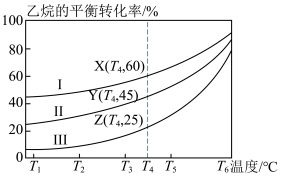
②图中Y点正反应速率和Z点逆反应速率的大小关系为v(Y)
③在T4℃,按n(C2H6):n(H2O)=1:9投料时,若达到平衡所需要的时间为20min,则乙烷分压平均变化速率为
您最近一年使用:0次
解题方法
10 . 含碳化合物的合成与转化具有重要的研究价值。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为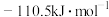 、
、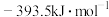 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为___________ 。
(2) 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示:
该反应的热化学反应方程式为___________ 。
(3)汽车尾气中的 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
(4) 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: 、
、 表示,则
表示,则
___________  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的v(逆)___________ z点对应的v(正)。
③若w点的时间为5min,则 的平均反应速率为
的平均反应速率为___________  。此温度下的化学平衡常数为
。此温度下的化学平衡常数为___________ 。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成
 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为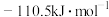 、
、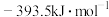 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为(2)
 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示: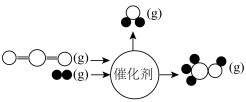
| 化学键 |
|
|
|
|
|
键能/( ) ) | 438 | 326 | 802 | 464 | 414 |
(3)汽车尾气中的
 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。A.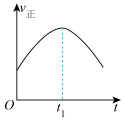 | B.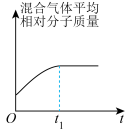 |
C.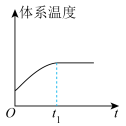 | D.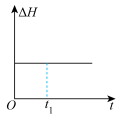 |
 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: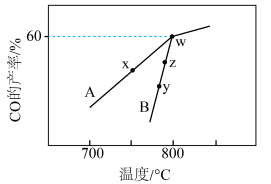
 、
、 表示,则
表示,则
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的v(逆)
③若w点的时间为5min,则
 的平均反应速率为
的平均反应速率为 。此温度下的化学平衡常数为
。此温度下的化学平衡常数为
您最近一年使用:0次