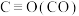名校
1 . 过硫酸钠(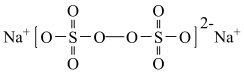 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
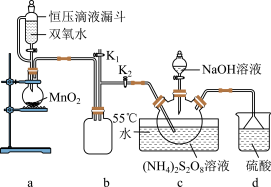
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。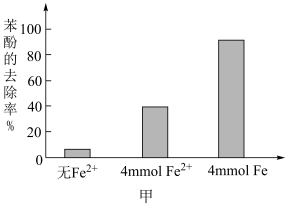
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为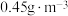 ,
, 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: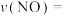
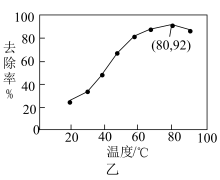
 。
。
您最近一年使用:0次
名校
2 . 化学兴趣小组同学用0.20
 、0.1
、0.1
 、0.2%淀粉溶液、0.50mol/L KI等试剂探究影响化学反应速率的因素。
、0.2%淀粉溶液、0.50mol/L KI等试剂探究影响化学反应速率的因素。
已知:
 (慢)
(慢)
 (快)
(快)
(1)向KI、 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的___________ (填化学式)耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色, 与
与 物质的量需满足的关系为
物质的量需满足的关系为
___________ (填“>”、“<”或“=”)2∶1.出现蓝色之前, 在反应中起到的作用是
在反应中起到的作用是___________ 。
(2)为探究反应物浓度对化学反应速率的影响,设计如下实验方案:
①表中的
___________ ,理由是___________ 。
②若实验①中观察到溶液变蓝的时间为10s,则用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率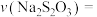
___________ mol/(L·s)。
(3)已知某条件下, 随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时
随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时 随反应时间(t)的变化曲线示意图(进行相应的标注)。
随反应时间(t)的变化曲线示意图(进行相应的标注)。___________

 、0.1
、0.1
 、0.2%淀粉溶液、0.50mol/L KI等试剂探究影响化学反应速率的因素。
、0.2%淀粉溶液、0.50mol/L KI等试剂探究影响化学反应速率的因素。已知:
 (慢)
(慢) (快)
(快)(1)向KI、
 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的 与
与 物质的量需满足的关系为
物质的量需满足的关系为
 在反应中起到的作用是
在反应中起到的作用是(2)为探究反应物浓度对化学反应速率的影响,设计如下实验方案:
| 实验序号 | 溶液体积/mL | ||||
 溶液 溶液 |  | KI溶液 |  溶液 溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 |  |  | 4.0 | 2.0 |
| ③ | 8.0 |  |  | 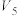 | 2.0 |

②若实验①中观察到溶液变蓝的时间为10s,则用
 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率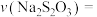
(3)已知某条件下,
 随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时
随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时 随反应时间(t)的变化曲线示意图(进行相应的标注)。
随反应时间(t)的变化曲线示意图(进行相应的标注)。
您最近一年使用:0次
名校
3 . 2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨CO2。该甲醇的制备反应及副反应如下:
ⅰ. (放热反应)
(放热反应)
ⅱ. (吸热反应)
(吸热反应)
(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
若CO2与足量H2发生反应转化为1molCO和水蒸气时吸收热量为42kJ,则
______ 。
(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:______ 。
②下列措施一定可以提高甲醇生成速率的是______ 。
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是______ 。
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。______ 极,B极的电极反应式为____________ 。
ⅰ.
 (放热反应)
(放热反应)ⅱ.
 (吸热反应)
(吸热反应)(1)键能是指断裂1mol化学键生成气态原子吸收的热量,几种化学键的键能如表所示。
化学键 | H-O | C=O(CO2) | H-H |
|
键能/ | 462.8 | 803.0 | 436.0 | x |

(2)在某温度下,向体积为1L的恒容密闭容器中充入3molH2和1molCO2,发生反应ⅰ,其中CO2(g)、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如下图所示:
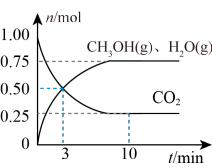
②下列措施一定可以提高甲醇生成速率的是
A.降低反应温度 B.缩小容器的容积
C.将产生的水蒸气及时移走 D.使用合适的催化剂
③下列选项能作为判断该反应达到平衡状态的依据的是
A.容器中CO2的体积分数不变
B.容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中混合气体的平均相对分子质量不变
E.单位时间内,断裂3molH-H键,同时生成2molH-O键
(3)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

您最近一年使用:0次
解题方法
4 . 研究氮氧化物 (NOₓ)的还原处理方法是环保领域的主要方向之一。回答下列问题:
 .用H2还原NO的反应为
.用H2还原NO的反应为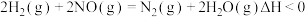

(1)该反应的正反应速率方程可表示为 ,某温度下,测得正反应速率v正与c(NO)或c(H
,某温度下,测得正反应速率v正与c(NO)或c(H )的变化关系如图1所示。
)的变化关系如图1所示。
___________ ,
___________ 。
(2)研究表明上述反应历程分两步基元反应:
i. ;
;
ii.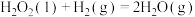 。
。
根据 (1)所给信息判断,H 还原 NO 总反应的速率由反应
还原 NO 总反应的速率由反应___________ (填“ i”或“ii” ) 决定。
(3)将一定量的H 和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H
和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H 的平衡转化率最大的是
的平衡转化率最大的是___________ 。
a. 恒温恒容 b.恒温恒压 c. 恒容绝热
 .脱除汽车尾气中 NO 和CO包括以下两个反应:
.脱除汽车尾气中 NO 和CO包括以下两个反应:
反应i. ;
;
反应ii. 。
。
反应过程中各物质相对能量如图 2 (TS表示过渡态): 的热化学方程式为
的热化学方程式为___________ 。
将恒定组成的NO和CO混合气体通入不同温度的反应器,相同时间内检测物质浓度,结果如图3。___________ (填“高温”或者“低温”)。
(6)实验过程中,高于340℃后N O浓度逐渐减小,试分析发生该变化的原因是
O浓度逐渐减小,试分析发生该变化的原因是___________ 。
(7)450℃时, 该时间段内NO的脱除率=___________ (保留2位有效数字, NO的脱除率
 .用H2还原NO的反应为
.用H2还原NO的反应为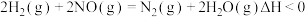

(1)该反应的正反应速率方程可表示为
 ,某温度下,测得正反应速率v正与c(NO)或c(H
,某温度下,测得正反应速率v正与c(NO)或c(H )的变化关系如图1所示。
)的变化关系如图1所示。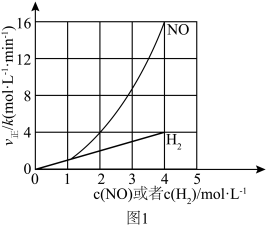


(2)研究表明上述反应历程分两步基元反应:
i.
 ;
;ii.
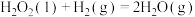 。
。根据 (1)所给信息判断,H
 还原 NO 总反应的速率由反应
还原 NO 总反应的速率由反应(3)将一定量的H
 和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H
和NO置于以下条件下发生反应(起始容器的体积、温度、压强均相同),到达平衡时,H 的平衡转化率最大的是
的平衡转化率最大的是a. 恒温恒容 b.恒温恒压 c. 恒容绝热
 .脱除汽车尾气中 NO 和CO包括以下两个反应:
.脱除汽车尾气中 NO 和CO包括以下两个反应:反应i.
 ;
;反应ii.
 。
。反应过程中各物质相对能量如图 2 (TS表示过渡态):
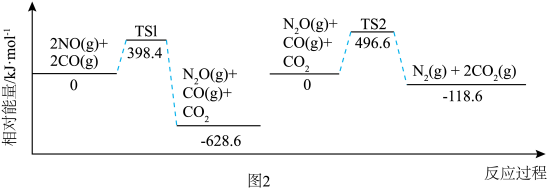
 的热化学方程式为
的热化学方程式为将恒定组成的NO和CO混合气体通入不同温度的反应器,相同时间内检测物质浓度,结果如图3。
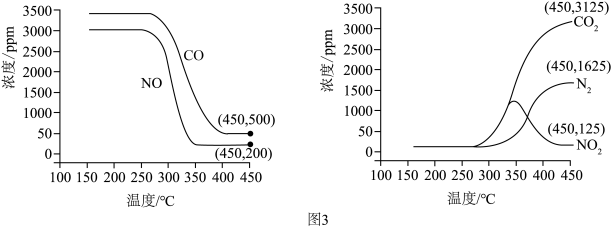
(6)实验过程中,高于340℃后N
 O浓度逐渐减小,试分析发生该变化的原因是
O浓度逐渐减小,试分析发生该变化的原因是(7)450℃时, 该时间段内NO的脱除率=

您最近一年使用:0次
解题方法
5 . 酯化反应可用通式表示为 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。
将 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:
二聚: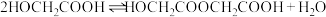
n聚: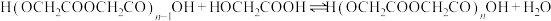
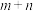 聚:
聚: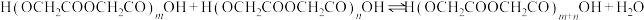 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。
Ⅰ.反应平衡体系分析
(1) 按系统命名法命名为
按系统命名法命名为______ 。
(2)定义反应程度 ,其中
,其中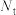 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,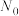 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则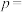
______ 。
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度 与平衡常数K的关系
与平衡常数K的关系
______ 。
(4)为了使平均聚合度增大,下列方法可行的是______ (填标号)。
A.及时移去 B.升高温度(
B.升高温度( )
)
C.提高 浓度 D.提高
浓度 D.提高 浓度
浓度
E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
(5)加入少量 催化与不加入
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为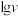 与
与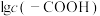 的关系]。
的关系]。
a、b两条曲线的理论斜率之比更接近______ 。 B.
B. C.
C.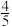 D.
D.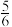
当温度升高时,b线斜率将______ (填“变大”、“变小”或“不变”)。
(6)加入少量 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
______ (用k、 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
 。在酸性条件下,
。在酸性条件下, ,
, 。假设整个过程中无环酯生成,不出现分层现象。
。假设整个过程中无环酯生成,不出现分层现象。将
 投入反应容器中,发生如下反应:
投入反应容器中,发生如下反应:二聚:
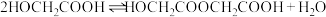
n聚:
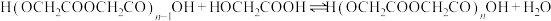
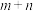 聚:
聚: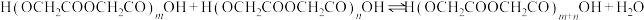 以上反应中每一步的速率常数近似认为相同,记平衡常数
以上反应中每一步的速率常数近似认为相同,记平衡常数 。
。Ⅰ.反应平衡体系分析
(1)
 按系统命名法命名为
按系统命名法命名为(2)定义反应程度
 ,其中
,其中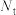 为时刻t时反应体系中-OH或者-COOH的数目,
为时刻t时反应体系中-OH或者-COOH的数目,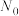 为初始反应体系中-OH或-COOH的数目。若
为初始反应体系中-OH或-COOH的数目。若 ,则
,则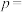
(3)最终产物中存在多种聚合度的缩聚产物,平均聚合度
 与平衡常数K的关系
与平衡常数K的关系
(4)为了使平均聚合度增大,下列方法可行的是
A.及时移去
 B.升高温度(
B.升高温度( )
)C.提高
 浓度 D.提高
浓度 D.提高 浓度
浓度E.先将单体预聚合成低聚物,然后将低聚物进一步聚合
Ⅱ.在实际生产过程中,通常会将反应生成的水及时移去。
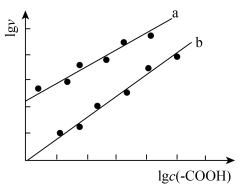
(5)加入少量
 催化与不加入
催化与不加入 催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为
催化两种情况下,初始阶段酯基的生成速率v与c(-COOH)的理论关系如图[图示为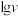 与
与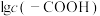 的关系]。
的关系]。a、b两条曲线的理论斜率之比更接近
 B.
B. C.
C.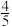 D.
D.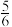
当温度升高时,b线斜率将
(6)加入少量
 催化时,实验测得反应过程中平均聚合度
催化时,实验测得反应过程中平均聚合度 与反应时间t的关系为:
与反应时间t的关系为: ,其中
,其中 为反应初始时
为反应初始时 浓度,k为常数。0~t时,酯基生成的平均速率
浓度,k为常数。0~t时,酯基生成的平均速率
 、t表示,忽略移去水对溶液体积的影响)。
、t表示,忽略移去水对溶液体积的影响)。
您最近一年使用:0次
名校
6 . Ⅰ.汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为两种无毒气体。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。___________ 逆反应速率(填“>”“<”或“=”)。
(2)该反应的化学方程式为___________ 。
(3)从反应开始到达到平衡,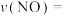
___________  ;该条件下,设起始压强为P,平衡时压强为
;该条件下,设起始压强为P,平衡时压强为 ,则
,则 的值为
的值为___________ 。
(4) 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则正极反应式为
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则正极反应式为___________ 。 ,反应过程中的能量变化如图所示。
,反应过程中的能量变化如图所示。___________ (填“放热”或“吸热”)反应,生成1mol  吸收或放出的热量为
吸收或放出的热量为___________ kJ(用a,b表示)。
(6)在恒容条件下进行该反应,下列叙述能说明反应达到平衡状态的是___________ (请用相应字母填空);
a.CO和 的浓度保持不变
的浓度保持不变
b.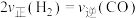
c.每生成1mol 的同时有2mol H-H键形成
的同时有2mol H-H键形成
d.容器内气体密度保持不变
e.容器内质量保持不变

(2)该反应的化学方程式为
(3)从反应开始到达到平衡,
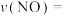
 ;该条件下,设起始压强为P,平衡时压强为
;该条件下,设起始压强为P,平衡时压强为 ,则
,则 的值为
的值为(4)
 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则正极反应式为
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则正极反应式为
 ,反应过程中的能量变化如图所示。
,反应过程中的能量变化如图所示。
 吸收或放出的热量为
吸收或放出的热量为(6)在恒容条件下进行该反应,下列叙述能说明反应达到平衡状态的是
a.CO和
 的浓度保持不变
的浓度保持不变b.

c.每生成1mol
 的同时有2mol H-H键形成
的同时有2mol H-H键形成d.容器内气体密度保持不变
e.容器内质量保持不变
您最近一年使用:0次
7 . 化学在生产生活中无处不在。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)汽车受到猛烈碰撞时,点火器点火引发 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是___________ (填字母),生成氮气的电子式为___________ 。 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。
(2)将2.0 mol 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ 。
(3)一定条件下,将1.0 mol 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应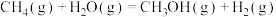 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是___________ (填字母)。
a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的 e.加入合适的催化剂
e.加入合适的催化剂
(4)用 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为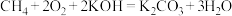 。
。 向B电极定向移动,则
向B电极定向移动,则___________ (填“A”或“B”)电极入口通甲烷,该电极反应的离子方程式为___________ 。
②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___________ 。
 .某汽车安全气囊的气体发生剂主要含有叠氮化钠(
.某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、三氧化二铁(
)、三氧化二铁( )、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
)、硝酸铵等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。(1)汽车受到猛烈碰撞时,点火器点火引发
 迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是
迅速分解,生成氮气和金属钠,同时释放大量的热。下列关于该反应过程中的能量变化示意图正确的是A.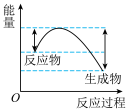 B.
B.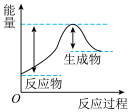 C.
C.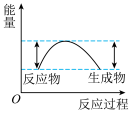
 .
. 、
、 (甲醇)既是重要的化工原料,又是重要的能源物质。
(甲醇)既是重要的化工原料,又是重要的能源物质。(2)将2.0 mol
 和4.0 mol
和4.0 mol  通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应
通入容积为4 L的反应器,保持容器容积不变,在一定温度下发生反应 ,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用
,测得在5 min时,CO的物质的量为0.8 mol,则0~5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为(3)一定条件下,将1.0 mol
 与2.0 mol
与2.0 mol  充入密闭容器中发生反应
充入密闭容器中发生反应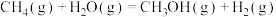 ,下列措施可以提高化学反应速率的是
,下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积 c.升高温度 d.保持恒容投入更多的
 e.加入合适的催化剂
e.加入合适的催化剂(4)用
 设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为
设计燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为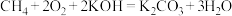 。
。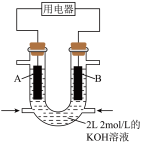
 向B电极定向移动,则
向B电极定向移动,则②当消耗甲烷的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
您最近一年使用:0次
名校
解题方法
8 . 控制变量法是化学实验的一种常用方法。
Ⅰ.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)判断锌和稀硫酸反应速率大小,最简单的方法可通过测定_______ 进行判断,在此5组实验中,其速率最快的是_______ (填实验序号)。
(2)实验1和2表明_______ 对反应速率有影响,实验1和3对比发现实验3反应速率明显较快,主要原因是_______ 。
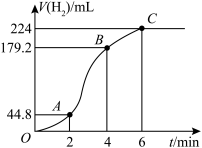
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。在OA、AB、BC三段中反应速率最快的是AB段,其原因是_______ 。_______ 。
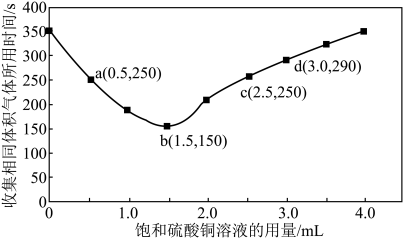
(5)b点对应的反应速率
_______  。
。
(6)通过以上分析可知选择加入下列哪些试剂可以与加入硫酸铜有相似的效果_______
Ⅰ.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
| 序号 | 锌的质量/g | 锌的形式 |  |  | 反应前溶液的温度/℃ | 其他试剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴 溶液 溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴 溶液 溶液 |
(1)判断锌和稀硫酸反应速率大小,最简单的方法可通过测定
(2)实验1和2表明
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。在OA、AB、BC三段中反应速率最快的是AB段,其原因是
(5)b点对应的反应速率

 。
。(6)通过以上分析可知选择加入下列哪些试剂可以与加入硫酸铜有相似的效果_______
A. 溶液 溶液 | B. 溶液 溶液 | C.稀 | D. 溶液 溶液 |
您最近一年使用:0次
名校
9 . 2020年9月22日,国家主席习近平在第75届联合国大会上宣布:中国二氧化碳排放力争2030年前达到峰值,2060年前实现“碳中和”。为达成这一目标,要尽量减少不可避免的碳排放。
(1)工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和 ),其反应的化学方程式为
),其反应的化学方程式为 ,该反应的能量变化图像如图所示。
,该反应的能量变化图像如图所示。_______ 。
A.铝粉与氧化铁的反应
B.氯化铵与 的反应
的反应
C.锌片与稀硫酸的反应
D.钠与冷水的反应
②一定温度下,在2L的恒容密闭容器中,加入0.02molC(s)和0.01mol 发生反应:
发生反应: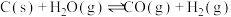 ,充分反应5min时,测得容器中CO的物质的量有0.008mol。以
,充分反应5min时,测得容器中CO的物质的量有0.008mol。以 表示的化学反应速率
表示的化学反应速率 为
为_______ 。
③我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:
 反应放热。在低温下获得高产率。反应过程示意图如下图:
反应放热。在低温下获得高产率。反应过程示意图如下图:_______ 。
A.据图可知起始时的2个 分子最终都参与了反应
分子最终都参与了反应
B.过程Ⅰ、过程Ⅱ均为吸热过程,
C.过程Ⅲ只生成了极性共价键
D.使用催化剂缩小反应物和生成物的能量差
(2)以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示:
反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示: 完全分解生成CO(g)和
完全分解生成CO(g)和 需要
需要_______ (填“吸收”或“放出”)_______ kJ的能量。
(3) 分解产生的CO和
分解产生的CO和 可以作为
可以作为 燃料电池的原料。下图为
燃料电池的原料。下图为 燃料电池的构造示意图,根据电子运动方向,可知氧气从
燃料电池的构造示意图,根据电子运动方向,可知氧气从_______ 口通入(填“a”或“b”);X极为电池的_______ (填“正”或“负”)极,电极反应为_______ , 向
向_______ 极移动(填“X”或“Y”);若两极共消耗气体3.36L(标准状况下),则通过导线的电子数为_______ 。
(1)工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和
 ),其反应的化学方程式为
),其反应的化学方程式为 ,该反应的能量变化图像如图所示。
,该反应的能量变化图像如图所示。
A.铝粉与氧化铁的反应
B.氯化铵与
 的反应
的反应C.锌片与稀硫酸的反应
D.钠与冷水的反应
②一定温度下,在2L的恒容密闭容器中,加入0.02molC(s)和0.01mol
 发生反应:
发生反应: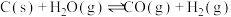 ,充分反应5min时,测得容器中CO的物质的量有0.008mol。以
,充分反应5min时,测得容器中CO的物质的量有0.008mol。以 表示的化学反应速率
表示的化学反应速率 为
为③我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:
 反应放热。在低温下获得高产率。反应过程示意图如下图:
反应放热。在低温下获得高产率。反应过程示意图如下图:
A.据图可知起始时的2个
 分子最终都参与了反应
分子最终都参与了反应B.过程Ⅰ、过程Ⅱ均为吸热过程,
C.过程Ⅲ只生成了极性共价键
D.使用催化剂缩小反应物和生成物的能量差
(2)以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示:
反应为减少“碳排放”提供了一个新途径,该反应各分子化学键完全断裂时的能量变化如图所示:
 完全分解生成CO(g)和
完全分解生成CO(g)和 需要
需要(3)
 分解产生的CO和
分解产生的CO和 可以作为
可以作为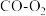 燃料电池的原料。下图为
燃料电池的原料。下图为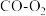 燃料电池的构造示意图,根据电子运动方向,可知氧气从
燃料电池的构造示意图,根据电子运动方向,可知氧气从 向
向
您最近一年使用:0次
名校
解题方法
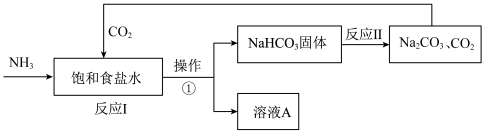
10 . 侯氏制碱法是我国化学工程专家侯德榜将氨碱法和合成氨法两种工艺联合起来生产纯碱的方法。主要过程如图所示(部分物质已略去):
(1)纯碱的化学式为___________ (填“ ”或“
”或“ ”);
”);
(2)操作①的名称是___________ (填“蒸发”或“过滤”);
(3)上述实验过程中可以循环使用的物质是___________ (填化学式);
(4)工业上可以用氨生产尿素,其方程式为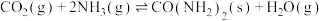 ,一定温度下,将1 mol
,一定温度下,将1 mol  和2 mol
和2 mol  充入体积为1L的密闭容器中,5 min后测得
充入体积为1L的密闭容器中,5 min后测得 的物质的量为0.6 mol,则:
的物质的量为0.6 mol,则:
①对上述反应,若适当升高温度,化学反应速率会___________ (填“增大”或“减小”);
②用 的浓度变化表示该反应的平均速率为
的浓度变化表示该反应的平均速率为___________ mol/(L·min)。
(1)纯碱的化学式为
 ”或“
”或“ ”);
”);(2)操作①的名称是
(3)上述实验过程中可以循环使用的物质是
(4)工业上可以用氨生产尿素,其方程式为
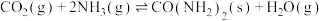 ,一定温度下,将1 mol
,一定温度下,将1 mol  和2 mol
和2 mol  充入体积为1L的密闭容器中,5 min后测得
充入体积为1L的密闭容器中,5 min后测得 的物质的量为0.6 mol,则:
的物质的量为0.6 mol,则:①对上述反应,若适当升高温度,化学反应速率会
②用
 的浓度变化表示该反应的平均速率为
的浓度变化表示该反应的平均速率为
您最近一年使用:0次
7日内更新
|
161次组卷
|
2卷引用:湖南省岳阳市平江县第三中学等多校联考2023年高一普通高中学业水平合格性考试仿真模拟(专家卷一)化学试题