名校
解题方法
1 . 下列实验结果不能作为相应定律或原理的证据之一的是
| A | B | C | D | |
| 定律或原理 | 勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 |
| 实验方案 |  | 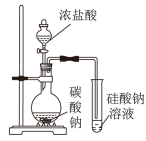 | 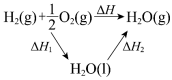 | 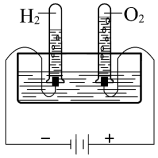 电解水 |
| 结果 | ①、②试管内溶液颜色均变深 | 烧瓶中冒气泡,试管中出现浑浊 | 测得∆H为∆H1和∆H2的和 | H2与O2的体积比约为2:1 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-02更新
|
440次组卷
|
4卷引用:江西省宜春市宜丰中学2022-2023学年高三上学期1月期末考试化学试题
名校
2 . K2Cr2O7溶液中存在平衡: 。用K2Cr2O7溶液进行下列实验。下列说法错误的是
。用K2Cr2O7溶液进行下列实验。下列说法错误的是

 。用K2Cr2O7溶液进行下列实验。下列说法错误的是
。用K2Cr2O7溶液进行下列实验。下列说法错误的是
A.①中 和 和 浓度相等说明反应达平衡 浓度相等说明反应达平衡 |
| B.①中溶液橙色加深,③中溶液变黄 |
C.②中 被C2H5OH还原为Cr3+ 被C2H5OH还原为Cr3+ |
| D.若向④中加入70%H2SO4溶液至过量,溶液变为绿色 |
您最近一年使用:0次
2021-06-11更新
|
308次组卷
|
4卷引用:江西省吉安市第一中学2021-2022学年度高二上学期开学考试化学试题
江西省吉安市第一中学2021-2022学年度高二上学期开学考试化学试题天津市北辰区2021届高三一模考试化学试题(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)07-2023新东方高二上期中考化学
名校
解题方法
3 . 有机物 可由甲和乙在一定条件下制得:
可由甲和乙在一定条件下制得:
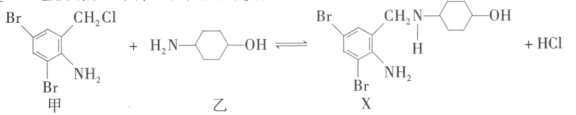
下列有关叙述正确的是
 可由甲和乙在一定条件下制得:
可由甲和乙在一定条件下制得:
下列有关叙述正确的是
A.甲的分子式为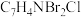 |
B. 中最多有13个碳原子共平面 中最多有13个碳原子共平面 |
C.乙遇 溶液发生显色反应 溶液发生显色反应 |
D.反应过程中加入适量 可提高 可提高 的产率 的产率 |
您最近一年使用:0次
2021-06-09更新
|
246次组卷
|
4卷引用:【全国百强校】江西省临川市第一中学2018-2019学年高二下学期第二次月考化学试题
4 . 为探讨化学平衡移动原理与氧化还原反应规律的联系,小睿同学通过改变浓度研究:“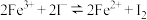 ”反应中Fe3+和Fe2+的相互转化。实验如下:
”反应中Fe3+和Fe2+的相互转化。实验如下:
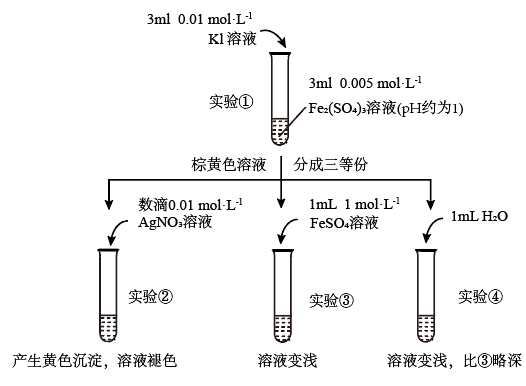
(1)待实验①溶液颜色不再改变时,再进行实验②③④,目的是使实验①的反应达到_______ 。
(2)实验④是实验③的_______ 试验,目的是_______ 。
(3)实验②的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。根据氧化还原反应的规律,该同学推测实验②中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致 的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
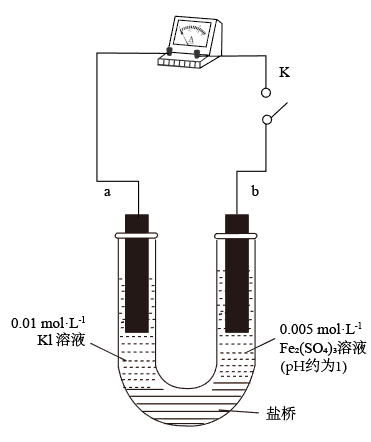
①K闭合时,指针向右偏转,b作_______ 极。
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是_______ 。
(4)按照(3)的原理,该同学用上图装置再进行实验,证实了实验③中Fe2+向Fe3+转化的原因。
①转化原因是_______ 。
②与(3)实验对比,不同的操作是_______ 。
(5)实验①中,还原性:I->Fe2+,而实验②③中,还原性:Fe2+>I-,将(3)和(4)作对比,得出的结论是_______ 。
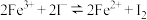 ”反应中Fe3+和Fe2+的相互转化。实验如下:
”反应中Fe3+和Fe2+的相互转化。实验如下:
(1)待实验①溶液颜色不再改变时,再进行实验②③④,目的是使实验①的反应达到
(2)实验④是实验③的
(3)实验②的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。根据氧化还原反应的规律,该同学推测实验②中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致
 的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是
(4)按照(3)的原理,该同学用上图装置再进行实验,证实了实验③中Fe2+向Fe3+转化的原因。
①转化原因是
②与(3)实验对比,不同的操作是
(5)实验①中,还原性:I->Fe2+,而实验②③中,还原性:Fe2+>I-,将(3)和(4)作对比,得出的结论是
您最近一年使用:0次
2021-04-26更新
|
289次组卷
|
3卷引用:江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期9月联考化学试题
江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期9月联考化学试题江苏省昆山市2020-2021学年高二下学期期中教学质量调研化学试题(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)
5 . 下列过程可以用勒夏特列原理解释的是
| A.H2、I2(g)、HI组成的平衡体系加压后颜色变深 |
| B.SO2与О2通过接触氧化制SO3需要高温条件 |
| C.合成氨工业中使用高压以提高氨的产量 |
| D.将煤块粉碎后燃烧,往往能提高燃烧效率 |
您最近一年使用:0次
2021-03-25更新
|
130次组卷
|
2卷引用:江西省峡江中学2021-2022学年高二上学期第一次月考化学(理科)试题
6 . 对于反应:  (g)+ I2(g)
(g)+ I2(g) 
 (g)+2HI(g) △H>0.达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有
(g)+2HI(g) △H>0.达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有
 (g)+ I2(g)
(g)+ I2(g) 
 (g)+2HI(g) △H>0.达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有
(g)+2HI(g) △H>0.达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有| A.恒压条件下通入惰性气体 | B.降低温度 |
| C.增大环戊烯浓度 | D.将容器体积减小到原来的一半 |
您最近一年使用:0次
名校
7 . 为减少碳的排放,科学家提出利用CO2和H2反应合成甲醇,其反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下列有关说法不正确的是
CH3OH(g)+H2O(g)。下列有关说法不正确的是
 CH3OH(g)+H2O(g)。下列有关说法不正确的是
CH3OH(g)+H2O(g)。下列有关说法不正确的是| A.恒温恒容下,该反应达到平衡时,各物质的物质的量分别为1mol、3mol、1mol和1mol,若此时各物质的物质的量分别增加1mol,平衡正向移动。 |
| B.恒温恒压下,该反应达到平衡时,各物质的物质的量分别为1mol、1mol、1mol和1mol,若此时通入12molCO2,平衡正向移动 |
| C.恒温恒容下,先向容器中加入1molCO2,再慢慢通入H2,发生反应,CH3OH的平衡物质的量逐渐增加 |
| D.恒温恒容下,先向容器中加入1molCO2,再慢慢通入H2,发生反应,CH3OH的平衡体积分数先增大后减小 |
您最近一年使用:0次
2021-02-08更新
|
244次组卷
|
2卷引用:江西省永丰县永丰中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
8 . 在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
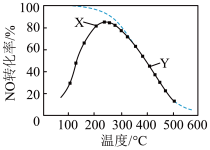

A.反应2NO(g)+O2(g) 2NO2(g)的∆H 2NO2(g)的∆H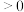 |
| B.图中X点所示条件下,延长反应时间能提高NO转化率 |
| C.图中Y点所示条件下,增加O2的起始浓度不能提高NO转化率 |
| D.380℃下,C起始(O2)=5.0×10−4 mol·L−1,NO平衡转化率为50%,则平衡常数K=4000 |
您最近一年使用:0次
2021-02-08更新
|
334次组卷
|
2卷引用:江西省永丰县永丰中学2020-2021学年高二上学期期中考试化学试题
名校
9 . 海水中因含有 和
和 等离子,其pH稳定在7.9~8.4.下列说法错误的是
等离子,其pH稳定在7.9~8.4.下列说法错误的是
 和
和 等离子,其pH稳定在7.9~8.4.下列说法错误的是
等离子,其pH稳定在7.9~8.4.下列说法错误的是| A.海水的弱碱性有利于珊瑚虫利用碳酸钙形成外壳 |
| B.夏天,海水的pH会减小 |
| C.人口增长、燃烧煤、大规模砍伐森林等因素,会造成海水的酸化 |
| D.弱碱性的海水,可用作烟道气中SO2的吸收剂 |
您最近一年使用:0次
2021-02-05更新
|
264次组卷
|
3卷引用:江西省宜春市丰城中学2023-2024学年高二下学期3月月考化学试题
解题方法
10 . 室温下,向圆底烧瓶中加入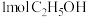 和含
和含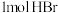 的氢溴酸,溶液中发生反应:
的氢溴酸,溶液中发生反应: ,充分反应后达到平衡。已知常压下,
,充分反应后达到平衡。已知常压下,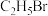 和
和 的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
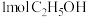 和含
和含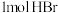 的氢溴酸,溶液中发生反应:
的氢溴酸,溶液中发生反应: ,充分反应后达到平衡。已知常压下,
,充分反应后达到平衡。已知常压下,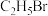 和
和 的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是A.增大 浓度,有利于生成 浓度,有利于生成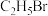 |
B.若反应物均增大至 ,则两种反应物平衡转化率之比不变 ,则两种反应物平衡转化率之比不变 |
| C.为缩短反应达到平衡的时间,将起始温度提高至50℃ |
D.加入 ,可增大乙醇的物质的量 ,可增大乙醇的物质的量 |
您最近一年使用:0次
2021-02-02更新
|
301次组卷
|
3卷引用:江西省赣州市2021届高三上学期期末考试化学试题
江西省赣州市2021届高三上学期期末考试化学试题安徽省涡阳县育萃高级中学2020-2021学年高二下学期第一次月考化学试题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)



