名校
解题方法
1 . 废催化剂(含 、
、 、
、 等成分)提取钛、钒工艺流程如下图所示。
等成分)提取钛、钒工艺流程如下图所示。
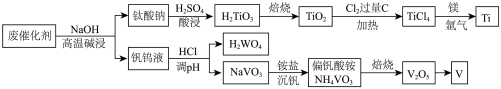
已知:①钛酸钠 难溶于水;
难溶于水;
②溶液的酸性较强时, 价钒主要以
价钒主要以 的形式存在;
的形式存在;
回答下列问题:
(1)Ti的价电子排布式_______ 。
(2)上述流程中,发生的氧化还原反应有_______ 个。
(3)“高温碱浸”中生成钛酸钠的离子方程式是_______ 。
(4)下列金属冶炼方法与上述流程中加入 冶炼
冶炼 的方法相似的是_______。
的方法相似的是_______。
(5)“沉钒”过程中,一般要加入过量 ,其原因是
,其原因是_______ 。
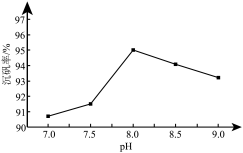
(6)沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后降低的原因可能是_______ 。
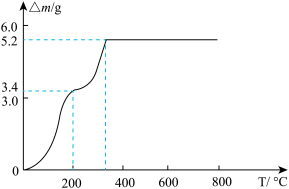
(7)取 固体加热时,固体减少的质量
固体加热时,固体减少的质量 随温度的变化曲线如图所示。加热到200℃时,产生气体的分子式为
随温度的变化曲线如图所示。加热到200℃时,产生气体的分子式为_______ 。
 、
、 、
、 等成分)提取钛、钒工艺流程如下图所示。
等成分)提取钛、钒工艺流程如下图所示。
已知:①钛酸钠
 难溶于水;
难溶于水;②溶液的酸性较强时,
 价钒主要以
价钒主要以 的形式存在;
的形式存在;回答下列问题:
(1)Ti的价电子排布式
(2)上述流程中,发生的氧化还原反应有
(3)“高温碱浸”中生成钛酸钠的离子方程式是
(4)下列金属冶炼方法与上述流程中加入
 冶炼
冶炼 的方法相似的是_______。
的方法相似的是_______。| A.高炉炼铁 | B.电解熔融氧化铝制铝 | C.铝热反应制钒 | D.氧化汞分解制汞 |
 ,其原因是
,其原因是(6)沉钒过程中,沉钒率随溶液pH的变化如图所示。沉钒率随溶液pH的增加先升高后降低的原因可能是

(7)取
 固体加热时,固体减少的质量
固体加热时,固体减少的质量 随温度的变化曲线如图所示。加热到200℃时,产生气体的分子式为
随温度的变化曲线如图所示。加热到200℃时,产生气体的分子式为
您最近一年使用:0次
名校
2 . 当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
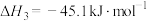
(1)根据盖斯定律,反应Ⅰ的
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
_______ eV。并写出该历程的化学方程式_______ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
(4)加压,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。_______ (填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的
_______ (列出计算式)。( 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:

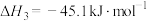
(1)根据盖斯定律,反应Ⅰ的

(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。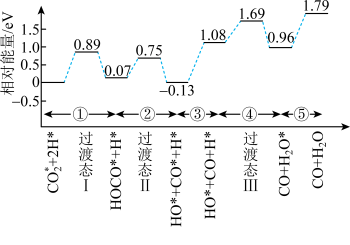

(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
| A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动 |
| B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热 |
C.增大 的浓度,有利于提高 的浓度,有利于提高 的平衡转化率 的平衡转化率 |
D.及时分离出 ,可以使得反应Ⅰ的正反应速率增大 ,可以使得反应Ⅰ的正反应速率增大 |
(4)加压,甲醇产率将
(5)加入新催化剂使1mol
 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。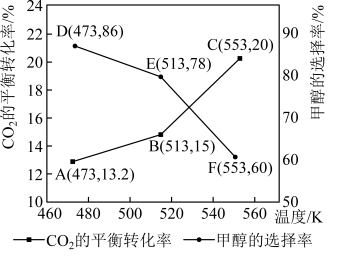
②553K时,若反应后体系的总压为p,反应Ⅰ的

 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
您最近一年使用:0次
2023-09-30更新
|
254次组卷
|
5卷引用:湖南省平江县颐华高级中学2023-2024学年高三下学期入学考试化学试题
名校
3 . 下列说法不能用勒夏特列原理解释的是
A.氯水中有平衡:Cl2+H2O HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深 CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
| C.配制Fe2(SO4)3溶液时,需要加入少量稀硫酸 |
| D.高压比常压条件更有利于合成氨的反应 |
您最近一年使用:0次
2023-09-17更新
|
82次组卷
|
2卷引用:湖南省永州市第一中学2023-2024学年高二上学期9月月考化学试题
名校
4 . 已知: 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: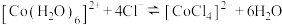 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:

以下结论和解释正确的是
 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: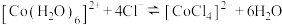 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
| A.由实验①可推知正反应为放热反应 |
B.等物质的量的 和 和 中 中 键数目之比为3∶2 键数目之比为3∶2 |
C.实验②是由于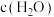 增大,导致平衡逆向移动 增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: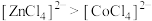 |
您最近一年使用:0次
名校
解题方法
5 . 下列有关实验现象和解释或结论都正确的组合是
| 选项 | 实验操作 | 现象 | 解释或结论 |
A | 相同条件下,分别测量0.1molL1和0.01molL1醋酸溶液的导电性 | 前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 向FeCl3和KSCN的混合溶液中加入KCl固体 | 血红色溶液变浅 | 增大KCl的浓度,使得平衡逆向移动 |
C | 两支试管各盛4mL0.1mol/L酸性高锰酸钾溶液,分别加入2mL0.1mol/L草酸溶液和2mL0.2mol/L草酸溶液 | 加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液褪色更快 | 反应物浓度越大,反应速率越快 |
D | 把充有NO2和N2O4的平衡球装置分别放入热水和冷水中 | 热水中颜色更深 | 其他条件不变时,温度升高,平衡向吸热反应方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-04更新
|
592次组卷
|
4卷引用:湖南师范大学附属中学2023-2024学年高二上学期入学考试化学试题
名校
6 . 下列平衡移动方向和现象判断正确的是
A. +H2O +H2O 2 2 +2H+,加水增大了水的浓度,平衡正向移动 +2H+,加水增大了水的浓度,平衡正向移动 |
B.2NO2(g) N2O4(g),压缩容器体积,平衡正向移动,气体颜色变浅 N2O4(g),压缩容器体积,平衡正向移动,气体颜色变浅 |
C.2HI(g) H2(g)+I2(g),压缩容器体积,平衡不移动,气体颜色无变化 H2(g)+I2(g),压缩容器体积,平衡不移动,气体颜色无变化 |
D.[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O ΔH>0,升高温度,溶液由蓝绿色变为黄绿色 [CuCl4]2-+4H2O ΔH>0,升高温度,溶液由蓝绿色变为黄绿色 |
您最近一年使用:0次
2023-08-31更新
|
358次组卷
|
3卷引用:湖南省长沙市实验中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
7 . 空气中的氮气可通过人工固氮获得氨气,氨气是重要的化工原料,通过氨氧化法可制得硝酸,反应过程如下图:

硝酸是一种强氧化性酸,制硝酸工业产生的尾气中含有氮氧化物(NOx),应处理后才能排放下列说法正确的是

硝酸是一种强氧化性酸,制硝酸工业产生的尾气中含有氮氧化物(NOx),应处理后才能排放下列说法正确的是
A.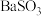 固体能溶于稀硝酸,生成 固体能溶于稀硝酸,生成 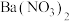 ,同时放出 ,同时放出  气体 气体 |
B.工业上,当转化①的反应达到平衡时,需不断地从混合气体中分离出  ,将未反应的原料气送回合成塔以提高原料的利用率 ,将未反应的原料气送回合成塔以提高原料的利用率 |
C.工业尾气中NOx常用碱液吸收处理,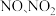 的混合气体能被足量烧碱溶液完全吸收的条件是 n(NO)≥n(NO2) 的混合气体能被足量烧碱溶液完全吸收的条件是 n(NO)≥n(NO2) |
D.向浓硝酸溶液中插入红热的炭,产生红棕色气体,则可证明炭与浓硝酸溶液反应一定生成  |
您最近一年使用:0次
名校
8 . 一定条件下的恒容密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下图表示反应过程中能量 的变化。下列说法不正确的是
2NH3(g),下图表示反应过程中能量 的变化。下列说法不正确的是

 2NH3(g),下图表示反应过程中能量 的变化。下列说法不正确的是
2NH3(g),下图表示反应过程中能量 的变化。下列说法不正确的是
| A.加入催化剂不改变该反应的反应热 |
| B.b 曲线是加入催化剂时的能量变化曲线 |
| C.在常温、体积一定的条件下,通入 1 mol N2和 3 mol H2反应后放出的热量为 92 kJ |
| D.温度降低,平衡正向移动,N2转化率增大 |
您最近一年使用:0次
2023-08-19更新
|
204次组卷
|
3卷引用:湖南省张家界市慈利县第一中学2023-2024学年高二上学期第二次月考化学试题
名校
9 . 铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。

回答下列问题:
(1)已知 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是___________ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式___________ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是___________ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为___________ (填写离子符号),并且防止在碱性条件下___________ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:___________ 。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
您最近一年使用:0次
名校
10 . 一定条件下,0.3mol 和0.9mol
和0.9mol 在体积为1L的密闭容器中发生反应:
在体积为1L的密闭容器中发生反应:
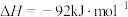 ,反应进行2min,
,反应进行2min, 的物质的量增加了0.4mol。
的物质的量增加了0.4mol。
下列说法正确的是
 和0.9mol
和0.9mol 在体积为1L的密闭容器中发生反应:
在体积为1L的密闭容器中发生反应:
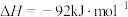 ,反应进行2min,
,反应进行2min, 的物质的量增加了0.4mol。
的物质的量增加了0.4mol。下列说法正确的是
A.平衡后再充入 ,既能加快反应速率又能提高 ,既能加快反应速率又能提高 的平衡转化率 的平衡转化率 |
| B.将容器的体积压缩,可增大单位体积活化分子数,增大活化分子的百分数,加快反应速率 |
| C.反应进行2min,放出的热量值小于18.4kJ |
D. 的体积分数保持不变,能说明反应达到平衡 的体积分数保持不变,能说明反应达到平衡 |
您最近一年使用:0次
2023-08-05更新
|
369次组卷
|
3卷引用:湖南省邵阳市2022-2023学年高二上学期12月月考化学试题



