名校
解题方法
1 . 重铬酸铵[(NH4)2Cr2O7]用作分析试剂、催化剂及媒染剂等。某化学兴趣小组对重铬酸铵的一些性质及组成进行探究。已知: (橙色)
(橙色)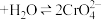 (黄色)
(黄色)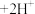 。回答下列问题:
。回答下列问题:
(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol/LNaOH溶液,振荡、微热。产生的现象是_______ ,写出该反应的化学方程式:_______ 。
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.520 g重铬酸铵样品进行实验。
①实验过程中通入N2的主要目的是_______ 。
②加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A、B中质量变化分别为1.00 g、0.720 g,则重铬酸铵受热分解的化学方程式为_______ 。
(3)实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++ +H2O=2BaCrO4↓+2H+,4
+H2O=2BaCrO4↓+2H+,4 +6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
+6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
实验步骤:称取样品2.600 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使 完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
①碱式滳定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数_______ (填“偏大”“偏小”或“无影响”);滴定时边滴边摇动锥形㼛,眼睛应观察_______ 。
②滳定结果如下表所示:
该样品中氮的质量分数为_______ (结果保留两位小数)。
 (橙色)
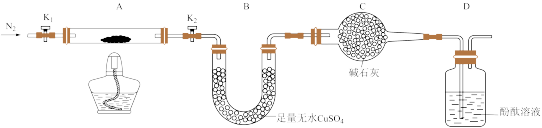
(橙色)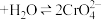 (黄色)
(黄色)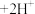 。回答下列问题:
。回答下列问题:(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol/LNaOH溶液,振荡、微热。产生的现象是
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.520 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是
②加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A、B中质量变化分别为1.00 g、0.720 g,则重铬酸铵受热分解的化学方程式为
(3)实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++
 +H2O=2BaCrO4↓+2H+,4
+H2O=2BaCrO4↓+2H+,4 +6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)
+6HCHO=3H++6H2O+(CH2)6N4H+,滴定时1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。(不考虑甲醛与硝酸的反应)实验步骤:称取样品2.600 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使
 完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。
完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol/LNaOH标准溶液滴定至终点,重复上述操作3次。①碱式滳定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数
②滳定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.06 |
| 2 | 25.00 | 1.98 | 21.97 |
| 3 | 25.00 | 0.20 | 21.20 |
| 4 | 25.00 | 0.45 | 20.45 |
您最近一年使用:0次
2022-11-02更新
|
233次组卷
|
2卷引用:湖南省长沙市长郡中学2022-2023学年高二上学期期中考试化学试题
2 . 对已经达到化学平衡的反应: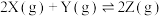 ,减小压强时,对反应产生的影响是
,减小压强时,对反应产生的影响是
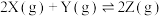 ,减小压强时,对反应产生的影响是
,减小压强时,对反应产生的影响是| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
您最近一年使用:0次
2022-11-02更新
|
736次组卷
|
97卷引用:2016-2017学年湖南省浏阳市第一中学高二上阶段性测试化学试卷
2016-2017学年湖南省浏阳市第一中学高二上阶段性测试化学试卷湖南省永州市东安县第一中学2019-2020学年高二上学期第一次月考化学试题湖南省邵阳市洞口县第四中学2019-2020学年高二上学期期中考试化学试题湖南省长沙宁乡市第十高级中学2020-2021学年高二上学期10月月考化学试题(已下线)2010—2011学年浙江省杭州学军中学高二下学期期中考试化学试卷(已下线)2010—2011学年内蒙古赤峰二中高一下学期期末考试化学试卷(已下线)2011-2012学年山东省鲁北中学高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市邹城二中高二上学期期中质量检测化学试卷(已下线)2011-2012学年云南省玉溪一中高二下学期期中考试化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2012-2013学年江苏省南京三中高二下学期期中考试化学试卷(已下线)2012-2013学年黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2013-2014学年河南省漯河市高二上学期期中考试化学试卷(已下线)2014-2015学年河南周口市沈丘县县直高级中学高二上第一次月考化学(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2014秋安徽省淮北师范大学附属实验中学高二上学期期中化学试卷2015-2016学年陕西省西安第七十中学高二上学期期中测试化学试卷2015-2016学年宁夏育才中学高二上学期期中测试化学试卷2015-2016学年青海西宁第十四中学高二上期中考试化学卷2015-2016学年陕西省澄城县寺前中学高一下学期期中考试化学试卷(已下线)同步君 人教版 选修4 第2章 第3节 化学平衡状态2016-2017学年湖北省襄阳五中高二上开学考试化学试卷2016-2017学年河北省博野中学高二上学期第二次月考化学试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷2016-2017学年贵州省贵阳六中高二上10月月考化学卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷2016-2017学年甘肃省民乐一中高二上10月月考化学试卷2016-2017学年山东省桓台二中高二12月检测化学试卷辽宁省辽源市金鼎高级中学2016-2017学年高二上学期期末考试化学试卷甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题山东省济南第一中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第二课时(化学平衡状态)【全国省级联考】广东省蓝精灵中学2017-2018 学年度高二上学期期末联考化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高二上学期第一次月考化学试题甘肃省岷县一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期中考试化学试题【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题甘肃省宁县二中2018-2019学年高二上学期期中考试化学试题四川省宜宾市第四中学2018-2019学年高二上学期期中考试理科综合化学试题高二人教版选修4 第二章 第三节 化学平衡河北省承德市第一中学2018-2019学年高二上学期第三次月考化学试题甘肃省镇原县孟坝中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区沙雅县第二中学2018-2019学年高二上学期期中考试化学试题河南省永城市实验高级中学2018-2019学年高二上学期期中考试化学试题辽宁省大连渤海高级中学2018-2019学年高二下学期期中考试化学试题上海市华东师范大学附属天山学校2018-2019学年高一第二学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二10月月考化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题甘肃省张掖市山丹县第一中学2019-2020学年上学期9月月考--高二化学江西省宜春九中(外国语学校)2019-2020学年高二上学期期中考试化学试题吉林省蛟河市朝鲜族中学校2019-2020学年高二上学期期中考试化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题新疆沙雅县第二中学2019-2020学年高二上学期期中考试化学试题贵州省毕节市实验高级中学2018-2019学年高二上学期期末考试化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二上学期期末考试化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题黑龙江桦南二中2019-2020学年高二上学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题陕西省延安市吴起高级中学2019-2020学年高一下学期第四次质量检测(期末)化学试题黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题海南省海口市第四中学2020-2021学年高二上学期第一次月考化学试题吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试题河北省张家口宣化一中2020-2021学年高二上学期12月月考化学试题黑龙江漠河市高级中学2020-2021学年高二上学期期末考试化学试题湖北省十堰市2020-2021学年高二上学期期末考试化学试题广东省惠州市2020-2021学年高二上学期期末考试化学试题福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题广东省惠州市2020-2021学年高二上学期期末质量监测化学试题吉林长春市榆树高级中学2019-2020学年高二下学期期末考试化学试题河南省开封市五县2020-2021学年高二上学期期末考试化学试题选择性必修1(SJ)专题2第三单元 化学平衡的移动山东省山大附中卧龙学校2021-2022学年高二上学期第一次月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期期中考试化学(理)试题四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题广东省揭阳市惠来县第一中学2021-2022学年高二上学期第二次阶段考试化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二上学期期中考试化学试题内蒙古乌兰察布市部分学校2021-2022学年高二上学期期中联考化学试题青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省随州市洛平许济四市联盟2022-2023学年高三上学期第一次质量检测化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题河南省灵宝市第五高级中学2021-2022学年高二下学期第一次月考化学试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(B卷)试题福建省南安市柳城中学2021-2022学年高二上学期期中考试化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题广东省阳江市高新区2022-2023学年高二上学期1月期末考试化学试题作业(十二) 压强对化学平衡的影响 勒·夏特列原理
名校
解题方法
3 . 乙烯水合法是工业制乙醇的方法: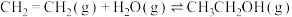 ,该反应在密闭容器中进行,下列说法错误的是
,该反应在密闭容器中进行,下列说法错误的是
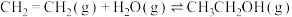 ,该反应在密闭容器中进行,下列说法错误的是
,该反应在密闭容器中进行,下列说法错误的是A.恒温恒容,充入 , ,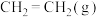 的转化率增大 的转化率增大 |
B.若升高温度,平衡常数减小,则该反应 |
| C.压缩容积,活化分子百分数增大,反应速率加快 |
D.恒温恒压,通入 ,平衡向左移动 ,平衡向左移动 |
您最近一年使用:0次
2022-10-29更新
|
571次组卷
|
7卷引用:湖南省衡阳市第一中学2023届高三下学期5月月考化学试题
湖南省衡阳市第一中学2023届高三下学期5月月考化学试题四川省雅安市2023届高三上学期零诊考试化学试题(已下线)专题13 化学反应速率和化学平衡(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2019年高考海南卷化学试题变式题(单选题)(已下线)选择题11-15辽宁省锦州市渤海大学附属高级中学2023-2024学年高三上学期第三次考试化学试题
4 . 废旧锡铬合金主要含Sn、Cr、SnO、Cr2O3,还有少量的Pb。采用如图工艺流程回收锡并制备K2Cr2O7。
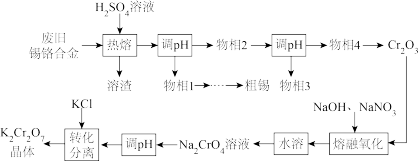
已知:“熔融氧化”反应的还原产物为NaNO2。
回答下列问题:
(1)Cr是24号元素,它的价层电子排布式是____ 。
(2)“热熔”获得的熔渣主要是____ (填化学式)。
(3)物相4在转化为Cr2O3前需要洗涤干燥,检查是否洗涤干净的试剂是____ 。
(4)“熔融氧化”的化学方程式是____ 。
(5)Na2CrO4溶液“调pH”是将pH调____ (填“大”或“小”),原因是____ 。
(6)“转化分离”中通过蒸发浓缩、降温至10℃,结晶过滤的方法分离得到产物,其原因是____ 。

已知:“熔融氧化”反应的还原产物为NaNO2。
回答下列问题:
(1)Cr是24号元素,它的价层电子排布式是
(2)“热熔”获得的熔渣主要是
(3)物相4在转化为Cr2O3前需要洗涤干燥,检查是否洗涤干净的试剂是
(4)“熔融氧化”的化学方程式是
(5)Na2CrO4溶液“调pH”是将pH调
(6)“转化分离”中通过蒸发浓缩、降温至10℃,结晶过滤的方法分离得到产物,其原因是
您最近一年使用:0次
名校
解题方法
5 . 下列事实能用勒夏特列原理来解释的是
A.SO2被氧化为SO3,往往需要使用催化剂:2SO2(g)+O2(g)  2SO3(g) 2SO3(g) |
B.500 ℃温度比室温更有利于合成氨反应:N2(g)+3H2(g)  2NH3(g)△H<0 2NH3(g)△H<0 |
C.H2、I2、HI平衡混合气体加压后颜色加深:H2(g)+I2(g)  2HI(g) 2HI(g) |
D.实验室采用排饱和食盐水的方法收集氯气:Cl2+H2O  H++Cl-+HClO H++Cl-+HClO |
您最近一年使用:0次
2022-10-06更新
|
842次组卷
|
40卷引用:湖南省湘潭市第一中学2020-2021学年高二下学期期中考试(水平测试)化学试卷
湖南省湘潭市第一中学2020-2021学年高二下学期期中考试(水平测试)化学试卷湖南省长沙宁乡市第十高级中学2020-2021学年高二上学期10月月考化学试题2015-2016学年湖北省黄冈市高二上学期期末考试化学试卷2015-2016学年内蒙古包头九中高一下期末化学试题【校级联考】福建省晋江市(安溪一中、养正中学、惠安一中、泉州实验中学四校)2018-2019学年高二上学期期中考试化学试题江西省赣州市南康中学2019-2020学年高二上学期第一次月考化学试题山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试化学试题山东省实验中学2019-2020学年高二上学期期中考试化学试题(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》山西省怀仁市重点中学2019-2020学年高二上学期期末考试化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题江西省南昌市第十中学2020-2021学年高二上学期第一次月考化学试题(已下线)【南昌新东方】7. 南昌十中 徐钢 刘惠文.(已下线)第七章 能力提升检测卷-2021年高考化学一轮复习讲练测山东省临沂市第四中学2020-2021学年高二11月份阶段检测化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第二次月考化学试题天津市滨海新区大港油田第三中学2020-2021学年高二上学期期中考试化学试题重庆市第七中学2020-2021学年高二上学期第一次月考化学试题河北省张家口市宣化一中2020-2021学年高二下学期期初考试化学试题(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题七 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题23 化学平衡的移动和化学反应进行的方向(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练重庆市育才中学校2021-2022学年高二上学期第一次月考化学试题四川省广安市武胜烈面中学校2021-2022学年高二10月月考化学试题新疆伊犁市奎屯市第一高级中学2019-2020学年高二上学期期中考试化学试题湖北省石首市第一中学2021-2022学年高二上学期10月月考化学试题(已下线)卷11 化学反应速率和平衡选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)第21讲 化学平衡状态 化学平衡的移动(讲)-2023年高考化学一轮复习讲练测(全国通用)天津市咸水沽第二中学2021-2022学年高二上学期期中化学试题河北省邯郸市大名县第一中学2022-2023学年高二上学期第一次月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高三上学期期中检测化学试题河北省石家庄市第十八中学2022-2023学年高二上学期10月月考化学试题广东省佛山市顺德区第一中学2022-2023学年高二上学期期中考试化学试题广东省佛山市三水中学2022-2023学年高二上学期11月第二次统测化学试题(已下线)第2讲 化学平衡状态及化学平衡的移动广东省肇庆市封开县广信中学、四会中学2023-2024学年高二上学期第一次联考化学试题天津市实验中学滨海学校2022-2023学年高二上学期期中质量调查化学试题广东省湛江市第二十一中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 已知反应:
 ,不同条件下,以X和Y的物质的量之比为
,不同条件下,以X和Y的物质的量之比为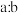 开始反应,反应达到平衡时,Z的物质的量分数与压强及温度的关系如图所示。下列判断正确的是
开始反应,反应达到平衡时,Z的物质的量分数与压强及温度的关系如图所示。下列判断正确的是
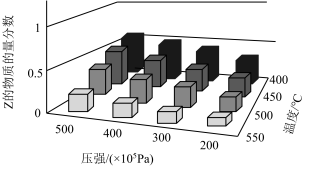

 ,不同条件下,以X和Y的物质的量之比为
,不同条件下,以X和Y的物质的量之比为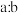 开始反应,反应达到平衡时,Z的物质的量分数与压强及温度的关系如图所示。下列判断正确的是
开始反应,反应达到平衡时,Z的物质的量分数与压强及温度的关系如图所示。下列判断正确的是
A.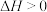 | B.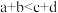 |
| C.反应物的转化率随温度升高而减小 | D.反应物的转化率随压强增大而减小 |
您最近一年使用:0次
2022-09-22更新
|
329次组卷
|
4卷引用:湖南省宁乡市四校联考2022-2023学年高二上学期10月月考化学试题
7 . 对于平衡体系mA(g)+nB(g) pC(g)+qD(g) △H<0。下列结论正确的是
pC(g)+qD(g) △H<0。下列结论正确的是
 pC(g)+qD(g) △H<0。下列结论正确的是
pC(g)+qD(g) △H<0。下列结论正确的是| A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n>p+q |
| B.若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时气体的总物质的量等于2amol |
| C.若平衡时,A.B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| D.温度升高时,K值增大 |
您最近一年使用:0次
8 . 在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示。则下列结论正确的是
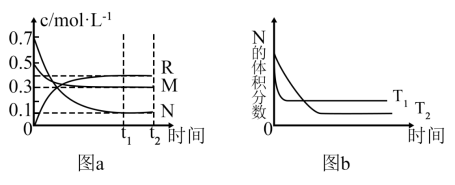

A.该反应的热化学方程式M(g)+3N(g) 2R(g) △H<0 2R(g) △H<0 |
| B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率增大 |
| D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动 |
您最近一年使用:0次
名校
解题方法
9 . 反应mX(g) nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
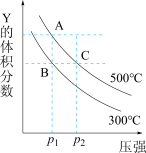
 nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
| A.该反应的ΔH>0 | B.m<n+p |
| C.B、C两点化学平衡常数:KB>KC | D.A、C两点的反应速率v(A)<v(C) |
您最近一年使用:0次
2022-09-15更新
|
2033次组卷
|
47卷引用:湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题
湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题湖南省攸县第一中学2022-2023学年高二上学期期末考试化学试题2015-2016学年浙江台州中学高二上第三次统练化学试卷内蒙古自治区北京八中乌兰察布分校2018-2019学年高二下学期第一次月考化学试题湖北省随州二中2019-2020学年高二上学期9月份月考化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题甘肃省镇原县镇原中学2019-2020学年高二上学期期中考试化学(理)试题甘肃省镇原县镇原中学2019-2020学年高一上学期期中考试化学(理)试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)2020年北京高二下学期 复习模拟试题二(选修4人教版)安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题(已下线)练习7 化学平衡(二)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)重庆市暨华中学校2021-2022学年高二上学期第一次月考化学试题四川省广安市武胜烈面中学校2021-2022学年高二10月月考化学试题天津市武清区崔黄口中学2021-2022学年高二上学期第一次练习化学试题重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题河南省平顶山九校联盟2021-2022学年高二上学期期中考试化学试题四川省广安市2021-2022学年高二上学期期末考试化学试题河南省宋基信阳实验中学2021-2022学年高三上学期12月月考化学试题吉林省长春市第六中学2021-2022学年高二上学期第三学程考试(理)化学试题陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题天津市武清区四校2022-2023学年高二上学期第一次阶段性练习化学试题上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题贵州省黔西南州金成实验学校2022-2023学年高二上学期9月月考化学试题重庆市江津中学2022-2023学年高二上学期10月阶段性考试化学试题山东省滕州市第一中学2022-2023学年高二上学期11月月考化学试题新疆昌吉州行知学校2022-2023学年高二上学期第一次线上月考化学试题四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题山东省泰安市宁阳县复圣中学2022-2023学年高二上学期期末考试化学试题 重庆市育才中学校2022-2023学年高二上学期期中考试化学试题辽宁省丹东市第二中学 大石桥市第三高级中学2022-2023学年高二上学期期末联考化学试题四川省宜宾市第四中学校2023-2024学年高二上学期9月月考化学试题四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题重庆市荣昌中学校2023-2024学年高二上学期期中考试化学试题四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题新疆生产建设兵团第二师八一中学2023-2024学年高二上学期期中考试化学(理科)试题四川省内江市威远中学校2023-2024学年高二上学期第二次月考(期中)化学试卷陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(三)化学试题陕西省宝鸡市渭滨区2023-2024学年高二上学期期末考试化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期1月期末化学试题 贵州省遵义市仁怀市第六中学2023-2024学年高二上学期期中考试化学试题河南省驻马店市环际大联考2023-2024学年高二上学期11月期中考试化学试题福建省泉州市泉州中远学校2023-2024学年高二上学期11月期中化学试题
名校
解题方法
10 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有硅、铝等杂质。制备流程如图所示:
,还含有硅、铝等杂质。制备流程如图所示:
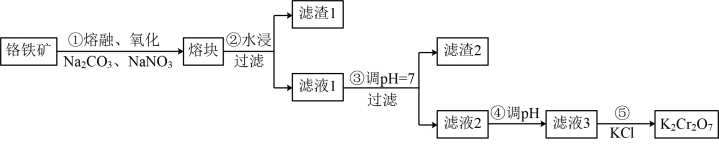
回答下列问题:
(1)步骤①的主要反应为: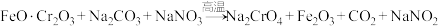
上述反应配平后 与
与 的系数比为
的系数比为___________ 。
(2)滤渣1中含量最多的金属元素是___________ ,滤渣2的主要成分是___________ 及含硅杂质。
(3)步骤④调滤液2的 使之变
使之变___________ (填“大”或“小”),原因是___________ (用离子方程式表示)。
(4)有关物质的溶解度如图所示。

向“滤液3”中加入适量 ,蒸发浓缩,冷却结晶,过滤得到
,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到
固体。冷却到___________ (填标号)得到的 固体产品最多。
固体产品最多。
a. 80℃ b. 60℃ c. 40℃ d. 10℃
 ,还含有硅、铝等杂质。制备流程如图所示:
,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:
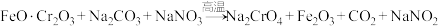
上述反应配平后
 与
与 的系数比为
的系数比为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的
 使之变
使之变(4)有关物质的溶解度如图所示。

向“滤液3”中加入适量
 ,蒸发浓缩,冷却结晶,过滤得到
,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到
固体。冷却到 固体产品最多。
固体产品最多。a. 80℃ b. 60℃ c. 40℃ d. 10℃
您最近一年使用:0次
2022-09-12更新
|
324次组卷
|
2卷引用:湖南省株洲市攸县第三中学2022-2023学年高三上学期第二次月考化学试题



