1 . 工业上用黄铜矿(主要成分是CuFeS2,还含有少量SiO2等)制备CuCl的工艺流程如图:
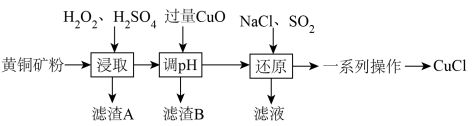
已知:①CuCl是一种难溶于水和乙醇的白色固体,在潮湿的空气中易水解氧化为碱式氯化铜Cu2(OH)3Cl。
(2)25℃时,Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)“滤渣A”的主要成分是_______ (填化学式)。
(2)“浸取”时,H2O2的实际用量远远超过理论用量,可能原因是______ 。
(3)当溶液中离子浓度≤1.0×10-5mol•L-1时,可认为该离子已沉淀完全。加入CuO调pH,使溶液中Fe3+沉淀完全,此时,溶液中c(Cu2+)=0.22mol•L-1,则“调pH”的合理范围为_______ 。
(4)“还原”过程生成CuCl的离子方程式是_______ 。
(5)“一系列操作”是指:加入去氧水、过滤、用无水乙醇洗涤、真空干燥。加入去氧水的目的是______ 。
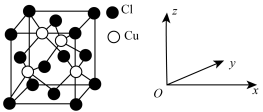
(6)①已知:CuCl的熔点为326℃,能升华,熔化呈液态时不导电。则CuCl晶体属于_______ (填晶体类型)。写出基态Cu+的核外电子排布式_______ 。
②原子坐标参数表示晶胞内部各原子的相对位置,图中 位置原子的坐标参数为(
位置原子的坐标参数为( ,
, ,
, ),则图中
),则图中 位置原子的坐标参数为
位置原子的坐标参数为_______ 。

已知:①CuCl是一种难溶于水和乙醇的白色固体,在潮湿的空气中易水解氧化为碱式氯化铜Cu2(OH)3Cl。
(2)25℃时,Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)“滤渣A”的主要成分是
(2)“浸取”时,H2O2的实际用量远远超过理论用量,可能原因是
(3)当溶液中离子浓度≤1.0×10-5mol•L-1时,可认为该离子已沉淀完全。加入CuO调pH,使溶液中Fe3+沉淀完全,此时,溶液中c(Cu2+)=0.22mol•L-1,则“调pH”的合理范围为
(4)“还原”过程生成CuCl的离子方程式是
(5)“一系列操作”是指:加入去氧水、过滤、用无水乙醇洗涤、真空干燥。加入去氧水的目的是
(6)①已知:CuCl的熔点为326℃,能升华,熔化呈液态时不导电。则CuCl晶体属于
②原子坐标参数表示晶胞内部各原子的相对位置,图中
 位置原子的坐标参数为(
位置原子的坐标参数为( ,
, ,
, ),则图中
),则图中 位置原子的坐标参数为
位置原子的坐标参数为
您最近半年使用:0次
名校
2 . 卤族元素单质及其化合物应用广泛。 具有与卤素单质相似的化学性质。
具有与卤素单质相似的化学性质。 在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的
在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的 反应生成硫酰氟(
反应生成硫酰氟( )。
)。 与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37.
与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37. 通入
通入 酸性溶液中可制得黄绿色气体
酸性溶液中可制得黄绿色气体 ,该气体常用作自来水消毒剂。工业用
,该气体常用作自来水消毒剂。工业用 制备
制备 的热化学方程式为
的热化学方程式为

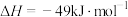 。下列关于反应
。下列关于反应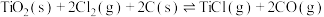 的说法
的说法不正确 的是
 具有与卤素单质相似的化学性质。
具有与卤素单质相似的化学性质。 在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的
在常温下能与Cu反应生成致密的氟化物薄膜,还能与熔融的 反应生成硫酰氟(
反应生成硫酰氟( )。
)。 与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37.
与浓硫酸反应可制得HF,常温下,测得氟化氢的相对分子质量约为37. 通入
通入 酸性溶液中可制得黄绿色气体
酸性溶液中可制得黄绿色气体 ,该气体常用作自来水消毒剂。工业用
,该气体常用作自来水消毒剂。工业用 制备
制备 的热化学方程式为
的热化学方程式为

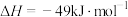 。下列关于反应
。下列关于反应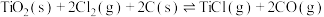 的说法
的说法A.保持其他条件不变,平衡时升高温度, |
B.保持其他条件不变,平衡时通入 ,达到新平衡时 ,达到新平衡时 变小 变小 |
C.反应生成1mol ,转移电子数目为 ,转移电子数目为 |
D.及时分离出CO,有利于 生成 生成 |
您最近半年使用:0次
名校
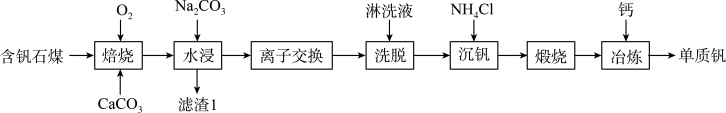
3 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是 、
、 ,含有的杂质有
,含有的杂质有 、
、 及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
已知:
①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
② ,
, ,
, 远大于
远大于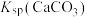 。
。
回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施有___________ 、___________ 。
(2)“焙烧”时, 、
、 都转化为
都转化为 ,写出
,写出 转化为
转化为 的化学方程式:
的化学方程式:___________ 。
(3)“水浸”加入 调节溶液的pH为8.5,可完全除去的金属离子有
调节溶液的pH为8.5,可完全除去的金属离子有___________ ,部分除去的金属离子有___________ 。“水浸”加入过量 不能使
不能使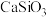 完全转化为
完全转化为 ,原因是
,原因是___________ 。
(4)“离子交换”与“洗脱”可表示为 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用___________ 。
(5)“沉钒”过程析出 晶体,需要加入过量
晶体,需要加入过量 ,目的是
,目的是___________ 。
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。
 、
、 ,含有的杂质有
,含有的杂质有 、
、 及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
已知:
①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
 ,
, ,
, 远大于
远大于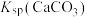 。
。回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施有
(2)“焙烧”时,
 、
、 都转化为
都转化为 ,写出
,写出 转化为
转化为 的化学方程式:
的化学方程式:(3)“水浸”加入
 调节溶液的pH为8.5,可完全除去的金属离子有
调节溶液的pH为8.5,可完全除去的金属离子有 不能使
不能使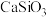 完全转化为
完全转化为 ,原因是
,原因是(4)“离子交换”与“洗脱”可表示为
 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(5)“沉钒”过程析出
 晶体,需要加入过量
晶体,需要加入过量 ,目的是
,目的是(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。
| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近半年使用:0次
4 . 下列方案设计、现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 检验铜和浓硫酸反应之后是否有酸剩余 | 取少量反应后的溶液于试管中,依次加入盐酸和BaCl2溶液 | 若出现白色沉淀,则硫酸剩余 |
| B | 探究淀粉在酸性条件下的水解程度 | 取少量淀粉溶液,加入适量稀硫酸加热5min后,再加NaOH中和硫酸,最后滴加碘水 | 溶液无明显现象,则淀粉完全水解 |
| C | 比较CH3COOH和HClO的酸性强弱 | 相同条件下分别用pH试纸测定0.1mol•L-1CH3COONa溶液、0.1mol•L-1NaClO溶液的pH | NaClO溶液pH>CH3COONa溶液的pH,证明CH3COOH的酸性比HClO的酸性强 |
| D | 探究浓度对化学平衡的影响 | 在4mL0.1mol•L-1K2Cr2O7溶液中加入数滴1mol•L-1NaOH溶液 | 若溶液由橙色变为黄色,则H+浓度减小,Cr2O +H2O +H2O 2CrO 2CrO +2H+平衡正移 +2H+平衡正移 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
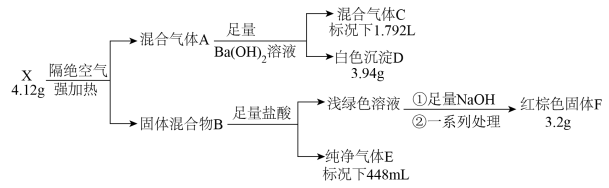
5 . 化合物X由四种元素组成,按如下流程进行实验。混合气体A由气体E和元素种类相同的另两种气体组成,且气体C的平均相对分子质量为8.5。混合物B中有两种固体。
请回答:
(1)组成X的四种元素为_______ ;X的化学式为_______ 。
(2)写出由X到A的化学方程式_______ 。
(3)用盐酸溶解固体F,滴加一定量KSCN溶液,得到血红色溶液Y。往溶液Y中加入一定量KCl固体,溶液Y颜色变淡,请结合离子方程式说明原因_______ 。
(4)设计实验检验混合气体A中相对分子量较小的两种气体_______ 。

请回答:
(1)组成X的四种元素为
(2)写出由X到A的化学方程式
(3)用盐酸溶解固体F,滴加一定量KSCN溶液,得到血红色溶液Y。往溶液Y中加入一定量KCl固体,溶液Y颜色变淡,请结合离子方程式说明原因
(4)设计实验检验混合气体A中相对分子量较小的两种气体
您最近半年使用:0次
解题方法
6 . 某铜矿酸性废水除去不溶性固体杂质后,仍含有c(H+)=0.1mol•L-1,c(Cu2+)=0.05mol•L-1,需净化处理。
已知:①含铜污水的排放标准为pH=7,c(Cu2+)≤1×10-7mol•L-1。
②Ksp[Cu(OH)2]=2.2×10-20,Ksp(CuS)=6.4×10-36,Ksp(FeS)=6.3×10-18;Kb(NH3•H2O)=1.7×10-25,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15。
(1)中和沉淀法处理。
①向酸性废水中加入氨水,调节pH,溶液中铜的去除率与pH关系如图所示。则pH由7到10时,铜的去除率下降的主要原因为_______ (用离子方程式表示)。

②若加入石灰乳处理废水,结合计算判断生成氢氧化铜沉淀能否达到排放标准______ (写出计算过程)。
(2)硫化物沉淀法处理。
①加入Na2S处理废水,pH=7时,Na2S溶液中硫元素的主要存在的微粒为_______ 。
②用FeS处理含铜废水比Na2S效果好。请通过必要的计算和说明采用FeS处理的优点的原因______ 。
(3)溶剂萃取法。用萃取剂RH可萃取废水中的铜离子,再加入20%的硫酸进行反萃取。
①实验室进行萃取操作时,振荡静置后,需对分液漏斗放气,正确放气的图示为_______ (填标号)。
A.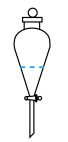 B.
B. 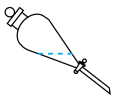 C.
C.
②萃取时,适度增大溶液的pH,Cu2+萃取率升高的原因是_______ 。
(4)实验中需测定废液中铜离子含量。
已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O =2I-+S4O
=2I-+S4O 。
。
请运用上述原理完成测定某弱酸性溶液中铜离子含量的实验方案:量取25.00mL废水于锥形瓶中,_______ (实验中须使用的试剂:0.1mol•L-1KI溶液、0.05000mol•L-1Na2S2O3标准溶液、0.5%淀粉溶液)。
已知:①含铜污水的排放标准为pH=7,c(Cu2+)≤1×10-7mol•L-1。
②Ksp[Cu(OH)2]=2.2×10-20,Ksp(CuS)=6.4×10-36,Ksp(FeS)=6.3×10-18;Kb(NH3•H2O)=1.7×10-25,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15。
(1)中和沉淀法处理。
①向酸性废水中加入氨水,调节pH,溶液中铜的去除率与pH关系如图所示。则pH由7到10时,铜的去除率下降的主要原因为

②若加入石灰乳处理废水,结合计算判断生成氢氧化铜沉淀能否达到排放标准
(2)硫化物沉淀法处理。
①加入Na2S处理废水,pH=7时,Na2S溶液中硫元素的主要存在的微粒为
②用FeS处理含铜废水比Na2S效果好。请通过必要的计算和说明采用FeS处理的优点的原因
(3)溶剂萃取法。用萃取剂RH可萃取废水中的铜离子,再加入20%的硫酸进行反萃取。
①实验室进行萃取操作时,振荡静置后,需对分液漏斗放气,正确放气的图示为
A.
 B.
B.  C.
C.
②萃取时,适度增大溶液的pH,Cu2+萃取率升高的原因是
(4)实验中需测定废液中铜离子含量。
已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。请运用上述原理完成测定某弱酸性溶液中铜离子含量的实验方案:量取25.00mL废水于锥形瓶中,
您最近半年使用:0次
7 . 利用某一工业钴渣(主要成分为 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示:
①沉淀1为黄钠铁矾,化学式为: 。
。
②当某离子浓度 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,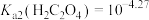
③氧化性:
(1)“浸出”过程中 元发生反应的离子方程式为
元发生反应的离子方程式为_______ ,用盐酸代替硫酸的缺点是_______ 。
(2)“浸出液”中加入 的作用是
的作用是_______ ,试剂a为_______ 。
(3)有机萃取剂用HR表示,发生萃取的反应可表示为 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是_______ 。
(4)沉淀2为 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH=_______ 。用 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=_______ 。
(5)已知氧化性: 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是_______ 。
 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示: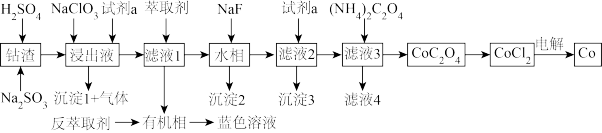
①沉淀1为黄钠铁矾,化学式为:
 。
。②当某离子浓度
 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,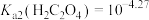
③氧化性:

(1)“浸出”过程中
 元发生反应的离子方程式为
元发生反应的离子方程式为(2)“浸出液”中加入
 的作用是
的作用是(3)有机萃取剂用HR表示,发生萃取的反应可表示为
 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是(4)沉淀2为
 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH= 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=(5)已知氧化性:
 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是
您最近半年使用:0次
2023·全国·模拟预测
解题方法
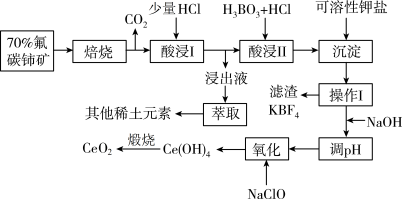
8 . 铈(Ce)是人类发现的第二种稀土元素,铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(主要含 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知:①铈的常见化合价为+3、+4。四价铈不易进入溶液,而三价铈易进入溶液
② 能与
能与 结合成
结合成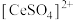 ,
, 能被萃取剂
能被萃取剂 萃取。
萃取。
(1)焙烧后铈元素转化成 和
和 ,焙烧氟碳铈矿的目的是
,焙烧氟碳铈矿的目的是___________ 。
(2)“酸浸II”过程中 转化为
转化为 ,且产生黄绿色气体,用稀硫酸和
,且产生黄绿色气体,用稀硫酸和 替换
替换 就不会造成环境污染。则稀硫酸、
就不会造成环境污染。则稀硫酸、 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)“操作I”的名称是___________ 。
(4)“浸出液”中含有少量 及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时
及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时 与萃取剂
与萃取剂 存在反应:
存在反应:
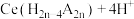 。用D表示
。用D表示 分别在有机层中与水层中存在形式的浓度之比:
分别在有机层中与水层中存在形式的浓度之比: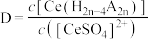 ,其他条件不变,在浸出液中加入不同量的
,其他条件不变,在浸出液中加入不同量的 ,以改变水层中的
,以改变水层中的 ,D随浸出液中
,D随浸出液中 增大而减小的原因是
增大而减小的原因是___________ 。
(5)取 上述流程中得到的
上述流程中得到的 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含 的硫酸亚铁溶液使
的硫酸亚铁溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则
标准溶液。则 的质量分数为
的质量分数为___________ (已知氧化性: ;
; 的相对分子质量为208)。
的相对分子质量为208)。
 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知:①铈的常见化合价为+3、+4。四价铈不易进入溶液,而三价铈易进入溶液
②
 能与
能与 结合成
结合成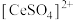 ,
, 能被萃取剂
能被萃取剂 萃取。
萃取。(1)焙烧后铈元素转化成
 和
和 ,焙烧氟碳铈矿的目的是
,焙烧氟碳铈矿的目的是(2)“酸浸II”过程中
 转化为
转化为 ,且产生黄绿色气体,用稀硫酸和
,且产生黄绿色气体,用稀硫酸和 替换
替换 就不会造成环境污染。则稀硫酸、
就不会造成环境污染。则稀硫酸、 与
与 反应的离子方程式为
反应的离子方程式为(3)“操作I”的名称是
(4)“浸出液”中含有少量
 及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时
及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时 与萃取剂
与萃取剂 存在反应:
存在反应:
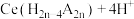 。用D表示
。用D表示 分别在有机层中与水层中存在形式的浓度之比:
分别在有机层中与水层中存在形式的浓度之比: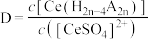 ,其他条件不变,在浸出液中加入不同量的
,其他条件不变,在浸出液中加入不同量的 ,以改变水层中的
,以改变水层中的 ,D随浸出液中
,D随浸出液中 增大而减小的原因是
增大而减小的原因是(5)取
 上述流程中得到的
上述流程中得到的 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含 的硫酸亚铁溶液使
的硫酸亚铁溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则
标准溶液。则 的质量分数为
的质量分数为 ;
; 的相对分子质量为208)。
的相对分子质量为208)。
您最近半年使用:0次
9 . 通过向烟道内喷入还原剂NH3,然后在催化剂的作用下将烟气中的NOx还原成清洁的N2和H2O。回答下列问题:
(1)已知下列反应的热化学方程式
①2NH3(g)+2NO(g)+ O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1
O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1
②2NO2(g)+ NH3(g)⇌
NH3(g)⇌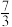 N2(g)+4H2O(g) ΔH2=-912kJ·mol-1
N2(g)+4H2O(g) ΔH2=-912kJ·mol-1
③NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g) ΔH3
④2NH3(g)+ O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1
O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1
计算反应③的ΔH3=___________ kJ·mol-1
(2)关于合成氨工艺的下列理解,不正确的是___________(填字母)。
(3)工业上生产NH3过程中,常用Fe作催化剂,控制温度773K,压强3.0×107Pa,原料中N2和H2物质的量之比为1:2.8.分析说明原料气中N2过量的理由:___________ 。
(4)若向容积为1.0L的反应容器中通入5molN2、15molH2,在不同温度下分别达到平衡时,混合气体中NH3的质量分数随压强变化的曲线如图所示。

①温度T1、T2、T3大小关系是___________ 。
②M点的平衡常数K=___________ (可用计算式表示)。
(5)铁和氨气在一定条件下发生置换反应生成氢气和另外一种化合物,该化合物的晶胞结构如图所示,该化合物的化学式为___________ ,若两个最近的Fe原子间的距离为acm,设NA为阿伏加德罗常数的数值,则该晶体的密度是___________ gcm-3(列出表达式即可)

(1)已知下列反应的热化学方程式
①2NH3(g)+2NO(g)+
 O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1
O2(g)⇌2N2(g)+3H2O(g) ΔH1=-813kJ·mol-1②2NO2(g)+
 NH3(g)⇌
NH3(g)⇌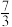 N2(g)+4H2O(g) ΔH2=-912kJ·mol-1
N2(g)+4H2O(g) ΔH2=-912kJ·mol-1③NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g) ΔH3
④2NH3(g)+
 O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1
O2(g)⇌N2(g)+3H2O(g) ΔH4=-633kJ·mol-1计算反应③的ΔH3=
(2)关于合成氨工艺的下列理解,不正确的是___________(填字母)。
| A.工业实际生产中合成氨反应的ΔH和ΔS都小于零 |
| B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率 |
| C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行 |
| D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂“中毒” |
(4)若向容积为1.0L的反应容器中通入5molN2、15molH2,在不同温度下分别达到平衡时,混合气体中NH3的质量分数随压强变化的曲线如图所示。

①温度T1、T2、T3大小关系是
②M点的平衡常数K=
(5)铁和氨气在一定条件下发生置换反应生成氢气和另外一种化合物,该化合物的晶胞结构如图所示,该化合物的化学式为

您最近半年使用:0次
名校
10 . 某学习小组欲利用 平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
 溶液和20 mL 0.015 mol⋅L
溶液和20 mL 0.015 mol⋅L KSCN溶液混合,得血红色溶液X,进行下列实验:
KSCN溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变 、
、 、
、 、
、 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取2 mL溶液X,加入5滴0.01 mol⋅L KSCN溶液,溶液红色
KSCN溶液,溶液红色_______ (填“变深”、“变浅”或“不变”,下同);取2 mL溶液X,插入经砂纸打磨过的铁丝,溶液红色_______ 。基于上述两个实验可以得到的结论是_______ 。
(2)取2 mL溶液X,加入5滴0.03 mol⋅L KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是
KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是_______ 或者不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.探究KCl对 平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
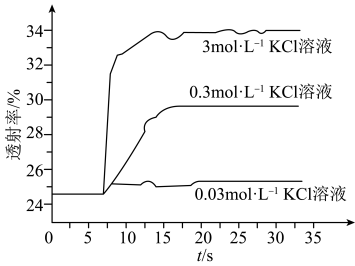
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响_______ 。二是_______ 。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:_______ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响
平衡体系产生的影响
资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取2 mL溶液X,分别加入5滴①去离子水、②0.3 mol⋅L KCl溶液、③0.3 mol⋅L
KCl溶液、③0.3 mol⋅L NaCl溶液、④0.3 mol⋅L
NaCl溶液、④0.3 mol⋅L
 溶液、⑤3 mol⋅L
溶液、⑤3 mol⋅L HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。

上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是_______ 。盐效应影响较大的阳离子是_______ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:_______ 。
 平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
 溶液和20 mL 0.015 mol⋅L
溶液和20 mL 0.015 mol⋅L KSCN溶液混合,得血红色溶液X,进行下列实验:
KSCN溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
 、
、 、
、 、
、 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取2 mL溶液X,加入5滴0.01 mol⋅L
 KSCN溶液,溶液红色
KSCN溶液,溶液红色(2)取2 mL溶液X,加入5滴0.03 mol⋅L
 KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是
KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.探究KCl对
 平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。猜想②:
 产生的影响。
产生的影响。猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响
平衡体系产生的影响资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取2 mL溶液X,分别加入5滴①去离子水、②0.3 mol⋅L
 KCl溶液、③0.3 mol⋅L
KCl溶液、③0.3 mol⋅L NaCl溶液、④0.3 mol⋅L
NaCl溶液、④0.3 mol⋅L
 溶液、⑤3 mol⋅L
溶液、⑤3 mol⋅L HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:
您最近半年使用:0次
2023-05-21更新
|
320次组卷
|
2卷引用:山东省泰安市2023届高三下学期三模化学试题



