名校
1 . 已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
 N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小,且整个操作过程物质均为气态)。下列说法不正确的是
| A.b点到c点的实验现象是气体颜色先变深后变浅,最后气体颜色比a点还要深 |
| B.c点与a点相比,n(NO2)减小,混合气体密度增大 |
| C.d 点:v(正)<v(逆) |
D.若在注射器中对反应H2(g)+I2(g)  2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 2HI(g)进行完全相同的操作,最后能得到相似的透光率变化趋势图象 |
您最近半年使用:0次
2017-02-28更新
|
319次组卷
|
3卷引用:2016-2017学年浙江省台州市高二上学期期末质量评估考试化学试卷
名校
2 . 下列关于各图的叙述正确的是
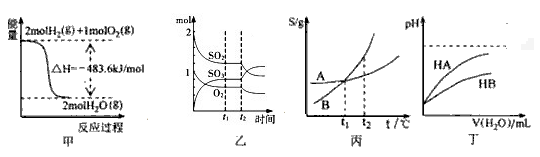

| A.图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 |
B.图乙表示一定条件下进行的反应2SO2+O2 2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积 2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积 |
| C.图丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω(A) |
| D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH |
您最近半年使用:0次
3 . 工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为


 Cr3+
Cr3+ Cr(OH)3↓ 其中第①步存在平衡:2
Cr(OH)3↓ 其中第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显________ 色。
(2)能说明第①步反应达平衡状态的是_________ 。(选填编号)
a. 和
和 的浓度相同 b.v正(
的浓度相同 b.v正( )=2v逆(
)=2v逆( )
)
c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中 转变为Cr3+的离子方程式:
转变为Cr3+的离子方程式:_______________________ .
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色) Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为____________________ 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以___________ 形式存在(填写离子符号)。
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为


 Cr3+
Cr3+ Cr(OH)3↓ 其中第①步存在平衡:2
Cr(OH)3↓ 其中第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O
(橙色)+H2O(1)若平衡体系的pH=2,则溶液显
(2)能说明第①步反应达平衡状态的是
a.
 和
和 的浓度相同 b.v正(
的浓度相同 b.v正( )=2v逆(
)=2v逆( )
)c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中
 转变为Cr3+的离子方程式:
转变为Cr3+的离子方程式:(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色)
 Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以
您最近半年使用:0次
解题方法
4 . 下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
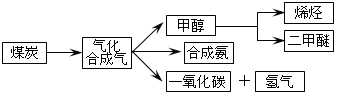
I.已知该产业链中某反应的平衡表达式为:K= ,它所对应反应的化学方程式为
,它所对应反应的化学方程式为________________ ;
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)△H1=-90.7kJ•mol-1
CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)△H3=-41.2kJ•mol-1
CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为________________ ,830℃时反应③的K=1.0,则在催化反应室中反应③的K________________ 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)="a" mol/L;达到平衡后,c(CH3OH)=2mol/L,a=________________ mol/L.
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
①此时刻,v正________________ v逆(填“大于”、“小于”或“等于”).
②平衡时二甲醚的物质的量浓度是________________ 。
(4)以二甲醚、空气、KOH溶液为原料,以石墨为电极可直接构成原电池,则该电池的负极反应式为________________ ;若以1.12L•min-1(标准状况)的速率向电池中通入二甲醚,用该电池电解500mL 2mol•L-1CuSO4溶液,通电0.50min后,计算理论上可析出金属铜的质量为________________ 。

I.已知该产业链中某反应的平衡表达式为:K=
 ,它所对应反应的化学方程式为
,它所对应反应的化学方程式为II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)
 CH3OH(g)△H1=-90.7kJ•mol-1
CH3OH(g)△H1=-90.7kJ•mol-1②2CH3OH(g)
 CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g)△H3=-41.2kJ•mol-1
CO2(g)+H2(g)△H3=-41.2kJ•mol-1(1)催化反应室中总反应的热化学方程式为
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)="a" mol/L;达到平衡后,c(CH3OH)=2mol/L,a=
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
①此时刻,v正
②平衡时二甲醚的物质的量浓度是
(4)以二甲醚、空气、KOH溶液为原料,以石墨为电极可直接构成原电池,则该电池的负极反应式为
您最近半年使用:0次
5 . 1.
化学选修:化学与技术随着能源问题的进一步突出,氢能作为一种清洁、高效、安全、可持续的能源,被视为21世纪最具发展潜力的清洁能源,开发氢能已引起各国的高度重视.
1.生产氢气的方式很多,写出工业生产中采用煤为原料制取氢气的化学反应方程式:_______ 。
2.热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

请回答下列问题;
①该循环工艺过程的总反应方程式为__________________ .
②运用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出氢气的目的是__________ 。
3.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4热化学循环制氢的反应可表示为:
2MnFe2O4 2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问地:
① 在反应中MnFe2O4是___________ (填“催化剂”或“中间产物”),若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为_____________ 。
②该热化学循环法制氢尚有不足之处,进一步改进的研究方向是____________ .
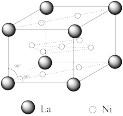
4.氢能的利用涉及氢的储存、运输和使用,镍和镧组成的一种合金LaNiX,是较好的储氢材料,能快速可逆地存储和释放氢气。LaNix的晶胞如右图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=____________ 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:LaNixH6+6NiO(OH)  LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为:
LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为:_______________ 。
化学选修:化学与技术随着能源问题的进一步突出,氢能作为一种清洁、高效、安全、可持续的能源,被视为21世纪最具发展潜力的清洁能源,开发氢能已引起各国的高度重视.
1.生产氢气的方式很多,写出工业生产中采用煤为原料制取氢气的化学反应方程式:
2.热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

请回答下列问题;
①该循环工艺过程的总反应方程式为
②运用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出氢气的目的是
3.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4热化学循环制氢的反应可表示为:
2MnFe2O4
 2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑请认真分析上述两个反应并回答下列问地:
① 在反应中MnFe2O4是
②该热化学循环法制氢尚有不足之处,进一步改进的研究方向是
4.氢能的利用涉及氢的储存、运输和使用,镍和镧组成的一种合金LaNiX,是较好的储氢材料,能快速可逆地存储和释放氢气。LaNix的晶胞如右图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=
 LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为:
LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为:
您最近半年使用:0次
6 . 有文献报道,硫在空气中燃烧时,产物中SO3约占5% ~ 6%(体积比,下同),而硫在纯氧气中燃烧时,其产物中的SO3约占2% ~ 3%,解释这一事实的理由正确的是( )
| A.在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动 |
| B.在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动 |
| C.在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响 |
| D.没有使用催化剂 |
您最近半年使用:0次
7 . 红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=_____________ 。
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是____________________ (用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________ (填写序号)。

(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是
CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是______ 。

 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0(1)请写出上述反应的化学平衡常数表达式:K=
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是
由图2判断,t2到t3的曲线变化的原因可能是
| A.升高温度 | B.加了催化剂 | C.通入O2 | D.缩小容器体积 |

(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是
CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是
您最近半年使用:0次
8 . 铁的单质和化合物在实验和实际生产中都有重要作用。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
(1)B装置中反应的化学方程式______________________________________________ 。
(2)A中溶液变红的原因是___________________________________________________ 。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在____ 。
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+与SCN-生成红色Fe(SCN) 3的反应____ 可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为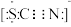 ,离子反应为:SCN-+8Cl2+9H2O=SO
,离子反应为:SCN-+8Cl2+9H2O=SO +NO3-+16Cl-+18H+ + CO2 ;
+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为____ 个。
②若要检验产物中含有SO ,常用的化学试剂是
,常用的化学试剂是________ (写试剂名称)。
Ⅱ.高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为______ 极,电极反应式为_______________________________ 。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
| 操作 | 现象 |
 | 现象1:A中溶液变红 现象2:稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+与SCN-生成红色Fe(SCN) 3的反应
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为
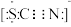 ,离子反应为:SCN-+8Cl2+9H2O=SO
,离子反应为:SCN-+8Cl2+9H2O=SO +NO3-+16Cl-+18H+ + CO2 ;
+NO3-+16Cl-+18H+ + CO2 ;①上述反应中,0.5molSCN-被氧化时转移的电子总数为
②若要检验产物中含有SO
 ,常用的化学试剂是
,常用的化学试剂是Ⅱ.高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为
您最近半年使用:0次
2010·山西太原·一模
9 . 在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
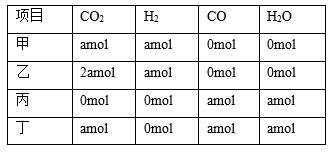
上述四种情况达到平衡后,n(CO)的大小顺序是
 CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
上述四种情况达到平衡后,n(CO)的大小顺序是
| A.乙=丁>丙=甲 | B.乙>丁>甲>丙 | C.丁>乙>丙=甲 | D.丁>丙>乙>甲 |
您最近半年使用:0次
2016-12-09更新
|
911次组卷
|
7卷引用:山西省太原五中2010届高三5月末考试试题理综化学
(已下线)山西省太原五中2010届高三5月末考试试题理综化学(已下线)2011-2012学年贵州省凯里一中高二上学期期中考试化学试卷(已下线)2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(已下线)2011-2012贵州省凯里一中第一学期期末考试高二化学试卷云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题吉林省蛟河市一中2018-2019学年高一下学期第三次测试化学试题河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题
12-13高二上·广东广州·期中
名校
10 . 对某已经达到化学平衡状态的可逆反应,如果改变某种条件,使某反应物的浓度减小,则下列说法不正确的是
| A.平衡可能向正反应方向移动 | B.平衡可能向逆反应方向移动 |
| C.生成物的浓度相应增大 | D.平衡可能移动也可能不移动 |
您最近半年使用:0次



