名校
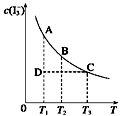
1 . I2在KI溶液中存在下列平衡:I2(aq)+I—(aq) I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法都正确的是
I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法都正确的是
①反应I2(aq) +I—(aq) I3—(aq)的
I3—(aq)的 H>0
H>0
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,在该混合液中加水,c(I3—)/c(I2)将变大
 I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法都正确的是
I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法都正确的是
①反应I2(aq) +I—(aq)
 I3—(aq)的
I3—(aq)的 H>0
H>0②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,在该混合液中加水,c(I3—)/c(I2)将变大
| A.只有①② | B.只有②③ | C.②③④ | D.②③⑤ |
您最近一年使用:0次
2018-11-20更新
|
1184次组卷
|
2卷引用:【市级联考】吉林省吉林市普通高中2019届高三上学期第一次调研测试化学试题
2 . 下列事实不能用勒夏特列原理解释的是
①溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
②工业合成氨反应N2(g) +3H2(g) 2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
③反应2 NO2(g) N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
④对于2HI(g) H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
①溴水中有下列平衡Br2+H2O
 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅②工业合成氨反应N2(g) +3H2(g)
 2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施
2NH3(g) △H<0,为提高氨的产率,实际生产中采取高温、高压的措施③反应2 NO2(g)
 N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅
N2O4(g)达平衡后,缩小容器体积可使体系颜色先变深后变浅④对于2HI(g)
 H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深| A.①② | B.②③ | C.③④ | D.②④ |
您最近一年使用:0次
名校
3 . 在一定条件下,体积不变的密闭容器中,发生可逆反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
 2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是| A.增大压强,平衡正向移动,此反应的ΔH仍保持不变 |
| B.增大O2浓度,SO2的平衡转化率减小 |
| C.降低温度,化学平衡常数减小 |
| D.升高温度,SO2的转化率一定增大 |
您最近一年使用:0次
2018-11-03更新
|
229次组卷
|
3卷引用:河北省唐山市第一中学2018-2019学年高二上学期10月月考化学试题
4 . 甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g) CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
下列说法正确的是( )
 CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 平衡 常数 | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2.0 | 4.0 | 3.2 | K1 |
| 乙 | 1 | T2 | 1.0 | 2.0 | 1.2 | K2 |
| A.K1=12.8 |
| B.T1<T2 |
| C.T1℃时向甲容器中再充入0.1 mol H2O(g),则平衡正向移动,CO2(g)的体积分数增大 |
| D.若在T2温度下,向2 L密闭容器中充入1.0 mol CO2和2.0 mol H2,达平衡时,CO2的转化率小于40% |
您最近一年使用:0次
名校
解题方法
5 . 以铬酸钾为原料,用电解法制备重铬酸钾的实验装置如图,下列说法不正确的是


| A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO +2H+ ⇌ Cr2O +2H+ ⇌ Cr2O +H2O向左移动 +H2O向左移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2 2K2Cr2O4+4KOH+2H2↑+O2↑ 2K2Cr2O4+4KOH+2H2↑+O2↑ |
| D.测定阳极液中K和Cr的含量。若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d |
您最近一年使用:0次
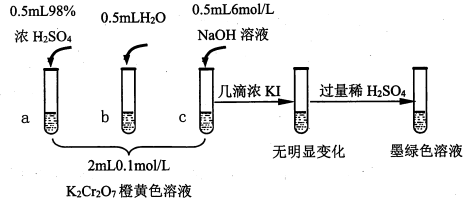
6 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________ 。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____ (“是”或“否”),理由是_________________________________ 。
(3)对比试管a、b、c的实验现象,得到的结论是________________ 。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______ ;写出此过程中氧化还原反应的离子方程式________________ 。
(5)小组同学用电解法处理含Cr2O 废水,探究不同因素对含Cr2O
废水,探究不同因素对含Cr2O 废水处理的影响,结果如下表所示(Cr2O
废水处理的影响,结果如下表所示(Cr2O 的起始浓度,体积、电压、电解时间均相同)。
的起始浓度,体积、电压、电解时间均相同)。
①实验ⅱ中Cr2O 放电的电极反应式是
放电的电极反应式是________________ 。
②实验ⅲ中Fe3+去除Cr2O 的机理如图所示,结合此机理,解释实验iv中Cr2O
的机理如图所示,结合此机理,解释实验iv中Cr2O 去除率提高较多的原因
去除率提高较多的原因_______________ 。


已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。(1)试管c和b对比,推测试管c的现象是
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?
(3)对比试管a、b、c的实验现象,得到的结论是
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是
(5)小组同学用电解法处理含Cr2O
 废水,探究不同因素对含Cr2O
废水,探究不同因素对含Cr2O 废水处理的影响,结果如下表所示(Cr2O
废水处理的影响,结果如下表所示(Cr2O 的起始浓度,体积、电压、电解时间均相同)。
的起始浓度,体积、电压、电解时间均相同)。| 实验 | ⅰ | ⅱ | ⅲ | ⅳ |
| 是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
| 是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
| 电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O 的去除率/% 的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
 放电的电极反应式是
放电的电极反应式是②实验ⅲ中Fe3+去除Cr2O
 的机理如图所示,结合此机理,解释实验iv中Cr2O
的机理如图所示,结合此机理,解释实验iv中Cr2O 去除率提高较多的原因
去除率提高较多的原因
您最近一年使用:0次
2018-04-01更新
|
644次组卷
|
3卷引用:北京市石景山区2018届高三3月统一测试(一模)理综化学试题
名校
解题方法
7 . 缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq) H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
(1)已知:CO2(g) CO2(aq) ΔH1=akJ·mol-l;
CO2(aq) ΔH1=akJ·mol-l;
CO2(aq)+H2O(l) H2CO3 (aq) ΔH2=bkJ·mol-1;
H2CO3 (aq) ΔH2=bkJ·mol-1;
HCO (aq)
(aq) H+(aq)+CO
H+(aq)+CO (aq) ΔH3=ckJ·mol-1;
(aq) ΔH3=ckJ·mol-1;
CO2(g)+H2O(l) 2H+(aq)+ CO
2H+(aq)+ CO (aq) ΔH4=dkJ·mol-1。
(aq) ΔH4=dkJ·mol-1。
则上述电离方程式中ΔH =_____________ (用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO ):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为
):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为______________ 。(lg2=0.3)若pH升高,则c(H2CO3)/c(HCO )=
)=___________ (填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________ 。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡

(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的ΔH_______________ (填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
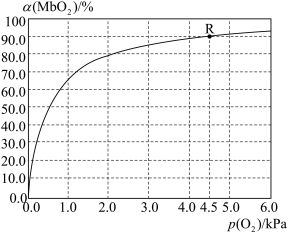
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________ (氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________ 。
Ⅰ.人体血液中存在平衡:H2CO3 (aq)
 H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。(1)已知:CO2(g)
 CO2(aq) ΔH1=akJ·mol-l;
CO2(aq) ΔH1=akJ·mol-l;CO2(aq)+H2O(l)
 H2CO3 (aq) ΔH2=bkJ·mol-1;
H2CO3 (aq) ΔH2=bkJ·mol-1;HCO
 (aq)
(aq) H+(aq)+CO
H+(aq)+CO (aq) ΔH3=ckJ·mol-1;
(aq) ΔH3=ckJ·mol-1;CO2(g)+H2O(l)
 2H+(aq)+ CO
2H+(aq)+ CO (aq) ΔH4=dkJ·mol-1。
(aq) ΔH4=dkJ·mol-1。则上述电离方程式中ΔH =
(2)若某人血液中c(HCO
 ):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为
):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为 )=
)=(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡

(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的ΔH
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:

①利用R点所示数据,计算37 ℃时该反应的平衡常数K=
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=
您最近一年使用:0次
2018-03-19更新
|
477次组卷
|
3卷引用:山东省菏泽市2018届高三第一次模拟考试理综化学试题
名校
8 . 砷为VA族元素,金属冶炼过程产生的含砷有毒废水需处理与检测。
(1)I.已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_______________ 。
II.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS
2AsS (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为______ ;砷酸的第一步电离方程式为_____________ 。
(2)“一级沉砷”中FeSO4的作用是_______________ ; “二级沉砷”中H2O2与含砷物质反应的化学方程式为_________ 。
III.去除水体中的砷,将As(Ⅲ)转化为As(Ⅴ),也可选用NaClO实现该转化。研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
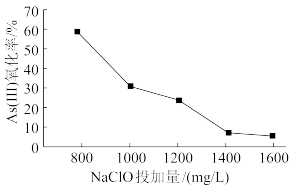
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。产生此结果的原因是_________________________________________ 。
(1)I.已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH22As(s)+
 O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =
II.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2AsS
2AsS (aq);
(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为
(2)“一级沉砷”中FeSO4的作用是
III.去除水体中的砷,将As(Ⅲ)转化为As(Ⅴ),也可选用NaClO实现该转化。研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:

已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。产生此结果的原因是
您最近一年使用:0次
9 . 某化学兴趣小组为验证SO2的还原性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:_____________ ,你预测的理论依据是(用离子方程式表示):________________________ 。
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_______________ 。
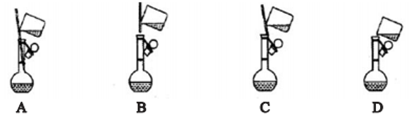
②测溶液的pH得知溶液呈酸性,其原因是:____________________ (用离子方程式表示)。
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_______________ 。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:_______________ 。
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:______________________ 。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:

②测溶液的pH得知溶液呈酸性,其原因是:
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:
您最近一年使用:0次
10 . 以下是关于“外界因素对化学平衡移动影响的实验研究”的课题,回答问题:
(1)影响化学平衡因素的界定:化学平衡发生移动的本质原因是________ ,所以影响化学平衡的因素可以从分析影响的因素入手.
a. v(正)≠v(逆) .v(正)和v(逆)都增大
.v(正)和v(逆)都增大 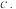 v(正)和v(逆)都减小
v(正)和v(逆)都减小
(2)研究的思路与方法
①研究对象的选择,现有以下可逆反应:
 .
.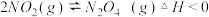
 .
.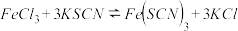
其中, 适合于研究
适合于研究_______ 对平衡的影响, 适合于研究
适合于研究_______ 对平衡的影响.
 .浓度
.浓度  .温度
.温度  .压强
.压强  .催化剂
.催化剂
②研究方法:采用控制其他因素不变,改变其中一个因素的方法,并进行对比实验.
(3)单一因素对化学平衡移动影响的实验研究:
 .浓度:将
.浓度:将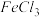 与
与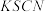 反应后所得的混合液分为
反应后所得的混合液分为 等份,分别加入浓
等份,分别加入浓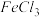 溶液、浓
溶液、浓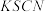 溶液和
溶液和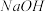 固体,观察现象.现象:加入浓
固体,观察现象.现象:加入浓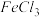 溶液后的混合溶液红色
溶液后的混合溶液红色________ ,加入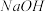 固体后,混合溶液红棕色
固体后,混合溶液红棕色________ .
 .温度:将密封并相互连通的盛有
.温度:将密封并相互连通的盛有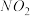 的两个玻璃球,一个放入热水中,另一个放入冷水中.
的两个玻璃球,一个放入热水中,另一个放入冷水中.
现象:放入热水中的球内红棕色________ ;放入冷水中的球内红棕色________ .
(4)综合(3)能得出的影响化学平衡移动的原因是________ .
(1)影响化学平衡因素的界定:化学平衡发生移动的本质原因是
a. v(正)≠v(逆)
 .v(正)和v(逆)都增大
.v(正)和v(逆)都增大  v(正)和v(逆)都减小
v(正)和v(逆)都减小(2)研究的思路与方法
①研究对象的选择,现有以下可逆反应:
 .
.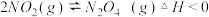
 .
.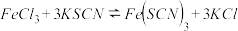
其中,
 适合于研究
适合于研究 适合于研究
适合于研究 .浓度
.浓度  .温度
.温度  .压强
.压强  .催化剂
.催化剂②研究方法:采用控制其他因素不变,改变其中一个因素的方法,并进行对比实验.
(3)单一因素对化学平衡移动影响的实验研究:
 .浓度:将
.浓度:将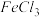 与
与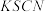 反应后所得的混合液分为
反应后所得的混合液分为 等份,分别加入浓
等份,分别加入浓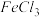 溶液、浓
溶液、浓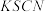 溶液和
溶液和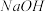 固体,观察现象.现象:加入浓
固体,观察现象.现象:加入浓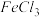 溶液后的混合溶液红色
溶液后的混合溶液红色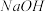 固体后,混合溶液红棕色
固体后,混合溶液红棕色 .温度:将密封并相互连通的盛有
.温度:将密封并相互连通的盛有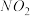 的两个玻璃球,一个放入热水中,另一个放入冷水中.
的两个玻璃球,一个放入热水中,另一个放入冷水中.现象:放入热水中的球内红棕色
(4)综合(3)能得出的影响化学平衡移动的原因是
您最近一年使用:0次



