名校
1 . I.CO、 均为大气污染物,利用催化剂处理污染气体成为化工的热点问题,在一定温度时,有催化剂存在的条件下,密闭容器中CO与
均为大气污染物,利用催化剂处理污染气体成为化工的热点问题,在一定温度时,有催化剂存在的条件下,密闭容器中CO与 转化为
转化为 与
与 ,其相关反应为:反应I:
,其相关反应为:反应I:
(1)已知:①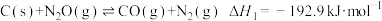
②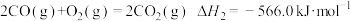
③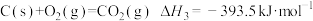
则反应 =
=_______ 。
(2)CO、 在
在 的表面进行两步反应转化为无毒的气体,其转化关系、相对能量与反应历程如图。
的表面进行两步反应转化为无毒的气体,其转化关系、相对能量与反应历程如图。

①分别写出 、CO在
、CO在 的表面上的反应方程式:
的表面上的反应方程式: _______ 、_______ 。
②第一步反应的速率比第二步的_______ (填“慢”或“快”)。两步反应均为_______ 热反应(填“放”或“吸”)。
(3)在一定温度,101 kPa下,分别在1 L密闭容器中充入2 mol 和2 mol CO,发生反应:
和2 mol CO,发生反应: ,达平衡时,测得无毒气体的体积分数75%,该条件下平衡常数
,达平衡时,测得无毒气体的体积分数75%,该条件下平衡常数
_______ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
II.汽车尾气及颗粒物等是造成近年来重度雾霾的原因之一、在汽车排气管中安装催化净化装置可以一定程度上减少对环境的伤害,其反应原理为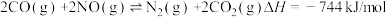 。
。
(4)为研究汽车尾气转化为无毒无害物质的有关反应,在密闭容器中充入10 mol CO和8 mol NO发生反应,如图所示为平衡时NO的体积分数与温度、压强的关系。
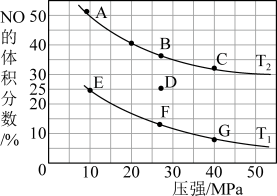
①该反应达平衡后,为了在提高反应速率同时提高NO的转化率,可采取的措施_______ (填字母代号)。
a.改用高效催化剂 b.升高温度 c.缩小容器的体积 d.增加CO的浓度
②若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的_______ 点。
III.“丁烯裂解法”是另一种重要的丙烯生产方法,但生产过程中会有生成乙烯的副反应发生。主反应: ;副反应:
;副反应: 。
。
测得上述两反应的平衡体系中,各组分的质量分数(w)随温度(t)和压强(p)变化的趋势分别如图1和图2所示。
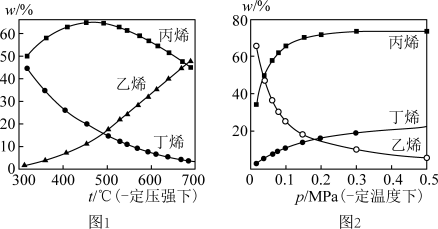
(5)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。
(6)有研究者结合图1数据并综合考虑各种因素,认为450 ℃的反应温度比300 ℃或700 ℃更合适,从反应原理角度分析其理由可能是_______ 。
 均为大气污染物,利用催化剂处理污染气体成为化工的热点问题,在一定温度时,有催化剂存在的条件下,密闭容器中CO与
均为大气污染物,利用催化剂处理污染气体成为化工的热点问题,在一定温度时,有催化剂存在的条件下,密闭容器中CO与 转化为
转化为 与
与 ,其相关反应为:反应I:
,其相关反应为:反应I:
(1)已知:①
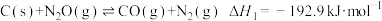
②
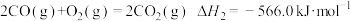
③
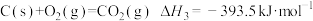
则反应
 =
=(2)CO、
 在
在 的表面进行两步反应转化为无毒的气体,其转化关系、相对能量与反应历程如图。
的表面进行两步反应转化为无毒的气体,其转化关系、相对能量与反应历程如图。
①分别写出
 、CO在
、CO在 的表面上的反应方程式:
的表面上的反应方程式: ②第一步反应的速率比第二步的
(3)在一定温度,101 kPa下,分别在1 L密闭容器中充入2 mol
 和2 mol CO,发生反应:
和2 mol CO,发生反应: ,达平衡时,测得无毒气体的体积分数75%,该条件下平衡常数
,达平衡时,测得无毒气体的体积分数75%,该条件下平衡常数
 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。II.汽车尾气及颗粒物等是造成近年来重度雾霾的原因之一、在汽车排气管中安装催化净化装置可以一定程度上减少对环境的伤害,其反应原理为
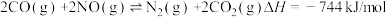 。
。(4)为研究汽车尾气转化为无毒无害物质的有关反应,在密闭容器中充入10 mol CO和8 mol NO发生反应,如图所示为平衡时NO的体积分数与温度、压强的关系。

①该反应达平衡后,为了在提高反应速率同时提高NO的转化率,可采取的措施
a.改用高效催化剂 b.升高温度 c.缩小容器的体积 d.增加CO的浓度
②若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的
III.“丁烯裂解法”是另一种重要的丙烯生产方法,但生产过程中会有生成乙烯的副反应发生。主反应:
 ;副反应:
;副反应: 。
。测得上述两反应的平衡体系中,各组分的质量分数(w)随温度(t)和压强(p)变化的趋势分别如图1和图2所示。

(5)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。
| A.300℃、0.1 MPa | B.700℃、0.1 MPa |
| C.300℃、0.5 MPa | D.700℃、0.5 MPa |
您最近半年使用:0次
名校
2 . 下列叙述及解释正确的是
A.N2(g)+3H2(g) 2NH3(g),在达到平衡后,保持压强不变,充入氩气,平衡向左移动 2NH3(g),在达到平衡后,保持压强不变,充入氩气,平衡向左移动 |
B.H2(g)+I2(g) 2HI(g) H0,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 2HI(g) H0,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
C.2C(s)+O2(g) 2CO(g),在达到平衡后,加入碳,平衡向正反应方向移动 2CO(g),在达到平衡后,加入碳,平衡向正反应方向移动 |
D.2NO2(g)(红棕色) N2O4(g)(无色) H0,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 N2O4(g)(无色) H0,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 |
您最近半年使用:0次
2023-01-11更新
|
274次组卷
|
3卷引用:辽宁省沈阳市第二中学2023-2024学年高二上学期10月阶段考试化学试题
辽宁省沈阳市第二中学2023-2024学年高二上学期10月阶段考试化学试题天津市南仓中学2022-2023学年高二上学期1月期末考试化学试题(已下线)专项02 化学反应速率与化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)
名校
3 . NO在催化剂条件下可被 H2还原为无害物质,反应为:2H2(g)+2NO(g) N2(g)+2H2O(g),在密闭容器中按c(NO)∶c(H2)=1∶1充入,反应结果如图,下列说法正确的是
N2(g)+2H2O(g),在密闭容器中按c(NO)∶c(H2)=1∶1充入,反应结果如图,下列说法正确的是
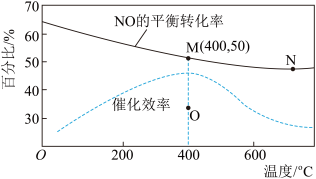
 N2(g)+2H2O(g),在密闭容器中按c(NO)∶c(H2)=1∶1充入,反应结果如图,下列说法正确的是
N2(g)+2H2O(g),在密闭容器中按c(NO)∶c(H2)=1∶1充入,反应结果如图,下列说法正确的是
| A.若投料比不变,增大起始时c(NO)和c(H2), 可以提高NO平衡转化率 |
| B.其它条件不变,将水蒸气分离出来,可以增大反应速率和NO平衡转化率 |
| C.N点比M点的平衡常数大 |
| D.若不用催化剂,M点平衡转化率会降至O点 |
您最近半年使用:0次
2023-01-09更新
|
639次组卷
|
3卷引用:辽宁省沈阳市第二中学2023-2024学年高二上学期10月阶段考试化学试题
名校
4 . 下列现象不能用勒夏特列原理解释的是
| A.为了准确测定NO2的相对分子质量,应尽量在高温低压条件下测定 |
| B.实验室制备乙酸乙酯,加入过量的乙醇 |
| C.实验室制备氯气,选用饱和食盐水净化氯气 |
| D.工业上选择高温条件和铁触媒作催化剂合成氨 |
您最近半年使用:0次
5 . 已知 ,用如图针筒装入一定量的
,用如图针筒装入一定量的 和
和 并进行如下实验。下列说法正确的是
并进行如下实验。下列说法正确的是
 ,用如图针筒装入一定量的
,用如图针筒装入一定量的 和
和 并进行如下实验。下列说法正确的是
并进行如下实验。下列说法正确的是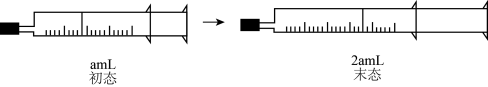
| A.初态到末态颜色变浅,平衡正向移动 | B.平均摩尔质量:末态大于初态 |
C.初态到末态 变大 变大 | D.初态到末态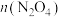 减小 减小 |
您最近半年使用:0次
2022-12-29更新
|
301次组卷
|
2卷引用:辽宁省大连市2022-2023学年高二上学期期末考试化学试题
6 . 对于N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
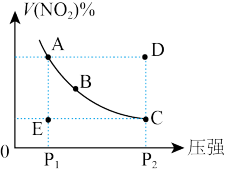
(1)A、C两点的反应速率的关系为A_______ C(填“>”、“<”或“=”)。
(2)当反应处于B状态时,v正_______ v逆(填“>”、“<”或“=”),A、B、C、D、E各状态中,v正<v逆的是_______ 。
(3)由D状态转变为C状态后,混合气体的总物质的量会_______ (填“增大”、“减小”)。
(4)欲要求使E状态从水平方向到达C状态后,再沿平衡曲线达A状态,从理论上来讲,可选用的条件是_______ 。
A.从P1无限缓慢加压至P2,再由P2无限缓慢降压至P1
B.从P1突然加压至P2,再由P2无限缓慢降压至P1
C.从P1突然加压至P2,再由P2突然降压至P1
 2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。
(1)A、C两点的反应速率的关系为A
(2)当反应处于B状态时,v正
(3)由D状态转变为C状态后,混合气体的总物质的量会
(4)欲要求使E状态从水平方向到达C状态后,再沿平衡曲线达A状态,从理论上来讲,可选用的条件是
A.从P1无限缓慢加压至P2,再由P2无限缓慢降压至P1
B.从P1突然加压至P2,再由P2无限缓慢降压至P1
C.从P1突然加压至P2,再由P2突然降压至P1
您最近半年使用:0次
名校
7 . 在密闭容器中发生反应:X+3Y 2Z △H< 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
2Z △H< 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是

 2Z △H< 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
2Z △H< 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
| A.T1大于T2 |
| B.当n(X):n(Y):n(Z)=1:3:2时,反应一定达到平衡状态 |
| C.升高温度,X体积分数增大 |
| D.Y一定呈气态 |
您最近半年使用:0次
2022-12-19更新
|
172次组卷
|
3卷引用:辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题
名校
8 . 含碳物质的价值型转化,有利于“减碳”和可持续发展。结合相关信息,回答:
(1)相关的化学键键能数据如下:


_________________  。
。
下列有利于提高CO平衡转化率的措施有_________________ (填标号)。
a.增大压强 b.降低温度
c.提高原料气中 的比例 d.使用高效催化剂
的比例 d.使用高效催化剂
(2)已知将 、
、 催化重整为可用的化学品,对改善环境意义重大,某科研团队在密闭容器中进行“合成气催化重整”,反应的化学方程式为
催化重整为可用的化学品,对改善环境意义重大,某科研团队在密闭容器中进行“合成气催化重整”,反应的化学方程式为
①下列能说明该反应达到化学平衡状态的是_________________ 。
a.混合气体的平均相对分子质量不再变化 B.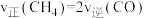
C.甲烷与氢气浓度比值不再变化 D.容器内混合气体的密度不再变化
②当投料比 时,
时, 的平衡转化率(
的平衡转化率( )与温度(T),初始压强(p)的关系如图所示。
)与温度(T),初始压强(p)的关系如图所示。
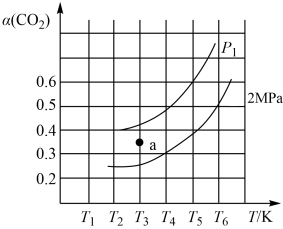
可知:压强
_________________ 2MPa(填“>”“<”或“=”);当温度为 、压强为2MPa时,a点时的v(逆)
、压强为2MPa时,a点时的v(逆)_________________ v(正)(填“>”“<”或“=”)
起始时向1L恒容容器中加入2mol 和2mol
和2mol  ,在温度为
,在温度为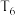 、初始压强为2MPa时反应,用压强表示该反应平衡常数的值的
、初始压强为2MPa时反应,用压强表示该反应平衡常数的值的
_____________ (分压=总压×物质的量百分数)。
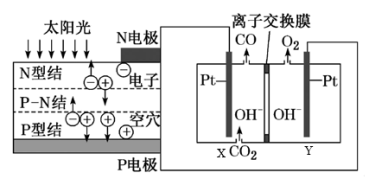
(3)图为一种可以循环利用人体呼出的 并提供
并提供 的装置,总反应方程式为
的装置,总反应方程式为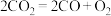 。写出阴极的电极反应:
。写出阴极的电极反应:_______________________
(1)相关的化学键键能数据如下:
化学键 | H-O | C≡O | C=O | H-H |
E/( | 463 | 1075 | 803 | 436 |


 。
。下列有利于提高CO平衡转化率的措施有
a.增大压强 b.降低温度
c.提高原料气中
 的比例 d.使用高效催化剂
的比例 d.使用高效催化剂(2)已知将
 、
、 催化重整为可用的化学品,对改善环境意义重大,某科研团队在密闭容器中进行“合成气催化重整”,反应的化学方程式为
催化重整为可用的化学品,对改善环境意义重大,某科研团队在密闭容器中进行“合成气催化重整”,反应的化学方程式为
①下列能说明该反应达到化学平衡状态的是
a.混合气体的平均相对分子质量不再变化 B.
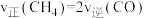
C.甲烷与氢气浓度比值不再变化 D.容器内混合气体的密度不再变化
②当投料比
 时,
时, 的平衡转化率(
的平衡转化率( )与温度(T),初始压强(p)的关系如图所示。
)与温度(T),初始压强(p)的关系如图所示。
可知:压强

 、压强为2MPa时,a点时的v(逆)
、压强为2MPa时,a点时的v(逆)起始时向1L恒容容器中加入2mol
 和2mol
和2mol  ,在温度为
,在温度为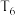 、初始压强为2MPa时反应,用压强表示该反应平衡常数的值的
、初始压强为2MPa时反应,用压强表示该反应平衡常数的值的
(3)图为一种可以循环利用人体呼出的
 并提供
并提供 的装置,总反应方程式为
的装置,总反应方程式为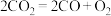 。写出阴极的电极反应:
。写出阴极的电极反应:
您最近半年使用:0次
9 . 某化学研究小组探究外界条件对化学反应速率和平衡的影响,图像如下,下列判断正确的是
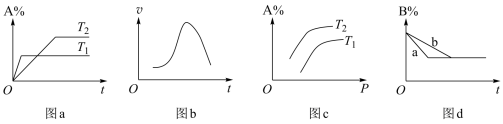

A.对于反应aA(g)+bB(g)  cC(g)ΔH1,由图a可知,T1>T2,ΔH1<0 cC(g)ΔH1,由图a可知,T1>T2,ΔH1<0 |
B.对于绝热条件下反应A(g)+B(g)  C(g)ΔH2,由图b可知,ΔH2<0 C(g)ΔH2,由图b可知,ΔH2<0 |
C.对于反应mA(g)+nB(g)  pC(g),由图c可知,m+n>p pC(g),由图c可知,m+n>p |
D.对于反应xA(g)+yB(g)  zC(g),图d中曲线a一定是使用了催化剂 zC(g),图d中曲线a一定是使用了催化剂 |
您最近半年使用:0次
名校
10 . N2H4、N2O4常用作火箭发射的推进剂。推进剂发生反应: 。下列有关说法错误的是
。下列有关说法错误的是
 。下列有关说法错误的是
。下列有关说法错误的是A.反应每生成0.3 mol N2,转移电子的数目为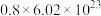 |
B.充有N2O4的密闭容器中存在: ,增大容器体积,平衡正向移动,容器内气体颜色变浅 ,增大容器体积,平衡正向移动,容器内气体颜色变浅 |
| C.碱性N2H4-空气燃料电池工作时,正极电极反应式为O2+4e-+2H2O=4OH- |
D.N2H4的电子式为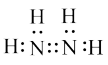 |
您最近半年使用:0次



