名校
解题方法
1 . 下列实验现象及对应得出的结论均正确的是
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | 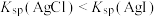 |
| B | 将浓硫酸滴到胆矾晶体表面,晶体表面出现白斑 | 浓硫酸具有吸水性 |
| C | 对平衡体系 压缩体积,混合气体的颜色变深 压缩体积,混合气体的颜色变深 | 平衡逆向移动 |
| D | 对盛有NH4Cl溶液的试管进行微热,溶液的pH增大 | 加热促进NH4Cl的水解 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
2 . 常温,利用色度计传感器检测透光率的变化以探究压强对反应体系2NO2 N2O4的影响,如图所示。已知:物质颜色越深,对光的吸收程度越大,透光率越小。下列说法错误的是
N2O4的影响,如图所示。已知:物质颜色越深,对光的吸收程度越大,透光率越小。下列说法错误的是
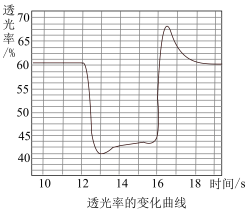
 N2O4的影响,如图所示。已知:物质颜色越深,对光的吸收程度越大,透光率越小。下列说法错误的是
N2O4的影响,如图所示。已知:物质颜色越深,对光的吸收程度越大,透光率越小。下列说法错误的是 
| A.10s时为化学平衡状态 | B.13s~16s的变化说明平衡正向移动 |
| C.16s时改变的操作是增大体系压强 | D.17s~18s中NO2的体积分数增大 |
您最近半年使用:0次
名校
3 . 硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关反应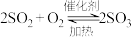 的说法中不正确的是
的说法中不正确的是
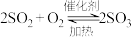 的说法中不正确的是
的说法中不正确的是A.实际生产中, 、 、 再循环使用提高原料利用率 再循环使用提高原料利用率 |
| B.实际生产中,为了提高反应速率,压强越高越好 |
C.在生产中,通入过量空气的目的是提高 的转化率 的转化率 |
| D.实际生产中,选定400~500℃作为操作温度的主要原因是催化剂的活性最高 |
您最近半年使用:0次
2023-06-08更新
|
255次组卷
|
3卷引用:广东省大埔县虎山中学等五校2022-2023学年高二上学期(11月)期中考试化学试题
名校
4 . 羰基硫(COS)能防止某些昆虫、线虫和真菌的危害。在容积不变的密闭容器中,将CO和 混合后在催化剂作用下,加热发生
混合后在催化剂作用下,加热发生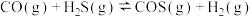 反应并达到平衡。若反应前CO的物质的量为10 mol,达到平衡时CO的物质的量为8 mol,且化学平衡常数为0.1.下列说法正确的是
反应并达到平衡。若反应前CO的物质的量为10 mol,达到平衡时CO的物质的量为8 mol,且化学平衡常数为0.1.下列说法正确的是
 混合后在催化剂作用下,加热发生
混合后在催化剂作用下,加热发生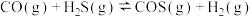 反应并达到平衡。若反应前CO的物质的量为10 mol,达到平衡时CO的物质的量为8 mol,且化学平衡常数为0.1.下列说法正确的是
反应并达到平衡。若反应前CO的物质的量为10 mol,达到平衡时CO的物质的量为8 mol,且化学平衡常数为0.1.下列说法正确的是A.反应前 的物质的量为7 mol 的物质的量为7 mol |
| B.增大压强,化学平衡正向移动 |
| C.增大CO浓度,正反应速率增大,逆反应速率减小 |
D.增大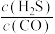 的比值,可以减小CO的转化率 的比值,可以减小CO的转化率 |
您最近半年使用:0次
名校
5 . 下列事实中,不能用勒夏特列原理解释的是
| A.开启啤酒瓶后,马上泛起大量泡沫 |
| B.在配制硫酸亚铁溶液时往往要加入少量铁粉 |
| C.实验室中常用排饱和食盐水的方法收集氯气 |
| D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
您最近半年使用:0次
名校
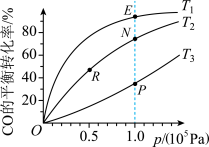
6 . 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
 CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
| A.温度:T1>T2>T3 |
| B.正反应速率:v(E)>v(P)、v(N)>v(R) |
| C.平衡常数:K(E)>K(P)、K(N)>K(R) |
| D.平均摩尔质量:M(E)>M(P)、M(N)>M(R) |
您最近半年使用:0次
2023-04-11更新
|
678次组卷
|
3卷引用:广东省梅州市梅州五校2022-2023学年高二下学期4月期中联考化学试题
名校
解题方法
7 . 向两个体积可变的密闭容器中均充入1 mol的 和2 mol的
和2 mol的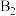 ,发生反应
,发生反应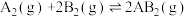
 。维持两个容器的压强分别为
。维持两个容器的压强分别为 和
和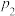 ,在不同温度下达到平衡,测得平衡时
,在不同温度下达到平衡,测得平衡时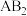 的体积分数随温度的变化如图所示。下列叙述正确的是
的体积分数随温度的变化如图所示。下列叙述正确的是
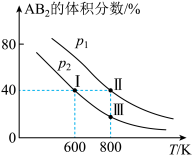
已知:图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上;
 和2 mol的
和2 mol的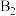 ,发生反应
,发生反应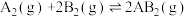
 。维持两个容器的压强分别为
。维持两个容器的压强分别为 和
和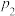 ,在不同温度下达到平衡,测得平衡时
,在不同温度下达到平衡,测得平衡时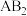 的体积分数随温度的变化如图所示。下列叙述正确的是
的体积分数随温度的变化如图所示。下列叙述正确的是
已知:图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上;
A.由图像可知, , , |
B.点Ⅰ时 的平衡转化率为40% 的平衡转化率为40% |
| C.点Ⅱ和点Ⅲ所对应的反应平衡常数相等 |
| D.将点Ⅱ所对应的容器冷却到600 K,可变成点Ⅰ |
您最近半年使用:0次
2022-12-12更新
|
236次组卷
|
2卷引用:广东省梅州市大埔县虎山中学2023届高三下学期6月模拟化学试题
名校
解题方法
8 . 反应mX(g) nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中,物质Y的体积分数随压强变化的曲线如图所示。下列说法正确的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中,物质Y的体积分数随压强变化的曲线如图所示。下列说法正确的是
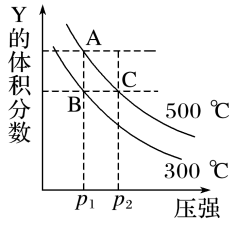
 nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中,物质Y的体积分数随压强变化的曲线如图所示。下列说法正确的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中,物质Y的体积分数随压强变化的曲线如图所示。下列说法正确的是
| A.该反应的ΔH<0 |
| B.m>n+p |
| C.A、C两点化学平衡常数:KA<KC |
| D.B、C两点的反应速率v(B)<v(C) |
您最近半年使用:0次
名校
9 . 下列操作或事实不能用勒夏特列原理解释的是
A.2NO2(g) N2O4(g) △H<0,把NO2球浸泡在冰水中,气体颜色变浅 N2O4(g) △H<0,把NO2球浸泡在冰水中,气体颜色变浅 |
| B.用饱和食盐水除去Cl2中的HCl,可减少Cl2的损失 |
C.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深 CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
| D.向含有Fe(SCN)3的红色溶液中加入铁粉,振荡,溶液颜色变浅或褪去 |
您最近半年使用:0次
2022-11-10更新
|
207次组卷
|
2卷引用:广东省梅州市大埔县虎山中学2022-2023学年高二上学期12月月考化学试题
名校
解题方法
10 . I.回答下列问题:
(1)正丁烷(C4H10)脱氢可制得1—丁烯(C4H8):①C4H10(g) C4H8(g)+H2(g) △H1
C4H8(g)+H2(g) △H1
已知:②C4H10(g)+ O2(g)
O2(g) C4H8(g)+H2O(g) △H2=-119kJ·mol-1
C4H8(g)+H2O(g) △H2=-119kJ·mol-1
③H2(g)+ O2(g)
O2(g) H2O(g) △H3=-242kJ·mol-1
H2O(g) △H3=-242kJ·mol-1
反应①的△H1为____ kJ·mol-1。
II.在容积为1.00L的恒容密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(2)反应的△H____ 0(填“>”或“<”)。
(3)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为____ mol·L-1·s-1;反应的平衡常数K为____ 。
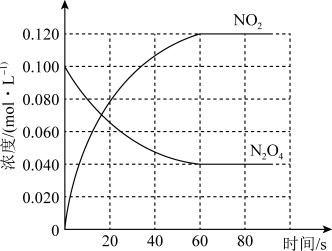
(4)2molN2O4通入1.00L的恒容密闭容器中在100℃时达平衡,在该温下提高N2O4转化率的措施有____ (写一个)。
(5)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____ (填“正反应”或“逆反应”)方向移动,判断理由是____ 。
(1)正丁烷(C4H10)脱氢可制得1—丁烯(C4H8):①C4H10(g)
 C4H8(g)+H2(g) △H1
C4H8(g)+H2(g) △H1已知:②C4H10(g)+
 O2(g)
O2(g) C4H8(g)+H2O(g) △H2=-119kJ·mol-1
C4H8(g)+H2O(g) △H2=-119kJ·mol-1③H2(g)+
 O2(g)
O2(g) H2O(g) △H3=-242kJ·mol-1
H2O(g) △H3=-242kJ·mol-1反应①的△H1为
II.在容积为1.00L的恒容密闭容器中,通入一定量的N2O4,发生反应N2O4(g)
 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:(2)反应的△H
(3)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为

(4)2molN2O4通入1.00L的恒容密闭容器中在100℃时达平衡,在该温下提高N2O4转化率的措施有
(5)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向
您最近半年使用:0次



