1 . 一定温度下,向恒容密闭容器中投入E和M发生如下反应:E(g)+M(g) F(g)
F(g) G(g)。已知反应初始c0(E)=c0(M)=0.10mol/L,部分物质的浓度(c)随时间(t)的变化关系如图所示,t2后反应体系达到平衡状态。下列说法正确的是
G(g)。已知反应初始c0(E)=c0(M)=0.10mol/L,部分物质的浓度(c)随时间(t)的变化关系如图所示,t2后反应体系达到平衡状态。下列说法正确的是
 F(g)
F(g) G(g)。已知反应初始c0(E)=c0(M)=0.10mol/L,部分物质的浓度(c)随时间(t)的变化关系如图所示,t2后反应体系达到平衡状态。下列说法正确的是
G(g)。已知反应初始c0(E)=c0(M)=0.10mol/L,部分物质的浓度(c)随时间(t)的变化关系如图所示,t2后反应体系达到平衡状态。下列说法正确的是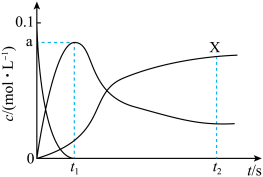
A.X为c(F)随 的变化曲线 的变化曲线 | B.0~t1内,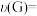 = = mol•L-1•s-1 mol•L-1•s-1 |
| C.反应的活化能:①>② | D.t2时,扩大容器的体积,n(F)减小 |
您最近半年使用:0次
23-24高二上·广东深圳·期末
名校
2 . 合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
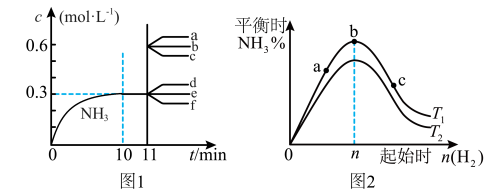
 2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
2NH3(g) ΔH<0。图1表示在2L恒容密闭容器中NH3的物质的量浓度随时间的变化曲线。图2表示在其他条件不变时,平衡时NH3的体积分数随起始时H2的物质的量的变化曲线。下列说法正确的是
| A.图1中,其他条件不变,第11min改用更为高效的催化剂,则c(NH3)-t的变化趋势为曲线b所示 |
| B.图1中,其他条件不变,第11min迅速压缩容器体积为1L,则c(NH3)-t的变化趋势为曲线a所示 |
| C.图2中,反应物N2的平衡转化率:b>a>c |
| D.图2中,T1、T2表示温度,则T1>T2 |
您最近半年使用:0次
名校
3 . Ⅰ.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。
下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500 ℃时催化剂效果最好
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
(2)分析表格数据,为了使SO2尽可能多地转化为SO3,应选择______ ℃、______ Mpa下进行实验。
(3)在实际生产中,选定的温度为400~500 ℃,原因是___
(4)在实际生产中,采用的压强为常压,原因是______
(5)在实际生产中,通入过量的空气,原因是_____
(6)尾气中SO2必须回收,原因是______
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:

已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为_____ ,CH3CH2OH(g)的体积分数为_____ %(保留一位小数)。
(8)此温度下,该反应的化学平衡常数Kp=_____ MPa-1(用平衡分压代替平衡浓度计算,列出计算式,不要求计算结果)。
 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
| A.SO2的体积分数不再变化 | B.混合物的密度不再变化 |
| C.v(SO2)=2v(O2) | D.气体的压强不再变化 |
(3)在实际生产中,选定的温度为400~500 ℃,原因是
(4)在实际生产中,采用的压强为常压,原因是
(5)在实际生产中,通入过量的空气,原因是
(6)尾气中SO2必须回收,原因是
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为
(8)此温度下,该反应的化学平衡常数Kp=
您最近半年使用:0次
名校
解题方法
4 . 2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:
i.

ii.
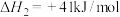
(1)研究表明,CO与 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:___________ 。
(2)上述反应在大型定容密闭容器中进行,下列说法正确的是___________。
(3)其他条件相同,仅改变容器体积,实验测得CO的平衡产率随着压强的增加而减少,可能原因是___________ 。
(4)在催化剂作用下,将 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性
选择性 的影响如下。
的影响如下。
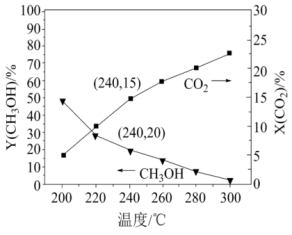
已知: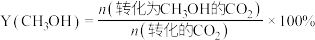
①240℃体系达到平衡时用时为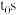 ,则
,则
___________ 
②该温度下反应ⅰ的化学平衡常数为___________ (列出计算式即可,数据用小数表示)
③在240℃达到平衡时,体系___________ (填“吸收”或“放出”)的热量为___________ kJ(除了反应ⅰ和ⅱ不考虑其他反应)。
 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:i.


ii.

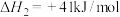
(1)研究表明,CO与
 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:(2)上述反应在大型定容密闭容器中进行,下列说法正确的是___________。
| A.反应i的活化能Ea大于反应ii |
| B.容器内压强不变时可以判断反应达到平衡 |
| C.升高温度可以提高甲醇的平衡产率 |
D.使用性能更佳的催化剂有可能提高 单位时间内的转化率 单位时间内的转化率 |
(3)其他条件相同,仅改变容器体积,实验测得CO的平衡产率随着压强的增加而减少,可能原因是
(4)在催化剂作用下,将
 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率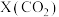 、
、 选择性
选择性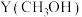 的影响如下。
的影响如下。
已知:
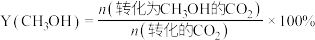
①240℃体系达到平衡时用时为
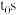 ,则
,则

②该温度下反应ⅰ的化学平衡常数为
③在240℃达到平衡时,体系
您最近半年使用:0次
名校
5 . 下列说法正确的是
A.恒温恒压,N2+3H2 2NH3达平衡时,各物质的物质的量均为1mol。再充3molN2,平衡正向移动 2NH3达平衡时,各物质的物质的量均为1mol。再充3molN2,平衡正向移动 |
| B.常温下,pH=3的醋酸与pH=3的盐酸体积比1:2混合后,混合溶液的pH=3 |
C.一定温度下的密闭容器中,发生反应2Cu2O(s)+O2(g) 4CuO(s),达平衡时压强为P0,将容器体积减小至原来的一半,达到新的平衡时气体压强为P,则P0<P<2P0 4CuO(s),达平衡时压强为P0,将容器体积减小至原来的一半,达到新的平衡时气体压强为P,则P0<P<2P0 |
D.恒温恒体积的容器,对反应2NO2(g) N2O4(g),在一定条件下达到平衡。若增加NO2的物质的量,可使再次平衡时 N2O4(g),在一定条件下达到平衡。若增加NO2的物质的量,可使再次平衡时 的值增大 的值增大 |
您最近半年使用:0次
名校
解题方法
6 . NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应: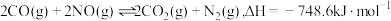 ,
, ,反应速率较小,有关该反应的说法正确的是
,反应速率较小,有关该反应的说法正确的是
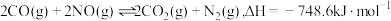 ,
, ,反应速率较小,有关该反应的说法正确的是
,反应速率较小,有关该反应的说法正确的是| A.K很大,说明NO与CO在排入大气之前就已反应完全 |
B.增大压强,反应速率增大,平衡将向右移动,K>2.5 106 106 |
| C.升高温度,既加快反应速率又可以提高有害气体的平衡转化率 |
| D.选用适宜催化剂可以使尾气排放达到标准 |
您最近半年使用:0次
2023-12-22更新
|
71次组卷
|
3卷引用:广东省深圳市罗湖高级中学2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
7 . 氮的氧化物是大气污染物之一,研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)碘蒸气的存在能大幅度提高 的分解速率,反应历程为:
的分解速率,反应历程为:
第一步: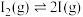 (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: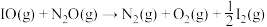 (快反应)
(快反应)
实验表明,含碘时 分解速率方程
分解速率方程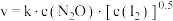 (
( 为速率常数)。下列表述正确的是___________
为速率常数)。下列表述正确的是___________
(2)对反应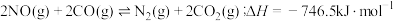 ,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
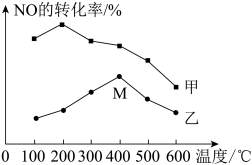
图中M点对应的速率(对应温度 )
)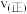
___________ 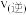 (填“>”、“<”或“=”),温度高于
(填“>”、“<”或“=”),温度高于 ,NO转化率降低的原因可能是
,NO转化率降低的原因可能是___________ 。
(3)在密闭容器中充入 和
和 ,发生反应:
,发生反应: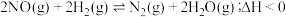 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。

①下列物理量中,图中d点大于b点的是___________ (填字母)。
A.正反应速率 B.逆反应速率
C. 的浓度 D.对应温度的平衡常数
的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为___________ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的___________ 点。
(4) 时,向容积为2L的恒容容器中充入
时,向容积为2L的恒容容器中充入 、
、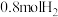 ,发生反应:
,发生反应: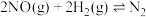
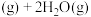 ,体系的总压强P随时间t的变化如下表所示:
,体系的总压强P随时间t的变化如下表所示:
①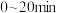 内该反应的平均反应速率
内该反应的平均反应速率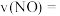
___________  。
。
②该温度下反应的平衡常数
___________  (用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(1)碘蒸气的存在能大幅度提高
 的分解速率,反应历程为:
的分解速率,反应历程为:第一步:
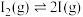 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)第三步:
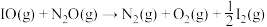 (快反应)
(快反应)实验表明,含碘时
 分解速率方程
分解速率方程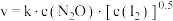 (
( 为速率常数)。下列表述正确的是___________
为速率常数)。下列表述正确的是___________| A.升高温度,第一步向右进行的程度变大 |
| B.第二步的活化能比第三步小 |
C. 为反应的催化剂 为反应的催化剂 |
D. 分解反应的速率与是否含碘蒸气有关 分解反应的速率与是否含碘蒸气有关 |
(2)对反应
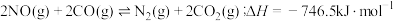 ,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
图中M点对应的速率(对应温度
 )
)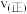
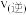 (填“>”、“<”或“=”),温度高于
(填“>”、“<”或“=”),温度高于 ,NO转化率降低的原因可能是
,NO转化率降低的原因可能是(3)在密闭容器中充入
 和
和 ,发生反应:
,发生反应: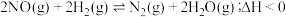 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
①下列物理量中,图中d点大于b点的是
A.正反应速率 B.逆反应速率
C.
 的浓度 D.对应温度的平衡常数
的浓度 D.对应温度的平衡常数②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的
(4)
 时,向容积为2L的恒容容器中充入
时,向容积为2L的恒容容器中充入 、
、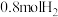 ,发生反应:
,发生反应: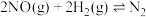
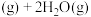 ,体系的总压强P随时间t的变化如下表所示:
,体系的总压强P随时间t的变化如下表所示: | 0 | 10 | 20 | 30 | 40 |
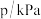 | 240 | 226 | 216 | 210 | 210 |
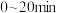 内该反应的平均反应速率
内该反应的平均反应速率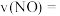
 。
。②该温度下反应的平衡常数

 (用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
您最近半年使用:0次
2023-12-18更新
|
162次组卷
|
2卷引用:广东省深圳市实验学校高中部2023-2024学年高二上学期第三阶段考试化学试题
名校
8 . 下列措施中,一定能使化学平衡移动的是
| A.改变某一反应物的投料 | B.改变压强 | C.使用催化剂 | D.改变温度 |
您最近半年使用:0次
名校
9 . 在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.50mol•L﹣1,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol•L﹣1,下列有关判断正确的是
| A.x+y<z | B.平衡向正反应方向移动 |
| C.B的转化率增大 | D.C的体积分数下降 |
您最近半年使用:0次
2023-09-22更新
|
221次组卷
|
75卷引用:广东省深圳市光明区高级中学2023-2024学年高二上学期10月月考化学试题
广东省深圳市光明区高级中学2023-2024学年高二上学期10月月考化学试题(已下线)2011-2012学年陕西省宝鸡中学高二下学期期中考试化学试题(已下线)2013届江西省丰城中学高三阶段测试化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷2015-2016学年湖北省宜昌葛洲坝中学高二上学期期中测试化学试卷2016届辽宁师范大学附属中学高三上学期期中考试化学试卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高二上期末化学卷2016届河南省信阳市鸡公山风景区学校高三下2月月考化学试卷2017届黑龙江牡丹江高级中学高三上期中化学卷云南省玉溪市第一中学2016-2017学年高二下学期期中考试化学试题广西桂林市第十八中学2016-2017学年高二下学期期中考试化学试题辽宁省庄河市高级中学2017-2018学年高二10月月考化学试题广东省阳东广雅学校2017-2018学年高二10月月考化学试题山西省运城中学、芮城中学2017-2018学年高二上学期期中联考化学试题内蒙古包头市第一中学2017-2018学年高二上学期期中考试化学试题陕西省西安市“八校”2018届高三联考化学试题【全国百强校】河北省武邑中学2019届高三上学期期中考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题辽宁省本溪市第一中学2018-2019学年高二上学期期末考试化学试题【区级联考】上海市黄浦区2019届高三第一学期期末(一模)学科质量检测化学试题【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期期中考试化学试题1重庆市万州二中2019-2020学年高二上学期入学考试化学试题重庆市万州第二高级中学2019-2020学年高二入学考试化学试题安徽省铜陵市第一中学2019-2020学年高二上学期期中考试化学试题四川省广元川师大万达中学2019-2020学年高二上学期期中考试化学试题安徽省合肥市六校2019-2020学年高二上学期期末考试化学(理)试题湖南省益阳市2019-2020学年高二上学期期末统考化学试题内蒙古包头市第六中学2019-2020学年高二上学期期中考试化学试题四川省广元市剑门关中学2019-2020学年高二上学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题湖北省黄冈市黄梅国际育才高级中学2018-2019学年高二下学期3月月考化学试题安徽省六安市第一中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时2 反应条件对化学平衡的影响高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)上海市行知中学2019-2020学年高三上学期期中考化学试题(已下线)2.3.1化学平衡状态(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期实验班第一次月考化学试题湖南省邵东县第一中学2020-2021学年高二上学期第一次月考化学试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题山西省运城市景胜中学2020-2021学年高二10月月考化学试题黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题河南省洛阳市新安县第一高级中学2020-2021学年高二10月月考化学试题内蒙古自治区包头市第六中学2020-2021学年高二上学期期中考试化学试题贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题重庆市石柱中学2020-2021学年高二上学期第一次月考化学试题选择性必修1 专题2 第三单元 课时1 影响化学平衡的因素黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题广西南宁市宾阳县宾阳中学2021-2022学年高二上学期期中考试化学(理科)试题吉林省长春市东北师大附中2021-2022学年高二上学期阶段测试化学试题辽宁省大连市2021-2022学年高三上学期双基测试化学试题辽宁省大连市2021-2022学年高二上学期期末联考化学试题山东省菏泽市2021-2022学年高二上学期期末教学质量检测化学试题(已下线)二轮拔高卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)重庆市缙云教育联盟2022届高三第二次诊断性检测化学试题(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)上海市宜川中学2021-2022学年高一下学期期末考试化学试题湖南省益阳市2022-2023学年高三上学期 9月质量检测化学试题北京市第三十一中学2021-2022学年高二上学期期中考试化学试题湖南省祁东县育贤中学2022-2023学年高二上学期第一次月考化学试题湖南省益阳市2020-2021学年高二上学期期末考试化学试题陕西师范大学附属中学2022-2023学年高一下学期6月期末考试化学试题河北省昌黎第一中学2023届高三下学期第七次调研考试化学试题山东省菏泽第一中学2022-2023学年高二上学期期末考试模拟检测化学试题(已下线)第2讲 化学平衡状态及化学平衡的移动北京市东直门中学2022-2023学年高二上学期期中考试化学试题云南省中央民族大学附属中学昆明五华实验学校2023-2024学年高二上学期期中考试化学试题四川省绵阳南山实验中学2023-2024学年高二上学期期中考试化学试题北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷四川省广安市华蓥中学2023-2024学年高二上学期11月月考化学试题2023-2024学年高二化学下学期月考1试卷 四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题陕西省宝鸡市扶风县法门高中2023-2024学年高二上学期期中考试化学试题贵州神贵阳市2023-2024学年清镇市博雅实验学校高二上学期第四次月考化学试卷
10 . 从下列实验事实所得出的现象解释或结论错误的是
| 选项 | 实验事实 | 现象解释或结论 |
| A | 将0.1mol/L5mL的Na2S2O3溶液和0.1mol/L5mL的H2SO4溶液混合后平均分装在2支试管中,一支放入冷水中,另一支放入热水中 | 放置在热水的试管中的溶液先出现浑浊,说明升高温度,化学反应速率会加快 |
| B | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| C | 压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 | 颜色先变深是浓度变大的原因,后变浅是压强变化对化学平衡的影响 |
| D | 向2mL0.1mol/L的FeCl3溶液中加入1滴KSCN溶液变为红色后,再加入少量KCl固体 | 溶液红色变浅,说明增大生成物浓度会使平衡逆向移动 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-09-10更新
|
360次组卷
|
4卷引用:广东省深圳外国语学校高中园2023-2024学年高二上学期第一学段(一)考试化学试题



