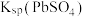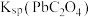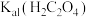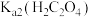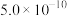名校
1 . 下列方案设计、现象和结论都正确的是
| 编号 | 实验目的 | 方案设计 | 现象与结论 |
| A | 比较 与 与 的酸性强弱 的酸性强弱 | 分别测 、 、 两饱和溶液的 两饱和溶液的 |  溶液 溶液 小,则酸性 小,则酸性 |
| B | 验证 溶液中存在水解平衡 溶液中存在水解平衡 | 往含有酚酞 溶液中加入少量 溶液中加入少量 晶体 晶体 | 溶液红色变浅,则 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 比较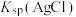 与 与 的大小 的大小 | 向足量 溶液中先加入少量 溶液中先加入少量 溶液,再加入 溶液,再加入 溶液 溶液 | 先生成白色沉淀,再生成淡黄色沉淀,则 |
| D | 探究压强对化学平衡的影响 | 快速压缩装有 、 、 平衡混合气体的针筒活塞 平衡混合气体的针筒活塞 | 平衡后气体颜色变深,则增大压强,平衡向生成 的方向移动 的方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪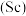 是一种稀土金属,钛尾矿经一系列处理后得到固体
是一种稀土金属,钛尾矿经一系列处理后得到固体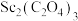 和主要成分是
和主要成分是 的废水,利用钛尾矿回收金属钪和草酸的工艺流程如图所示。回答下列问题:
的废水,利用钛尾矿回收金属钪和草酸的工艺流程如图所示。回答下列问题: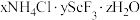 是“沉钪”过程中
是“沉钪”过程中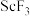 与氯化物形成的复盐沉淀,在强酸中部分溶解。
与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③ 时,部分物质的相关信息如表所示:
时,部分物质的相关信息如表所示:
(1)“焙烧”时将固体粉碎的目的为________________ 。
(2)“焙烧”过程中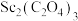 生成
生成 的化学方程式为
的化学方程式为_________________ 。
(3)“脱水除铵”过程中固体质量与温度的关系如图所示,其中在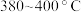 过程中会有白烟冒出,保温至无烟气产生,由图中数据可得
过程中会有白烟冒出,保温至无烟气产生,由图中数据可得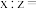
_______ 。

(4)传统制备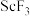 的方法是先得到
的方法是先得到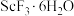 沉淀,再高温脱水得
沉淀,再高温脱水得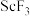 ,但通常含有
,但通常含有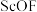 杂质,原因是
杂质,原因是_______________ (用化学方程式表示)。流程中“沉钪”后“脱水除铵”可制得纯度很高的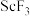 ,其原因是
,其原因是____________ 。
(5)将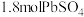 加到
加到 含有
含有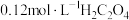 的废水中,发生的离子反应为
的废水中,发生的离子反应为 ,该反应的平衡常数的值
,该反应的平衡常数的值
________ 。
(6)滤饼经较浓硫酸处理后的“沉淀”是_______ (化学式)。
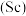 是一种稀土金属,钛尾矿经一系列处理后得到固体
是一种稀土金属,钛尾矿经一系列处理后得到固体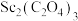 和主要成分是
和主要成分是 的废水,利用钛尾矿回收金属钪和草酸的工艺流程如图所示。回答下列问题:
的废水,利用钛尾矿回收金属钪和草酸的工艺流程如图所示。回答下列问题: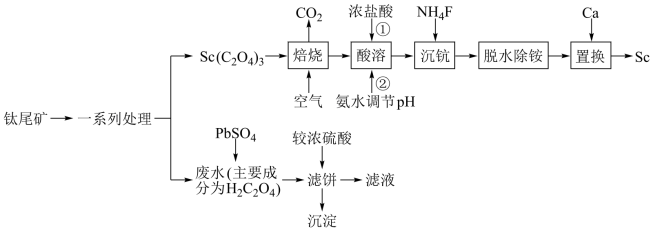
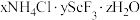 是“沉钪”过程中
是“沉钪”过程中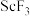 与氯化物形成的复盐沉淀,在强酸中部分溶解。
与氯化物形成的复盐沉淀,在强酸中部分溶解。②“脱水除铵”是复盐沉淀的热分解过程。
③
 时,部分物质的相关信息如表所示:
时,部分物质的相关信息如表所示:
|
|
|
|
|
|
|
|
(1)“焙烧”时将固体粉碎的目的为
(2)“焙烧”过程中
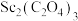 生成
生成 的化学方程式为
的化学方程式为(3)“脱水除铵”过程中固体质量与温度的关系如图所示,其中在
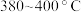 过程中会有白烟冒出,保温至无烟气产生,由图中数据可得
过程中会有白烟冒出,保温至无烟气产生,由图中数据可得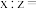

(4)传统制备
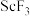 的方法是先得到
的方法是先得到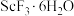 沉淀,再高温脱水得
沉淀,再高温脱水得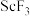 ,但通常含有
,但通常含有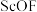 杂质,原因是
杂质,原因是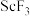 ,其原因是
,其原因是(5)将
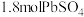 加到
加到 含有
含有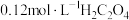 的废水中,发生的离子反应为
的废水中,发生的离子反应为 ,该反应的平衡常数的值
,该反应的平衡常数的值
(6)滤饼经较浓硫酸处理后的“沉淀”是
您最近一年使用:0次
3 . 一种利用配合物消除氮氧化物污染的反应为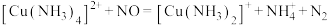
 。设
。设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
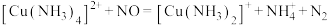
 。设
。设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是A.键角: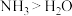 |
B.1mol 中含有 中含有 键的数目为 键的数目为 |
C.同温下 的数目:1L0.5mol/L 的数目:1L0.5mol/L 溶液>2L0.25mol/L 溶液>2L0.25mol/L 溶液 溶液 |
D.标准状况下,每生成22.4L ,该反应转移电子数为 ,该反应转移电子数为 |
您最近一年使用:0次
解题方法
4 . 二氧化锗常用作有机反应的催化剂以及制备半导体的原料。某大型化工厂提纯二氧化锗废料(主要含GeO2、AS2O3)的工艺如图,下列有关说法正确的是
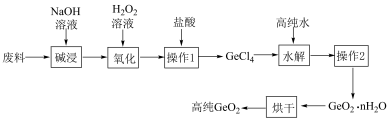
已知:①GeO2与碱反应生成Na2GeO3;AS2O3与碱反应生成NaASO2;
②GeCl4的熔点−49.5℃,沸点为85℃,极易发生水解

已知:①GeO2与碱反应生成Na2GeO3;AS2O3与碱反应生成NaASO2;
②GeCl4的熔点−49.5℃,沸点为85℃,极易发生水解
| A.Ge在周期表中位于第四周期第ⅥA族 |
B.“氧化”时,离子反应为ASO +H2O2+2OH-=ASO +H2O2+2OH-=ASO +2H2O +2H2O |
| C.“操作1”是蒸馏,“操作2”所用仪器主要为玻璃棒、漏斗、烧杯 |
| D.“操作1”加入的盐酸为7mol/L,若改成1mol/L可节省原料同时不影响产率 |
您最近一年使用:0次
名校
5 . 25℃时部分弱酸的电离平衡常数如下表:
1.室温下① ②
② ③
③ ④
④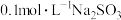 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)_____ 。
2.下列离子方程式书写正确的是
| 弱酸 |  |  |  |  |
| 电离平衡常数 |  | 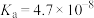 |   | 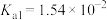  |
 ②
② ③
③ ④
④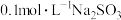 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)2.下列离子方程式书写正确的是
A.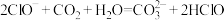 |
B. |
C. |
D. |
您最近一年使用:0次
6 .  催化剂可以催化
催化剂可以催化 脱除烟气中的
脱除烟气中的 ,主反应为:
,主反应为: ;已知:偏钒酸铵
;已知:偏钒酸铵 本身在水中溶解度不大,草酸
本身在水中溶解度不大,草酸 能与含钒粒子形成易溶于水的物质。
能与含钒粒子形成易溶于水的物质。
(1)催化剂的制备。分别称取定量的 与
与 混合,加入草酸溶液,在
混合,加入草酸溶液,在 水浴下加热搅拌至完全溶解,加入一定量的
水浴下加热搅拌至完全溶解,加入一定量的 粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到
粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到 催化剂。加入草酸的作用是
催化剂。加入草酸的作用是__________ 。
(2)催化剂的使用。在脱硝过程中,若烟气中含有 ,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是
,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是__________ 。
(3)催化剂的回收。通过如下工艺流程可以回收其中的金属。
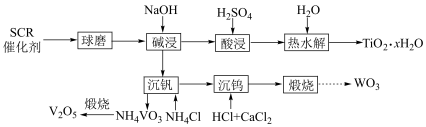
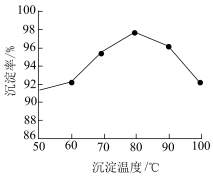
①该流程中钒以 的形式沉淀出来。沉钒率是指
的形式沉淀出来。沉钒率是指 沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过
沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过 时,沉钒率下降的可能原因是
时,沉钒率下降的可能原因是__________ 。(写一条即可)
②“酸浸”后钛主要以 形式存在,“热水解”反应的离子方程式为
形式存在,“热水解”反应的离子方程式为__________ 。
③煅烧 的化学方程式为
的化学方程式为__________ 。
④为测定回收所得 样品的纯度,进行如下实验:称取
样品的纯度,进行如下实验:称取 灼烧后的样品,用稀硫酸溶解、定容得到
灼烧后的样品,用稀硫酸溶解、定容得到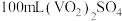 溶液。量取
溶液。量取 溶液放入锥形瓶中,加入过量的
溶液放入锥形瓶中,加入过量的 溶液,再用
溶液,再用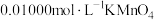 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。已知:
。已知: ;
;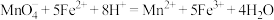 。计算
。计算 样品的纯度(写出计算过程)
样品的纯度(写出计算过程)__________ 。
 催化剂可以催化
催化剂可以催化 脱除烟气中的
脱除烟气中的 ,主反应为:
,主反应为: ;已知:偏钒酸铵
;已知:偏钒酸铵 本身在水中溶解度不大,草酸
本身在水中溶解度不大,草酸 能与含钒粒子形成易溶于水的物质。
能与含钒粒子形成易溶于水的物质。(1)催化剂的制备。分别称取定量的
 与
与 混合,加入草酸溶液,在
混合,加入草酸溶液,在 水浴下加热搅拌至完全溶解,加入一定量的
水浴下加热搅拌至完全溶解,加入一定量的 粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到
粉末于上述混合溶液中进行浸渍处理,经过滤、焙烧、研磨后即可得到 催化剂。加入草酸的作用是
催化剂。加入草酸的作用是(2)催化剂的使用。在脱硝过程中,若烟气中含有
 ,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是
,一旦低于可运行的最低温度时会导致催化剂活性下降,原因可能是(3)催化剂的回收。通过如下工艺流程可以回收其中的金属。

①该流程中钒以
 的形式沉淀出来。沉钒率是指
的形式沉淀出来。沉钒率是指 沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过
沉淀中V元素的质量和废催化剂中V元素的质量之比。沉钒率随温度的变化曲线如题图,温度超过 时,沉钒率下降的可能原因是
时,沉钒率下降的可能原因是
②“酸浸”后钛主要以
 形式存在,“热水解”反应的离子方程式为
形式存在,“热水解”反应的离子方程式为③煅烧
 的化学方程式为
的化学方程式为④为测定回收所得
 样品的纯度,进行如下实验:称取
样品的纯度,进行如下实验:称取 灼烧后的样品,用稀硫酸溶解、定容得到
灼烧后的样品,用稀硫酸溶解、定容得到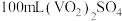 溶液。量取
溶液。量取 溶液放入锥形瓶中,加入过量的
溶液放入锥形瓶中,加入过量的 溶液,再用
溶液,再用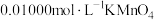 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 。已知:
。已知: ;
;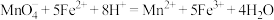 。计算
。计算 样品的纯度(写出计算过程)
样品的纯度(写出计算过程)
您最近一年使用:0次
解题方法
7 . 为探究 与
与 溶液能否发生氧化还原反应,设计了如下装置:闭合K一段时间后,观察到Y电极表面有银白色物质析出。下列说法正确的是
溶液能否发生氧化还原反应,设计了如下装置:闭合K一段时间后,观察到Y电极表面有银白色物质析出。下列说法正确的是
 与
与 溶液能否发生氧化还原反应,设计了如下装置:闭合K一段时间后,观察到Y电极表面有银白色物质析出。下列说法正确的是
溶液能否发生氧化还原反应,设计了如下装置:闭合K一段时间后,观察到Y电极表面有银白色物质析出。下列说法正确的是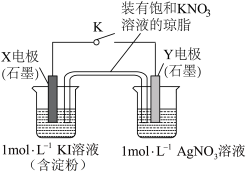
| A.Y电极为阴极 | B.右侧烧杯中 经盐桥移向左侧烧杯 经盐桥移向左侧烧杯 |
C.闭合K后右侧烧杯中溶液 不断升高 不断升高 | D.若将X电极换成 ,实验现象不变 ,实验现象不变 |
您最近一年使用:0次
名校
8 . 常温下,CH3COONa溶液和NaHCO3溶液的浓度与pH的关系如图所示。已知a为CH3COONa溶液和NaHCO3溶液的交点。下列说法错误的是
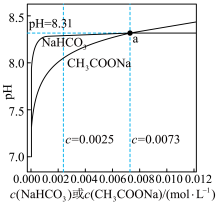
| A.c(NaHCO3)>0.0025mol·L-1时,其溶液的pH基本不变 |
| B.浓度越大CH3COONa溶液的碱性越强,是因为CH3COONa的水解程度随浓度的增大而增大 |
| C.a点CH3COONa溶液中的c(CH3COOH)小于NaHCO3溶液中的c(H2CO3) |
D.0.01mol·L-1的NaHCO3溶液中,满足c(Na+)>c( )>c(H2CO3)>c( )>c(H2CO3)>c( ) ) |
您最近一年使用:0次
2024-04-02更新
|
74次组卷
|
2卷引用:河北省石家庄市第十七中学2023-202424学年高三下学期3月月考化学试题
名校
9 . H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。
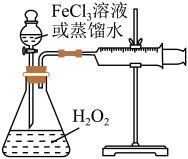
(1)①写出锥形瓶中反应的化学方程式________ 。
②设计实验方案:在不同条件下,测定_______ 。(要求所测得的数据能直接体现反应速率大小)
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
①表格中a=_______ ,b=________ 。
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是________ 。
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为_______ 。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴_______ 溶液,产生蓝色沉淀。
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因______ 。

(1)①写出锥形瓶中反应的化学方程式
②设计实验方案:在不同条件下,测定
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
| 实验序号 | 10%H2O2/mL | 蒸馏水/mL | 0.2mol·LFeCl3溶液/mL | 现象 |
| I | 10 | a | 0 | 无明显变化 |
| Ⅱ | 10 | b | 2 | 锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅 |
| Ⅲ | 5 | 5 | 2 | 锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快 |
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因
您最近一年使用:0次
10 . 实验室制备 并对其进行性质探究
并对其进行性质探究
I.制备 (无水
(无水 易潮解,加热易升华)
易潮解,加热易升华)
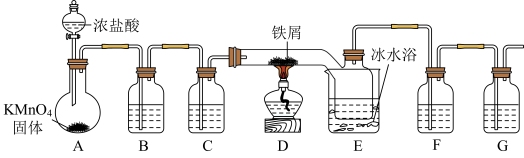
(1)A为氯气发生装置,A中的反应方程式是_______ (锰被还原为 )。
)。
(2)B中试剂的用途是_______ ;C中试剂是_______ ;F中的试剂是_______ 。
II.探究性质
将制得FeCl3的配成0.1molFeCl3溶液,进行实验ii和实验iii。
(3)实验ii:将酸化的5mL0.1mol/L 溶液与2mL0.1mol/L
溶液与2mL0.1mol/L 溶液混合,得到红色溶液(
溶液混合,得到红色溶液( 与
与 可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是
可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是_______ 。
(4)结合化学方程式,解释a中的实验现象_______ 。
(5)对b的现象进行探究。推测灼烧时,导出的气体是_______ 。
(6)将c黑色固体溶于浓盐酸,无气泡产生,小组同学判断黑色固体中含有正二价铁,其理由是_______ 。
 并对其进行性质探究
并对其进行性质探究I.制备
 (无水
(无水 易潮解,加热易升华)
易潮解,加热易升华)
(1)A为氯气发生装置,A中的反应方程式是
 )。
)。(2)B中试剂的用途是
II.探究性质
将制得FeCl3的配成0.1molFeCl3溶液,进行实验ii和实验iii。
(3)实验ii:将酸化的5mL0.1mol/L
 溶液与2mL0.1mol/L
溶液与2mL0.1mol/L 溶液混合,得到红色溶液(
溶液混合,得到红色溶液( 与
与 可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是
可以形成红色配离子),一段时间后红色褪去。溶液褪色的原因是| 实验ⅲ | 操作 | 序号 | 现象 |
 | a | 蒸发时,试管内有白雾 | |
| b | 灼烧时,导出的气体可以使NaBr溶液变黄 | ||
| c | 最终,试管底部留有黑色固体 |
(4)结合化学方程式,解释a中的实验现象
(5)对b的现象进行探究。推测灼烧时,导出的气体是
(6)将c黑色固体溶于浓盐酸,无气泡产生,小组同学判断黑色固体中含有正二价铁,其理由是
您最近一年使用:0次