名校
解题方法
1 . 剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表,下列选项正确的是
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.77×10-4 | K a=5.0×10-10 | K a1=4.3×10-7,Ka2=5.6×10-11 |
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2=2HCN+CO |
| B.处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) |
| C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者 |
| D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
您最近一年使用:0次
2 . 氧化铍(BeO) 广泛用于原子能、宇航等领域。一种以铍矿石 (主要成分为Be2SiO4,少量MnO等)为原料提取氧化铍的工艺流程如图所示。
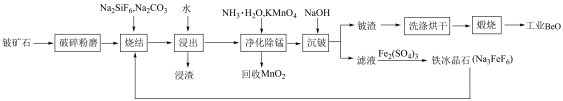
已知:烧结时,未发生氧化还原反应:烧结后,Be、Mn元素以可溶性的Na2BeF4、Na2MnF4形式存在,其余元素以稳定氧化物的形式存在。
回答下列问题:
(1)“烧结”前,将铍矿石“破碎粉磨”的目的是______ 。
(2)“浸渣”的成分为_____ (填化学式)。
(3)“净化除锰”步骤的离子反应方程式为_____________ 。
(4)“沉铍”时,先加入足量NaOH溶液,得到含铍粒子是________ (填粒子符号), 再加热煮沸,调节pH=11,得到颗粒状Be(OH)2。从化学平衡移动的角度解释上述反应原理__________ 。
(5)铁冰晶石(Na3FeF6) 晶体中存在的作用力有__________ ,Fe'+ 的杂化方式是____ (填标号)。
A.dsp2 B.sp3d2 C.sp2 D.sp3

已知:烧结时,未发生氧化还原反应:烧结后,Be、Mn元素以可溶性的Na2BeF4、Na2MnF4形式存在,其余元素以稳定氧化物的形式存在。
回答下列问题:
(1)“烧结”前,将铍矿石“破碎粉磨”的目的是
(2)“浸渣”的成分为
(3)“净化除锰”步骤的离子反应方程式为
(4)“沉铍”时,先加入足量NaOH溶液,得到含铍粒子是
(5)铁冰晶石(Na3FeF6) 晶体中存在的作用力有
A.dsp2 B.sp3d2 C.sp2 D.sp3
您最近一年使用:0次
解题方法
3 . 硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂、媒染剂。常温下该物质在空气中会水解,受热时易分解。以废铜屑(表面沾有油污)为原料制备([Cu(NH3)4]SO4·H2O)的实验步骤如下:
I、CuSO4的制备

(1)步骤①中采取“碱煮水洗”,目的是___________ 。
(2)步骤②在常温下进行,需要加入的试剂是___________ 。
Ⅱ、晶体的制备
将上述制备的CuSO4溶液加入装置A中,滴加6mol·L-1氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色[Cu(NH3)4]SO4溶液。将A中溶液转移至B中,析出([Cu(NH3)4]SO4·H2O)晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。。
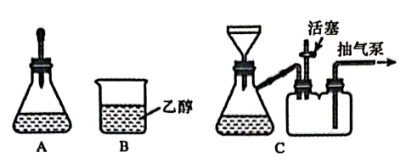
(3)用离子方程式表示装置A中“沉淀消失”的原因___________ 。
(4)抽滤时,抽气泵处于工作状态,活塞需___________ (填“打开”或“关闭”),作用是___________ 。
(5)晶体采用冷风吹干而不用加热烘干的原因是___________ 。
Ⅲ废液回收
减压过滤后的废液中含有[Cu(NH3)4]SO4、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液。
(6)向废液中加入硫酸的作用是___________ 。(答出两条)
(7)(NH4)2SO4溶液受热易分解,则回收乙醇的实验方法为___________ 。
I、CuSO4的制备

(1)步骤①中采取“碱煮水洗”,目的是
(2)步骤②在常温下进行,需要加入的试剂是
Ⅱ、晶体的制备
将上述制备的CuSO4溶液加入装置A中,滴加6mol·L-1氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色[Cu(NH3)4]SO4溶液。将A中溶液转移至B中,析出([Cu(NH3)4]SO4·H2O)晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。。

(3)用离子方程式表示装置A中“沉淀消失”的原因
(4)抽滤时,抽气泵处于工作状态,活塞需
(5)晶体采用冷风吹干而不用加热烘干的原因是
Ⅲ废液回收
减压过滤后的废液中含有[Cu(NH3)4]SO4、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液。
(6)向废液中加入硫酸的作用是
(7)(NH4)2SO4溶液受热易分解,则回收乙醇的实验方法为
您最近一年使用:0次
4 . Mn3O4可用作电子计算机中存储信息的磁芯、磁盘等。常温下,以软锰矿(主要成分是MnO2,还含有少量的Fe2O3、Al2O3)为原料制备Mn3O4 的工艺流程如图所示。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸”后的浸取液中,锰、铁以Mn2+、Fe2+的形式存在, MnO2参加反应的离子方程式为______ 。
(2)①“调pH”的范围为_______ 。该过程中,加入H2O2发生反应的离子方程式为______ ;X试剂最适宜的是_______ (填字母)。
a.氨水 b. CaO固体
c. MnCO3 d. MnO2
②若用Mn+表示浸取液中的金属离子,结合化学用语用平衡移动原理解释形成滤渣1的原因:_____ 。
(3)“沉锰”时,为了加快沉锰的反应速率,可升高反应温度,当温度达到50° C后,随着温度升高,Mn2+的沉淀率会降低,其可能原因是_______ 。
(4)“沉锰”后的滤液2中存在的主要阳离子是_______ 。(填离子符号)。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀的pH | 2.1 | 7.0 | 3.5 | 8.2 |
| 完全沉淀的pH | 3.4 | 8.3 | 4.6 | 10.2 |
(1)“酸浸”后的浸取液中,锰、铁以Mn2+、Fe2+的形式存在, MnO2参加反应的离子方程式为
(2)①“调pH”的范围为
a.氨水 b. CaO固体
c. MnCO3 d. MnO2
②若用Mn+表示浸取液中的金属离子,结合化学用语用平衡移动原理解释形成滤渣1的原因:
(3)“沉锰”时,为了加快沉锰的反应速率,可升高反应温度,当温度达到50° C后,随着温度升高,Mn2+的沉淀率会降低,其可能原因是
(4)“沉锰”后的滤液2中存在的主要阳离子是
您最近一年使用:0次
解题方法
5 . 下列实验操作和现象正确,且所得到的结论也正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 取适量H2O2溶液于试管中,滴入Fe2(SO4)3溶液,振荡,观察现象 | 产生气体使带火星木条复燃 | Fe3+的氧化性强于H2O2 |
| B | 向试管加入2mL1mol•L-1MgCl2溶液,滴加2mL1mol•L-1NaOH溶液,再滴加几滴1mol•L-1CuCl2,观察现象 | 产生白色白色沉淀,后产生蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| C | 将溴乙烷和NaOH的乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| D | 向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液 | 溶液红色逐渐褪去 | BaCl2溶液呈酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 将煤液化得到的甲醇是重要的化工原料。下图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
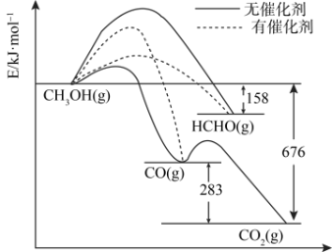
(1)在有催化剂作用下,CH3OH与O2反应主要生成___________ (填“CO”、“CO2”或HCHO”)。请补全热化学方程式HCHO(g)+1/2O2(g)=CO(g)+H2O(g)___________ 。
(2)请从有效碰撞理论的角度说明加入催化剂可以加快化学反应速率的原因:___________ 。
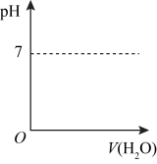
(3)HCHO可进一步被氧化为重要工业原料HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化___________ 。

(1)在有催化剂作用下,CH3OH与O2反应主要生成
(2)请从有效碰撞理论的角度说明加入催化剂可以加快化学反应速率的原因:
(3)HCHO可进一步被氧化为重要工业原料HCOOH(其酸性比H2SO3弱,比CH3COOH强)。在下图中画出常温下向甲酸钠溶液中加水时溶液的pH的变化

您最近一年使用:0次
名校
解题方法
7 . 碳及其化合物是重要的化工原料,但对气候环境造成不良影响,需要综合利用。
(1)工业上利用如下反应制 :
:
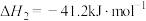 。
。
①在不同进气比和不同温度下(其他条件相同),测得相应的CO平衡转化率见表。
a点平衡混合物中 的体积分数
的体积分数___________ (保留3位有效数字),a、c两点对应的反应温度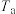
___________  (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
②若在恒容绝热的密闭容器中通入一定量的CO和 发生此反应,下列说法表示该反应达到最大限度的是
发生此反应,下列说法表示该反应达到最大限度的是___________ (填标号)。
a.装置内的气体无CO b.装置内的压强不再变化
c. 的体积分数不变 d.装置内气体摩尔质量不变
的体积分数不变 d.装置内气体摩尔质量不变
③一定温度下,在3L容积可变的密闭容器中发生该反应,已知 随时间
随时间 的变化曲线a如图1所示,在
的变化曲线a如图1所示,在 时刻改变一个条件,曲线a变为b,则改变的条件是
时刻改变一个条件,曲线a变为b,则改变的条件是___________ 。

(2)烷可用于制备合成气:
 。将
。将 和
和 以物质的量之比为
以物质的量之比为 充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(
)与温度( )的关系如图2所示。
)的关系如图2所示。 ℃时,CO的体积分数最大的原因为
℃时,CO的体积分数最大的原因为___________ 。
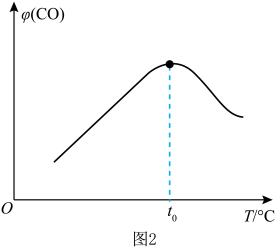
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图3所示。阳极的电极反应式为___________ 。
(4)工业废气中的 可用氨水捕获生成
可用氨水捕获生成 溶液。常温下
溶液。常温下 溶液中:
溶液中:
___________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);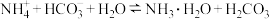 的平衡常数
的平衡常数
___________ 。(已知常温下 的电离平衡常数
的电离平衡常数 ,
, 的电离平衡常数
的电离平衡常数 ,
, )
)
(1)工业上利用如下反应制
 :
:
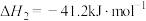 。
。①在不同进气比和不同温度下(其他条件相同),测得相应的CO平衡转化率见表。
| 平衡点 | a | b | c |
 | 0.5 | 0.5 | 1 |
| CO平衡转化率/% | 50 | 66.7 | 50 |
a点平衡混合物中
 的体积分数
的体积分数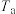
 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。②若在恒容绝热的密闭容器中通入一定量的CO和
 发生此反应,下列说法表示该反应达到最大限度的是
发生此反应,下列说法表示该反应达到最大限度的是a.装置内的气体无CO b.装置内的压强不再变化
c.
 的体积分数不变 d.装置内气体摩尔质量不变
的体积分数不变 d.装置内气体摩尔质量不变③一定温度下,在3L容积可变的密闭容器中发生该反应,已知
 随时间
随时间 的变化曲线a如图1所示,在
的变化曲线a如图1所示,在 时刻改变一个条件,曲线a变为b,则改变的条件是
时刻改变一个条件,曲线a变为b,则改变的条件是
(2)烷可用于制备合成气:

 。将
。将 和
和 以物质的量之比为
以物质的量之比为 充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(
)与温度( )的关系如图2所示。
)的关系如图2所示。 ℃时,CO的体积分数最大的原因为
℃时,CO的体积分数最大的原因为
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图3所示。阳极的电极反应式为

(4)工业废气中的
 可用氨水捕获生成
可用氨水捕获生成 溶液。常温下
溶液。常温下 溶液中:
溶液中:
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);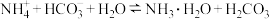 的平衡常数
的平衡常数
 的电离平衡常数
的电离平衡常数 ,
, 的电离平衡常数
的电离平衡常数 ,
, )
)
您最近一年使用:0次
名校
8 . 氯化铵( )易溶于水,微溶于乙醇,是一种常见的化肥,也可用于制造干电池。25℃时,
)易溶于水,微溶于乙醇,是一种常见的化肥,也可用于制造干电池。25℃时, ,
,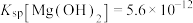 。
。
回答下列问题:
(1) 是侯氏制碱法的副产品,实验室用如图所示装置模拟侯氏制碱法。侯氏制碱法的原理为
是侯氏制碱法的副产品,实验室用如图所示装置模拟侯氏制碱法。侯氏制碱法的原理为 。
。
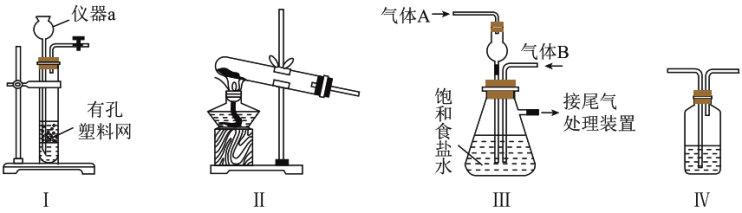
①仪器a的名称为___________ ;制取 可选择上图装置
可选择上图装置___________ (填“Ⅰ”或“Ⅱ”)。
②实验开始时,应先通气体___________ (填“A”或“B”)。
(2)某学习小组探究各因素对 水解程度的影响。设计实验方案如表所示(表中
水解程度的影响。设计实验方案如表所示(表中 浓度均为
浓度均为 ):
):
①实验1和2,探究浓度对 水解程度的影响,则a
水解程度的影响,则a___________ ;当A2与A1满足___________ 关系时,说明溶液浓度越小, 水解程度越大。
水解程度越大。
②有同学认为实验测得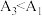 ,不能说明温度升高,促进了
,不能说明温度升高,促进了 水解,其理由为
水解,其理由为___________ 。
(3)将打磨过的镁条放入水中,无明显现象,但放入 溶液中,能观察到剧烈反应并产生较多的气泡。
溶液中,能观察到剧烈反应并产生较多的气泡。
①甲小组同学查阅资料得知,Mg与 难反应是因为Mg与水反应生成的
难反应是因为Mg与水反应生成的 ,覆盖在Mg表面阻碍Mg与
,覆盖在Mg表面阻碍Mg与 进一步反应,加入
进一步反应,加入 能发生反应:
能发生反应: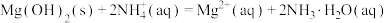 ,从而去除
,从而去除 。实验小组计算了该反应的
。实验小组计算了该反应的
___________ (保留3位有效数字),说明了反应能够进行(若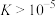 ,说明反应能够进行)。
,说明反应能够进行)。
②乙小组同学提出如下猜想:
猜想一:Mg可与 直接反应
直接反应
猜想二:Mg与 水解产生的
水解产生的 反应
反应
猜想三:Mg既与 直接反应同时与其水解产生的
直接反应同时与其水解产生的 反应
反应
设计了以下实验验证猜想,请帮助完成表格内容(已知: 微溶于乙醇)。
微溶于乙醇)。
实验发现实验Ⅱ、Ⅲ测定的pH变化和温度变化趋势基本一致,猜想一正确。
 )易溶于水,微溶于乙醇,是一种常见的化肥,也可用于制造干电池。25℃时,
)易溶于水,微溶于乙醇,是一种常见的化肥,也可用于制造干电池。25℃时, ,
,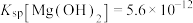 。
。回答下列问题:
(1)
 是侯氏制碱法的副产品,实验室用如图所示装置模拟侯氏制碱法。侯氏制碱法的原理为
是侯氏制碱法的副产品,实验室用如图所示装置模拟侯氏制碱法。侯氏制碱法的原理为 。
。
①仪器a的名称为
 可选择上图装置
可选择上图装置②实验开始时,应先通气体
(2)某学习小组探究各因素对
 水解程度的影响。设计实验方案如表所示(表中
水解程度的影响。设计实验方案如表所示(表中 浓度均为
浓度均为 ):
):| 序号 | 温度/℃ | 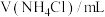 | 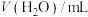 | pH |
| 1 | 25 | 40.0 | 0 | A1 |
| 2 | a | 4.0 | 36.0 | A2 |
| 3 | 85 | 40.0 | 0 | A3 |
 水解程度的影响,则a
水解程度的影响,则a 水解程度越大。
水解程度越大。②有同学认为实验测得
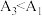 ,不能说明温度升高,促进了
,不能说明温度升高,促进了 水解,其理由为
水解,其理由为(3)将打磨过的镁条放入水中,无明显现象,但放入
 溶液中,能观察到剧烈反应并产生较多的气泡。
溶液中,能观察到剧烈反应并产生较多的气泡。①甲小组同学查阅资料得知,Mg与
 难反应是因为Mg与水反应生成的
难反应是因为Mg与水反应生成的 ,覆盖在Mg表面阻碍Mg与
,覆盖在Mg表面阻碍Mg与 进一步反应,加入
进一步反应,加入 能发生反应:
能发生反应: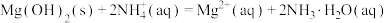 ,从而去除
,从而去除 。实验小组计算了该反应的
。实验小组计算了该反应的
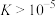 ,说明反应能够进行)。
,说明反应能够进行)。②乙小组同学提出如下猜想:
猜想一:Mg可与
 直接反应
直接反应猜想二:Mg与
 水解产生的
水解产生的 反应
反应猜想三:Mg既与
 直接反应同时与其水解产生的
直接反应同时与其水解产生的 反应
反应设计了以下实验验证猜想,请帮助完成表格内容(已知:
 微溶于乙醇)。
微溶于乙醇)。| 实验I | 将Mg粉加入乙醇中,发现无明显现象,再将Mg粉加入 |
| 实验Ⅱ | 取 的 的 溶液 溶液 置于烧杯中并连接传感器,加入镁粉,测定溶液的pH变化和温度变化 置于烧杯中并连接传感器,加入镁粉,测定溶液的pH变化和温度变化 |
| 实验Ⅲ | 取 的 的 溶液 溶液 置于烧杯中并连接传感器,加入少量 置于烧杯中并连接传感器,加入少量 |
您最近一年使用:0次
9 . 从废定影液(主要含有 、
、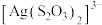 、
、 、
、 中回收Ag和
中回收Ag和 的主要步骤为:向废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤为:向废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关说法正确的是
,用苯萃取分液。下列有关说法正确的是
 、
、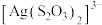 、
、 、
、 中回收Ag和
中回收Ag和 的主要步骤为:向废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤为:向废定影液中加入NaOH调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关说法正确的是
,用苯萃取分液。下列有关说法正确的是| A.过滤时,为加快滤液流下,可以用玻璃棒搅拌漏斗中的液体 |
B.配制 溶液时,向其中加入少量NaOH溶液, 溶液时,向其中加入少量NaOH溶液, 的值增 大 的值增 大 |
C.灼烧 生成Ag和 生成Ag和 ,该反应每生成1mol Ag转移3mol电子 ,该反应每生成1mol Ag转移3mol电子 |
| D.分液时,先放出水层,再从分液漏斗下口放出含有苯和溴的有机层 |
您最近一年使用:0次
2023-05-12更新
|
650次组卷
|
3卷引用:山东省聊城市2023届高考一模化学试题
名校
解题方法
10 . 下列关于盐类水解的说法正确的是
| A.在Na2S溶液中加入少量Na2S固体,Na2S的水解程度增大 |
| B.将CuSO4溶液由20℃加热到60℃,溶液的pH增大 |
C.向CH3COONa溶液中加水,溶液中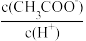 的比值增大 的比值增大 |
| D.常温下,0.1mol/L的NaB溶液的pH=8,溶液中c(Na+)=c(B-)+c(HB)=0.1mol/L |
您最近一年使用:0次



