名校
1 . 前四周期元素X、Y、Z、M、N、O、P,原子序数逐渐增大,其中X、Y、Z、M、N为短周期元素,而X、Y、Z、M处于同周期的P区,且未成对电子数之比为1:2:3:2;N与Z同族。O、P分别位于周期表第2、4列,P的单质被称为“未来金属”,具有质量轻、强度大、耐腐蚀性好的优点。
(1)Y、Z、M三种元素的电负性由大到小的顺序:________ (用元素符号表示)。
(2)M的常见氢化物的氢键的键能小于HF的氢键的键能,但Z的常见氢化物常温下为液态而HF常温下为气态的原因是:__________ 。
(3)XN一种耐磨涂料,可用于金属表面保护层,该化合物可由X的三溴化物和N的三溴化物于高温下在氢气的氛围中合成。
①写出合成XN的化学方程式:_________ 。(各物质用化学式表示)
②XN的晶体的晶胞如图所示:
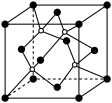
其中实心球为N,在一个晶胞中N原子空间堆积方式为______ ,N原子的配位数为______ ;该结构中有一个配位键,提供空轨道的原子是________ (写元素符号)。

(4)O和硫形成的某种晶体的晶胞如图a所示:该晶胞原子的坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为_______ 。
(5)图b为P的一种面心立方晶胞结构,若晶胞的边长为anm,则P的密度为_____ g·cm-3(用含a和NA的代数式表示)
(1)Y、Z、M三种元素的电负性由大到小的顺序:
(2)M的常见氢化物的氢键的键能小于HF的氢键的键能,但Z的常见氢化物常温下为液态而HF常温下为气态的原因是:
(3)XN一种耐磨涂料,可用于金属表面保护层,该化合物可由X的三溴化物和N的三溴化物于高温下在氢气的氛围中合成。
①写出合成XN的化学方程式:
②XN的晶体的晶胞如图所示:

其中实心球为N,在一个晶胞中N原子空间堆积方式为

(4)O和硫形成的某种晶体的晶胞如图a所示:该晶胞原子的坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为
(5)图b为P的一种面心立方晶胞结构,若晶胞的边长为anm,则P的密度为
您最近一年使用:0次
2019-06-20更新
|
84次组卷
|
2卷引用:河北省唐山市开滦第二中学2018-2019学年高二6月月考化学试题
名校
2 . 过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于________ 区。某一次性电池负极材料是Zn,正极材料是Mn的一种常见氧化物,放电后生成MnOOH,电解质是KOH。该电池的正极反应式为__________________________ 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为________ ,该能层具有的原子轨道数为________ 。BH4-的立体构型是________ 。
(3)单质Cu的晶体类型为______ ,晶体中组成微粒通过________ 作用形成面心立方密堆积,其中Cu原子的配位数为______ 。在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是________ ,乙醛分子中∠HCO的键角________ 乙醇分子中∠HCO的键角(填“大于”、“等于”或“小于”)。
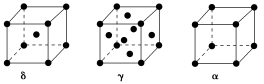
(4)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为________ ,δ、γ、α三种晶胞的边长之比为________ 。
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为
(3)单质Cu的晶体类型为
(4)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为

您最近一年使用:0次
名校
解题方法
3 . 下列物质的结构或性质及解释均正确且具有因果关系的是
| 选项 | 物质的结构或性质 | 解释 |
| A | 硬度;SiC>Si | 晶体类型不同 |
| B | 分解温度: | 相对分子质量越大,范德华力越大 |
| C |  在 在 中的榕解度大于在 中的榕解度大于在 中的溶解度 中的溶解度 |  的相对分子质量大于 的相对分子质量大于 的相对分子质量 的相对分子质量 |
| D | 酸性: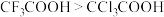 | 氟的电负性大于氯的电负性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-21更新
|
105次组卷
|
2卷引用:2024届河北省保定市十校高三下学期三模化学试题
名校
解题方法
4 . 下列各物质的酸性强弱关系正确的是
| A.CH2ClCOOH>CHCl2COOH | B.CCl3COOH<CFCl2COOH |
| C.CH3CF2COOH>CHF2COOH | D.C17H35COOH>C4H9COOH |
您最近一年使用:0次
名校
5 . 已知X、Y元素同周期,且电负性X>Y,下列说法正确的是( )
| A.X与Y形成化合物时,X显正价,Y显负价 | B.第一电离能Y一定小于X |
| C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 | D.气态氢化物的稳定性:HmY小于HnX |
您最近一年使用:0次
2018-02-11更新
|
243次组卷
|
3卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第2课时
6 . 已知A、B、D、E、G、X、Y、Z八种元素的原子序数依次增大。其中,A原子核外电子只有1种运动状态;基态B、E原子的2p轨道均含2个未成对电子;G是周期表中电负性最大的元素;Y和G同主族,X和Y同周期,且X离子是同周期元素简单离子中半径最小的;Z是八种元素中唯一的第四周期元素位于ds区,且基态原子核外只有1个未成对电子其余均为成对电子。推断出元素符号及相应化学式,并回答下列问题:
(1)基态Z原子的简化核外电子排布式:_______ ,基态E原子价层电子轨道表达式:_______ ,基态X原子的核外电子排布共有_______ 个能级。
(2)键能:G-G_______ Y-Y(填“>或<”,后同);B和D的第三电离能:B_______ D。
(3)A2E分子的VSEPR理想模型为_______ ;已知DA3溶于A2E溶液呈碱性,试在方框内画出DA3与A2E的分子间形成的氢键_______ 。

(4)B2A2分子中σ键和π键的比例_______ ;B2A2、E2在NaOH溶液中可构建燃料电池,试写出该燃料电池负极的电极反应式:_______ 。
(1)基态Z原子的简化核外电子排布式:
(2)键能:G-G
(3)A2E分子的VSEPR理想模型为

(4)B2A2分子中σ键和π键的比例
您最近一年使用:0次
7 . 图一是Na、Cu、Si、H、C、N等元素单质的熔点高低顺序,其中c、d均为热和电的良导体。
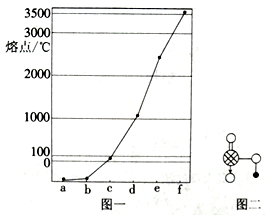
(1)单质d对应元素的基态原子M层电子排布式为_____ ,该元素位于元素周期表的____ 区。
(2)单质a、f对应的元素以原子个数比1 : 1形成的分子(相同条件下对H2的相对密度为13)中含σ键和π键的个数比为____ ,该分子中心原子的杂化轨道类型为________ 。
(3)单质b对应元素原子的最高能级电子云轮廓图形状为____ 形,将b的简单氢化 物溶于水后的溶液滴加到AgNO3溶液中至过量,所得络离子的结构可用示意图表示为_______ 。
(4)图二是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的两个原因_____________ 。

(1)单质d对应元素的基态原子M层电子排布式为
(2)单质a、f对应的元素以原子个数比1 : 1形成的分子(相同条件下对H2的相对密度为13)中含σ键和π键的个数比为
(3)单质b对应元素原子的最高能级电子云轮廓图形状为
(4)图二是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的两个原因
您最近一年使用:0次
8 . 下列说法错误的是
| A.在1个CsCl晶胞中含有1个Cs+ |
| B.SO2在水中的溶解度比CO2在水中的溶解度要大 |
| C.X、Y元素同周期,且电负性X>Y,第一电离能可能Y大于X |
| D.根据电子排布的特点,Cu和Ga在周期表中都属于d区 |
您最近一年使用:0次
名校
解题方法
9 . 硼(B)及其化合物是结构化学的重要研究对象。请回答下列问题:
(1)和B同主族电负性最小的元素[放射性元素(周期表中84号及其后的元素)除外]的价电子排布式为___________ ,Be、B、C的第一电离能由大到小的顺序是___________________ (用元素符号表示)
(2)无机苯(B3N3H6)与苯结构相似,其中B的杂化方式为______________ ,1mol B3N3H6中σ键的数目为______________________ 。
(3)Al和B同主族,其化合物氟化铝的熔沸点远远高于氯化铝,试解释其原因________________ 。
(4)将硼砂(NaB4O7)和NH4C1共热可得白色固体BN和B2O3、方程式_________________________ 。
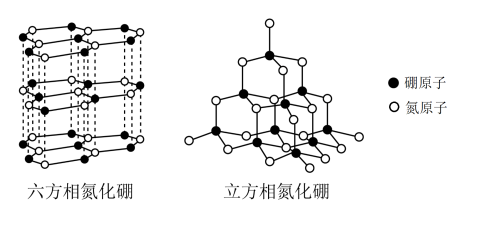
氮化硼有两种晶型结构,一种是六方氮化硼,其结构与石墨相似却不导电,原因是__________________ ;另一种是类似于金刚石结构的立方氮化硼,已知晶胞边长为361.5pm,N原子半径为a pm,则B原子半径为___________ pm(只要求列算式)。
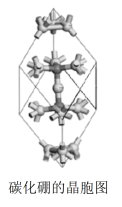
(5)碳化硼是除金刚石和氮化硼外最硬的固体,下图是碳化硼的晶胞简图,该图给出了晶胞中的所有原子,除“三原子”(中心原子和其相连的2个原子)外,晶胞的其余原子都是B12多面体中的1个原子,B12多面体的其他原子都不在晶胞内,均未画出。图中原子旁的短棍表示该原子与其他原子相连,若上述三原子都是碳原子,写出碳化硼的化学式_____________________ 。
(1)和B同主族电负性最小的元素[放射性元素(周期表中84号及其后的元素)除外]的价电子排布式为
(2)无机苯(B3N3H6)与苯结构相似,其中B的杂化方式为
(3)Al和B同主族,其化合物氟化铝的熔沸点远远高于氯化铝,试解释其原因
(4)将硼砂(NaB4O7)和NH4C1共热可得白色固体BN和B2O3、方程式
氮化硼有两种晶型结构,一种是六方氮化硼,其结构与石墨相似却不导电,原因是

(5)碳化硼是除金刚石和氮化硼外最硬的固体,下图是碳化硼的晶胞简图,该图给出了晶胞中的所有原子,除“三原子”(中心原子和其相连的2个原子)外,晶胞的其余原子都是B12多面体中的1个原子,B12多面体的其他原子都不在晶胞内,均未画出。图中原子旁的短棍表示该原子与其他原子相连,若上述三原子都是碳原子,写出碳化硼的化学式

您最近一年使用:0次
名校
10 . 下列各元素电负性大小顺序正确的是( )
| A.K>Na>Li | B.F>O>S | C.As>P>N | D.C>N>O |
您最近一年使用:0次



