解题方法
1 .  是一种高迁移率的新型热电材料,回答下列问题:
是一种高迁移率的新型热电材料,回答下列问题:
(1) 为ⅣA族元素,与同主族
为ⅣA族元素,与同主族 元素比较,电负性
元素比较,电负性
___ (填“>”或“<”) 。单质
。单质 与干燥
与干燥 反应生成
反应生成 。
。 空间构型为
空间构型为___ 。
(2)基态 原子的核外电子排布式为
原子的核外电子排布式为__ 。 的氢化物的沸点比
的氢化物的沸点比 的
的__ (填“高”或“低”),判断理由是___ 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有
配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有__ mol,该螯合物中N的杂化方式有___ 种。

(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系 的晶胞结构如下图所示,晶胞梭边夹角均为
的晶胞结构如下图所示,晶胞梭边夹角均为 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。
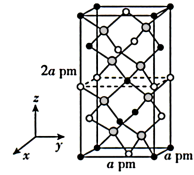
一个晶胞中有__ 个 ,找出距离Cd(0,0,0)最近的
,找出距离Cd(0,0,0)最近的
__ (用分数坐标表示)。 晶体中与单个
晶体中与单个 键合的
键合的 有
有__ 个。
 是一种高迁移率的新型热电材料,回答下列问题:
是一种高迁移率的新型热电材料,回答下列问题:(1)
 为ⅣA族元素,与同主族
为ⅣA族元素,与同主族 元素比较,电负性
元素比较,电负性
 。单质
。单质 与干燥
与干燥 反应生成
反应生成 。
。 空间构型为
空间构型为(2)基态
 原子的核外电子排布式为
原子的核外电子排布式为 的氢化物的沸点比
的氢化物的沸点比 的
的(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有
配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系
 的晶胞结构如下图所示,晶胞梭边夹角均为
的晶胞结构如下图所示,晶胞梭边夹角均为 ,晶胞中部分原子的分数坐标如下表所示。
,晶胞中部分原子的分数坐标如下表所示。
| 坐标 原子 | x | y | z |
 | 0 | 0 | 0 |
 | 0 | 0 | 0.5 |
 | 0.25 | 0.25 | 0.125 |
一个晶胞中有
 ,找出距离Cd(0,0,0)最近的
,找出距离Cd(0,0,0)最近的
 晶体中与单个
晶体中与单个 键合的
键合的 有
有
您最近一年使用:0次
名校
解题方法
2 . 新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____ ,该能层具有的原子轨道数为_____ .
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____ ,B原子的杂化轨道类型是_____ .
Li、B、H元素的电负性由大到小排列顺序为_____ .
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____ H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是_____ (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____ ,NaH的理论密度是___________ g•cm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是
Li、B、H元素的电负性由大到小排列顺序为
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+
| I1/kJ•mol﹣1 | I2/kJ•mol﹣1 | I3/kJ•mol﹣1 | I4/kJ•mol﹣1 | I5/kJ•mol﹣1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为
您最近一年使用:0次
名校
解题方法
3 . 下列是元素周期表中的部分元素,请回答下列有关问题:
(1)①元素的价层电子排布式___________ ,⑦元素基态原子的价层电子轨道表示式为___________ 。
(2)上述表中的元素中,电负性最小的元素是___________ (填元素符号,下同),第三周期第一电离能最大的元素是___________ 。
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是___________ (填化学式,下同),碱性最强的是___________ 。
| 周期 | 族 | |||||||
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ | |||||
(2)上述表中的元素中,电负性最小的元素是
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是
您最近一年使用:0次
名校
解题方法
4 . C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____ 周期第_____ 族。
(2)N的基态原子核外电子排布式为_____ ;Cu的基态原子最外层有___ 个电子。
(3)用“>”或“<”填空:
(1)Si位于元素周期表第
(2)N的基态原子核外电子排布式为
(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al | N | 金刚石 | CH4 |
您最近一年使用:0次
2020-05-20更新
|
85次组卷
|
2卷引用:河北省石家庄市第二中学2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分
解题方法
5 . 由苯甲醛在NaCN的催化作用下,在乙醇水溶液中发生偶联缩合反应获得安息香(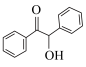 )的反应机理如下图所示:
)的反应机理如下图所示:

| A.合成安息香的总反应为取代反应 |
| B.机理中的碳原子有3种杂化方式 |
| C.NaCN反应前后没有发生变化,故其未参加反应 |
| D.非金属元素的电负性:N>O>C>H |
您最近一年使用:0次
解题方法
6 . 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、二氧化碳、青霉素、硝酸钾、乙醇、氨等“分子”改变过人类的世界。
(1)铁原子在基态时,外围电子排布式为____________ 。
(2)CO2的电子式为____________ ,1 mol CO2分子中含有σ键的物质的量为____________ 。
(3)6-氨基青霉烷酸的结构如图所示:
①其中C、N、O原子半径的大小关系为____________ ,电负性的大小关系为____________ ;
②其中采用sp3杂化的原子有C、____________ 。
(4)硝酸钾中NO3-的空间构型为____________ ,写出与NO3-互为等电子体的一种由前二周期元素原子构成的非极性分子化学式____________ 。
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是____________ 。
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为____________ g/cm3(用NA表示阿伏伽德罗常数)。
(1)铁原子在基态时,外围电子排布式为
(2)CO2的电子式为
(3)6-氨基青霉烷酸的结构如图所示:
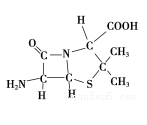
①其中C、N、O原子半径的大小关系为
②其中采用sp3杂化的原子有C、
(4)硝酸钾中NO3-的空间构型为
(5)乙醇的相对分子质量比氯乙烷小,但其沸点比氯乙烷高,其原因是
(6)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,若两个最近的Fe原子间的距离为a cm,则该晶体的密度计算式为

您最近一年使用:0次
2017-03-13更新
|
476次组卷
|
2卷引用:河北省石家庄市启明中学2019-2020学年高二四月月考化学试题
11-12高二上·福建厦门·期中
名校
7 . A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是
| A.四种元素A、B、C、D分别为O、Ca、Na、Ar |
| B.元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 |
| C.元素A、C简单离子的半径大小关系为A<C |
| D.元素B、C电负性大小关系为B>C |
您最近一年使用:0次
2016-12-09更新
|
520次组卷
|
12卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷2016-2017学年宁夏银川市第二中学高二下学期第一次月考化学试卷云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题(已下线)专题11.1 原子结构与性质(练)-《2020年高考一轮复习讲练测》云南省凤庆县第一中学2019-2020学年高二12月月考化学试题(已下线)第35讲 原子结构与性质(精练)-2021年高考化学一轮复习讲练测甘肃省静宁县第一中学2020-2021学年高二上学期期末考试化学(实验班)试题(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)吉林省长春市实验中学2020-2021学年度高二下学期阶段考试化学试题云南省玉溪市易门县一中2021-2022学年高二下学期3月月考化学试题
名校
解题方法
8 . 元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ns1;B元素的原子价层电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。
(1)写出元素名称:C___________ 、D___________ 、E___________ 。
(2)C基态原子的轨道表示式为___________ 。
(3)与D元素同周期中第一电离能比D小的元素有___________ 种。
(4)当n=2时,BC2分子的电子式为___________ ;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是___________ 。
(5)若A元素的原子最外层电子排布式为2s1,B元素的原子价层电子排布式为3s23p2,A、B、C、D四种元素的电负性由大到小的顺序是___________ (用元素符号表示)。
(6)E元素原子的价层电子排布式是___________ ,其最高价氧化物的化学式是___________ 。
(1)写出元素名称:C
(2)C基态原子的轨道表示式为
(3)与D元素同周期中第一电离能比D小的元素有
(4)当n=2时,BC2分子的电子式为
(5)若A元素的原子最外层电子排布式为2s1,B元素的原子价层电子排布式为3s23p2,A、B、C、D四种元素的电负性由大到小的顺序是
(6)E元素原子的价层电子排布式是
您最近一年使用:0次
名校
解题方法
9 . 镓与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____ ,基态As原子核外有_________ 个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____ 和+3。砷的电负性比镓____ (填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_________ 。
GaF3的熔点超过1000℃,可能的原因是______ 。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为___ ,草酸根中碳原子的杂化方式为____ 。
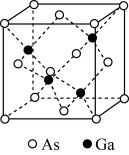

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_____ ,晶体的密度为____ (设NA为阿伏加 德罗常数的数值,列出算式即可)g·cm−3。
(1)基态Ga原子的核外电子排布式为
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为


(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为
您最近一年使用:0次
2020-08-15更新
|
92次组卷
|
10卷引用:河北省邢台市2018届高三上学期期末考试理综化学试题
河北省邢台市2018届高三上学期期末考试理综化学试题河北省藁城市第一中学2019届高三下学期4月月考化学试题河北省沧州市泊头市第一中学2020届高三上学期第四次月考化学试题湖南省邵阳市2018届高三上学期期末考试理综化学试题山东省济南市章丘区2018届高三3月模拟联考理综化学试题山西省六校(长治二中,晋城一中、康杰中学、临汾一中等)2018届高三第四次名校联合考试(百日冲刺)理综化学试题四川省泸县第四中学2019届高三二诊模拟理综-化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二下学期第一次月考化学试题湖南省湘潭一中、双峰一中,邵东一中2019-2020学年高二下学期联考化学试题高二选择性必修2(人教版2019)全书综合训练
9-10高二下·河南郑州·期末
名校
解题方法
10 . 有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________ ,B是________ ,E是_________ 。
(2) 写出C元素基态原子的电子排布式_________________________ 。
(3)写出D元素原子的价电子排布图____________________ 。
(4) 元素B与D的电负性的大小关系是___________ ,C与E的第一电离能的大小关系是___________ 。(填“>”、“<”或“=”)
(1)A是
(2) 写出C元素基态原子的电子排布式
(3)写出D元素原子的价电子排布图
(4) 元素B与D的电负性的大小关系是
您最近一年使用:0次
2019-04-28更新
|
125次组卷
|
4卷引用:河北省唐山市开滦第二中学2018-2019学年高二下学期期中考试化学试题
河北省唐山市开滦第二中学2018-2019学年高二下学期期中考试化学试题(已下线)2010年郑州市智林学校高二下学期期末考试化学试题四川省成都市双流棠湖中学2019-2020学年高二下学期第二次月考化学试题福建省福州福清市2017-2018学年高二下学期期中考试化学试题



