名校
1 . 二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。

回答下列问题:
(1)锌基态离子的价电子排布图为_______________ ;在基态18O原子中,核外电子存在_________ 种空间运动状态。
(2)乙二醇中C、H、O的电负性大小关系是__________ ;碳酸乙烯酯中碳原子的杂化轨道类型有___________ ;1mol 碳酸乙烯酯中含有的σ键的数目为__________ NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是_________ (填微粒符号),[Zn(H2O)6]2+中所含化学键的类型为__________________________ 。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______________ 。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为_________ ;若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______ g·cm-3(用NA表示阿伏伽德罗常数的值,列出算式不要求结果)。

回答下列问题:
(1)锌基态离子的价电子排布图为
(2)乙二醇中C、H、O的电负性大小关系是
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为
您最近一年使用:0次
2018-01-15更新
|
257次组卷
|
2卷引用:河北省承德一中2019届高三上学期第二次月考(期中)化学试题
名校
解题方法
2 . 脱羧反应是有机化学中的正要反应,如图为制备氰化物的脱羧反应。下列说法正确的是
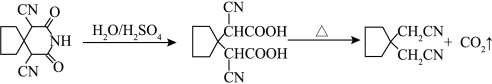
| A.电负性:S>O>N>C>H |
B. 分子的空间填充模型为 分子的空间填充模型为 |
C.化合物 分子中碳原子有2种杂化方式 分子中碳原子有2种杂化方式 |
D.化合物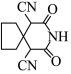 分子中有2个手性碳原子 分子中有2个手性碳原子 |
您最近一年使用:0次
3 . 钕磁铁是一种非常重要的新型磁铁,主要含钕 (60 Nd )、铁、硼三种元素。
(1)基态钕原子核外有_______ 种不同运动状态的电子。
(2)基态铁原子的价电子排布图为___________ 。
(3)第二周期中,第一电离能小于硼的元素为________ (填元素符号),电负性大于硼的主族元素有______ 种。
(1)基态钕原子核外有
(2)基态铁原子的价电子排布图为
(3)第二周期中,第一电离能小于硼的元素为
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物。
(1)尿素中所含元素的电负性最大的是______ ,尿素分子间的氢键可表示为______ 。
(1)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①与铁同周期且未成对电子数与Fe3+相同的元素是______ 。
②[Fe(H2NCONH2)6](NO3)3中存在的化学键______  填序号
填序号 。
。
A.离子键 B.金属键 C.配位键 D.σ键 E.π键
③ 中N原子杂化后的价电子排布图为
中N原子杂化后的价电子排布图为______ , 的空间构型为
的空间构型为______ 。
Ⅱ.Mg2NiH4是一种贮氢的金属氢化物
(3) Mg2NiH4可通过氢化镁和镍单质球磨制成。在Mg2NiH4晶胞中,Ni原子占据如图的顶点和面心, Mg2+处于如图八个小立方体的体心。
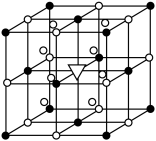
①Mg2NiH4中H的化合价为______ 。
②Mg2+位于Ni原子形成的______ (填“八面体空隙”或“四面体空隙”)。
③若晶体的密度为d g·cm-3,Mg2NiH4的摩尔质量为M g·mol-1,则Mg2+和Ni原子的最短距离为______ nm(用含d、M的代数式表示)。
(1)尿素中所含元素的电负性最大的是
(1)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①与铁同周期且未成对电子数与Fe3+相同的元素是
②[Fe(H2NCONH2)6](NO3)3中存在的化学键
 填序号
填序号 。
。A.离子键 B.金属键 C.配位键 D.σ键 E.π键
③
 中N原子杂化后的价电子排布图为
中N原子杂化后的价电子排布图为 的空间构型为
的空间构型为Ⅱ.Mg2NiH4是一种贮氢的金属氢化物
(3) Mg2NiH4可通过氢化镁和镍单质球磨制成。在Mg2NiH4晶胞中,Ni原子占据如图的顶点和面心, Mg2+处于如图八个小立方体的体心。

①Mg2NiH4中H的化合价为
②Mg2+位于Ni原子形成的
③若晶体的密度为d g·cm-3,Mg2NiH4的摩尔质量为M g·mol-1,则Mg2+和Ni原子的最短距离为
您最近一年使用:0次
名校
解题方法
5 . 已知A、B、C、D四种元素的原子序数之和等于36.A的单质是最轻的气体;B的基态原子有3个不同的能级,各能级中电子数相等;D有“生物金属”之称,其单质和化合物有广泛的用途,D4+离子和氩原子的核外电子排布相同.工业上利用DO2和碳酸钡在熔融状态下制取化合物甲(甲可看做一种含氧酸盐).化合物甲有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,化合物甲晶体的晶胞结构为立方体(如下图所示),其中Ba2+占据体心位置,O2-占据棱心位置,D4+占据顶点位置.

请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是__________________ (填元素符号).
(2)BA4分子的空间构型是______________ ;B原子轨道的杂化类型为_____ .
(3)C的气态氢化物的电子式为____ ;其沸点高于同主族其他元素氢化物的沸点,主要原因是____________________ .
(4)D的基态原子核外电子排布式为____________________ .
(5)①制备化合物甲的化学方程式为____________________ .
②在甲晶体中,若将D4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的__________ .
③在甲晶体中,D4+的氧配位数为__________ .
④已知甲晶体的摩尔质量为M g/mol,其晶胞边长为4.03×10-10m,则甲晶体的密度为__________________ g/cm3(要求列出算式,阿伏伽德罗常数用NA表示).

请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是
(2)BA4分子的空间构型是
(3)C的气态氢化物的电子式为
(4)D的基态原子核外电子排布式为
(5)①制备化合物甲的化学方程式为
②在甲晶体中,若将D4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的
③在甲晶体中,D4+的氧配位数为
④已知甲晶体的摩尔质量为M g/mol,其晶胞边长为4.03×10-10m,则甲晶体的密度为
您最近一年使用:0次
2018-12-04更新
|
137次组卷
|
2卷引用:河北省石家庄市第二中学2019届高三上学期期中考试理科综合化学试题
6 . 光伏材料是指能将太阳能直接转换成电能的材料,光伏材料又称太阳能材料,只有半导体材料具有这种功能。硅(Si)、镓(Ga)、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)硅能形成与烷烃类似的硅烷,写出乙硅烷的电子式:___________ 。硅烷很难像烷烃一样形成长链,这是因为硅的原子半径___________ (填“大于”“小于”或“等于”)碳的原子半径,因此键长___________ (填“长”或“短”),键能小。丁硅烯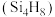 中
中 键与
键与 键的个数比为
键的个数比为___________ 。
(2)我国航天事业发展迅猛,太阳能电池材料使用的是砷化镓(GaAs)。基态砷原子中电子占据的最高能层符号是___________ 。
(3)光催化还原 制备
制备 的反应中,带状纳米
的反应中,带状纳米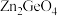 是该反应的良好催化剂。Zn、Ge、O电负性由大到小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大到小的顺序是___________ 。
(4)硅和锗都能与氯元素形成四氯化物 和
和 ,从原子结构角度解释原因:
,从原子结构角度解释原因:___________ 。
(5)太阳能电池材料的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因:___________ 。
(1)硅能形成与烷烃类似的硅烷,写出乙硅烷的电子式:
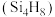 中
中 键与
键与 键的个数比为
键的个数比为(2)我国航天事业发展迅猛,太阳能电池材料使用的是砷化镓(GaAs)。基态砷原子中电子占据的最高能层符号是
(3)光催化还原
 制备
制备 的反应中,带状纳米
的反应中,带状纳米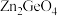 是该反应的良好催化剂。Zn、Ge、O电负性由大到小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大到小的顺序是(4)硅和锗都能与氯元素形成四氯化物
 和
和 ,从原子结构角度解释原因:
,从原子结构角度解释原因:(5)太阳能电池材料的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因:
您最近一年使用:0次
7 . 下列有关元素及其化合物性质的说法中正确的是
A. 与 与 发生水解反应,水解产物中都有HI 发生水解反应,水解产物中都有HI |
| B.ⅣA族元素单质的晶体类型相同 |
C.N的电负性比P大,可推断 分子的极性比 分子的极性比 分子的极性大 分子的极性大 |
D. 的熔沸点高于HF,可推断 的熔沸点高于HF,可推断 分子间氢键比HF分子间氢键多 分子间氢键比HF分子间氢键多 |
您最近一年使用:0次
名校
解题方法
8 . 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O
(1)X基态原子的电子排布式为______ .
(2)C、H、O三种原子的电负性由大到小的顺序为______ .
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:
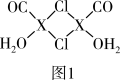
①与CO为互为等电子体的分子是______ .
②该配合物中氯原子的杂化方式为______ .
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______ .
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______ .XCl的化学式__________

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=_____________ (无需化简,列式即可)。
(1)X基态原子的电子排布式为
(2)C、H、O三种原子的电负性由大到小的顺序为
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:

①与CO为互为等电子体的分子是
②该配合物中氯原子的杂化方式为
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=
您最近一年使用:0次
名校
解题方法
9 . 四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是________ 、________ ;杂化轨道分别是________ 、________ ;a分子的立体结构是________ 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是________ 晶体、________ 晶体。
(3)Y与Z比较,电负性较大的是________ ,W2+离子的核外电子排布式是________ 。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是
(3)Y与Z比较,电负性较大的是
您最近一年使用:0次
名校
10 . 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的原子序数依次增大。A是宇宙中含量最丰富的元素,B、D原子的L层有2个未成对电子。E3+离子M层3d轨道电子为半满状态,F比E原子序数大1且位于同一族。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F的价电子排布图_______ ,E位于周期表____ 区。
(2)B、C、D的电负性由小到大的顺序为___________ 。
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是_______ (填结构简式)
(4)F可形成分子式均为F(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时产生淡黄色沉淀,则这种配合物的化学式为_______
(5)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞平均含有___ 个B原子。
(1)写出F的价电子排布图
(2)B、C、D的电负性由小到大的顺序为
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是
(4)F可形成分子式均为F(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时产生淡黄色沉淀,则这种配合物的化学式为
(5)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞平均含有
您最近一年使用:0次



