解题方法
1 . 太阳能电池板材料除单品硅外,还有铜、铟、稼、硒、硅等化学物质。
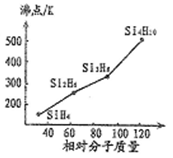
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____ Si(填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷(SinH2n+2)。硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是______________ 。
(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________ 。
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为___________________ 。
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度_____ g/cm3。
(3)稼的基态原子的电子排布式是_______ 。与铟、稼元家处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物.如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______ ,B与N之间形成______ 键;硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.其电离方程式为______________ 。
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度
(3)稼的基态原子的电子排布式是
您最近一年使用:0次
解题方法
2 . 【化学——选修3:物质结构与性质】
在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3===2Na3AlF6+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__________ (填序号)。
a.离子键 b.极性键 c.配位键 d.范德华力
(2) CO2分子的空间构型为_____________ ,中心原子的杂化方式为____________ ,和CO2互为等电子体的氧化物是______________ 。
(3)反应物中电负性最大的元素为___________________ (填元素符号),写出其原子最外层的电子排布图:___________________ 。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是
________________ (填具体的微粒符号)。

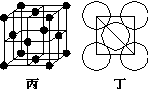
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为_______ 个;Al晶体的密度为_____________ (用字母表示)。
在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3===2Na3AlF6+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在
a.离子键 b.极性键 c.配位键 d.范德华力
(2) CO2分子的空间构型为
(3)反应物中电负性最大的元素为
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是


(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为
您最近一年使用:0次
2016-12-09更新
|
308次组卷
|
3卷引用:2016届江西省吉安一中高三5月模拟考试理综化学试卷
3 . 三硫化四磷是黄绿色针状结晶,其结构如图所示。不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:
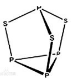
(1)Se是S的下一周期同主族元素,其核外电子排布式为_____ 。
(2)第一电离能:S_____ (填“>”或“<”,下同)P,电负性:S_____ P
(3)三硫化四磷分子中P原子采取_____ 杂化,与PO 互为等电子体的化合物分子的化学式为
互为等电子体的化合物分子的化学式为_______ 。
(4)二硫化碳属_______ (填“极性”或“非极性”)分子。
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_______ 。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是_______ 。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为_______ ,用NA表示阿伏加德罗常数的数值,NaOH的密度为_______ g/cm3.

(1)Se是S的下一周期同主族元素,其核外电子排布式为
(2)第一电离能:S
(3)三硫化四磷分子中P原子采取
 互为等电子体的化合物分子的化学式为
互为等电子体的化合物分子的化学式为(4)二硫化碳属
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为
您最近一年使用:0次
2016-12-09更新
|
754次组卷
|
10卷引用:2017届江西省赣州市十四县(市)高三下学期期中联考理综化学试卷
2017届江西省赣州市十四县(市)高三下学期期中联考理综化学试卷江西省赣中南五校2017届高三下学期期中联合考试化学试题2016届山西省临汾一中高三下3月月考理综化学试卷广西南宁市2017届高三第一次模拟测试理综化学试题2017届广西钦州市高三下学期普通高中毕业班第一次适应性测试(二模)理综化学试卷广西陆川县中学2018届高三9月月考理科综合化学试题辽宁省丹东市2018届高三一模考试理综-化学试题(已下线)广西钦州市普通高中2017届高三下学期第一次适应性测试(二模)理综化学试题(已下线)易错28 晶胞的结构与性质-备战2021年高考化学一轮复习易错题(已下线)第5周 周测卷-备战2022年高考化学周测与晚练(新高考专用)
名校
解题方法
4 . 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W原子的核外电子排布式为______ 。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为______ 、______ 、______ ,推测盐中阴离子的空间构型为______ ,其中心原子杂化方式为______ 。
(3)Z、W两种元素电负性的大小关系为______ ;Y、Z两种元素第一电离能的大小关系为______ 。
(4)CO的结构可表示为C≡O,元素Y的单质Y2的结构也可表示为Y Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):
①结合数据说明CO比Y2活泼的原因:______ 。
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是______ 。
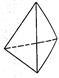
A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
(1)W原子的核外电子排布式为
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为
(3)Z、W两种元素电负性的大小关系为
(4)CO的结构可表示为C≡O,元素Y的单质Y2的结构也可表示为Y
 Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明CO比Y2活泼的原因:
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是

A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
您最近一年使用:0次



