1 . 为践行社会主义核心价值观,创建和谐社会,实现碳达峰和碳中和,我国科学家独创了一种二氧化碳转化新路径:通过电催化与生物合成相结合,以二氧化碳和水为原料成功合成了葡萄糖(C6H12O6)和脂肪酸,为人工和半人工合成“粮食”提供了新路径。关于上述物质,下列说法正确的是
| A.CO2和H2O均为极性分子,故CO2易溶于水 |
| B. CO2晶体属于分子晶体,晶体中一个CO2分子周围紧邻的CO2分子有12个 |
| C.H2O分子中O原子上有2对孤电子对,故H2O分子的VSEPR模型为V形 |
| D.葡萄糖为分子晶体,脂肪酸为离子晶体 |
您最近一年使用:0次
2023-03-30更新
|
257次组卷
|
4卷引用:山东省滨州市惠民县2022-2023学年高二下学期4月期中质量检测化学试题
名校
解题方法
2 . I.工业中可利用生产钛白的副产物FeSO4·7H2O和硫铁矿(FeS2)联合制备铁精粉(FexOy)和硫酸,实现能源及资源的有效利用。
(1)FeSO4·7H2O结构示意图如图:
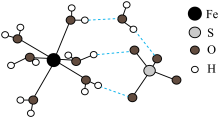
①Fe2+的价层电子排布式为_____ 。
②H2O中O和SO 中S均为sp3杂化,比较H2O中H-O-H键角和SO
中S均为sp3杂化,比较H2O中H-O-H键角和SO 中O-S-O键角的大小并解释原因
中O-S-O键角的大小并解释原因____ 。
③FeSO4·7H2O中H2O与Fe2+、H2O与SO 的作用力类型分别是
的作用力类型分别是_____ 。
(2)FeS2晶体的晶胞形状为立方体,边长为anm,结构如图:
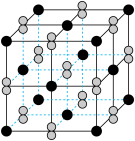
①Fe2+的配位数_____ 个。
②FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数为NA,晶体的密度为_____ g•cm-3。(1nm=10—9m)
Ⅱ.四氟肼(N2F4)可作高能燃料的氧化剂,可用Fe3+与二氟胺(HNF2)反应制得,发生的反应是2HNF2+2Fe3+=N2F4↑+2Fe2++2H+,请回答有关问题:
(3)F原子最外层电子排布式_____ ;N原子核外不同运动状态的电子有_____ 种;N2的电子式_____ ;F元素的非金属性比N强,用原子结构的知识说明理由:_____ 。
(4)HNF2中N元素的化合价是_____ ;反应中氧化剂与还原剂的物质的量之比为_____ ;若生成0.1molN2F4,电子转移数是____ 。
(1)FeSO4·7H2O结构示意图如图:

①Fe2+的价层电子排布式为
②H2O中O和SO
 中S均为sp3杂化,比较H2O中H-O-H键角和SO
中S均为sp3杂化,比较H2O中H-O-H键角和SO 中O-S-O键角的大小并解释原因
中O-S-O键角的大小并解释原因③FeSO4·7H2O中H2O与Fe2+、H2O与SO
 的作用力类型分别是
的作用力类型分别是(2)FeS2晶体的晶胞形状为立方体,边长为anm,结构如图:

①Fe2+的配位数
②FeS2的摩尔质量为120g·mol-1,阿伏加德罗常数为NA,晶体的密度为
Ⅱ.四氟肼(N2F4)可作高能燃料的氧化剂,可用Fe3+与二氟胺(HNF2)反应制得,发生的反应是2HNF2+2Fe3+=N2F4↑+2Fe2++2H+,请回答有关问题:
(3)F原子最外层电子排布式
(4)HNF2中N元素的化合价是
您最近一年使用:0次
名校
解题方法
3 . 下列图像正确的是
A. 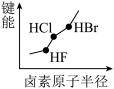 | B. 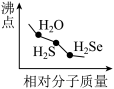 |
C. 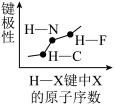 | D. 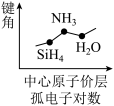 |
您最近一年使用:0次
2023-03-26更新
|
424次组卷
|
9卷引用:山东省济宁市兖州区2019-2020学年高二5月阶段性测试化学试题
山东省济宁市兖州区2019-2020学年高二5月阶段性测试化学试题江苏省泰州中学2020-2021学年高一下学期期末考试化学试题(已下线)第2章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)河北省沧州市2021-2022学年高二下学期期末考试化学试题黑龙江省佳木斯市第十二中学2021-2022学年高二下学期期中考试化学试题河南省洛阳强基联盟2022-2023学年高二下学期3月联考化学试题湖北省宜昌市协作体2022-2023学年高二下学期期中考试化学试题湖南省岳阳市郡华学校2023-2024学年高二下学期入学考试化学试题江西省萍乡市2023-2024学年高二下学期4月期中考试化学试题
名校
4 . 根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间结构正确的是
| 选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间结构 |
| A |  | sp | 直线形 | 直线形 |
| B |  |  | 平面三角形 | 平面三角形 |
| C |  |  | 四面体形 | 三角锥形 |
| D |  |  | 平面三角形 | 平面三角形 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 下列说法不正确的是
| A.某微粒空间构型为三角锥形,则该微粒一定是极性分子 |
| B.有下列分子:①CO2②NO2③SO2④BF3⑤NH3,分子的VSEPR模型为平面三角形的是 ②③④ |
| C.Ca2+、K+、Cl-、S2-四种离子的半径依次减小 |
| D.核外电子数为偶数的基态原子,其原子轨道中可能含“未成对电子” |
您最近一年使用:0次
名校
6 . 回答下列问题:
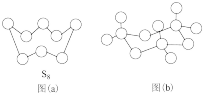
(1)图(a)为 的结构,其硫原子的杂化轨道类型为
的结构,其硫原子的杂化轨道类型为___________ 。
(2)气态三氧化硫以单分子形式存在,其分子的空间结构为___________ ;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。
(3) 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为___________ ,中心原子的杂化方式为___________ 。
(4) 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为___________ 。
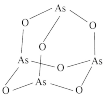
(5) 中,
中, 原子的轨道杂化方式为
原子的轨道杂化方式为___________ 。

(1)图(a)为
 的结构,其硫原子的杂化轨道类型为
的结构,其硫原子的杂化轨道类型为(2)气态三氧化硫以单分子形式存在,其分子的空间结构为
(3)
 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(4)
 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为
(5)
 中,
中, 原子的轨道杂化方式为
原子的轨道杂化方式为
您最近一年使用:0次
2023-03-14更新
|
774次组卷
|
2卷引用:山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题
名校
解题方法
7 . 现有五种元素,其中Y、Z、W为同周期主族元素,Q为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)Q位于第______ 族______ 区。
(2)离子ZW 的空间结构为:
的空间结构为:___________ ;化合物X2W的价层电子对互斥模型为___________ 。
(3)比较ZX 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
_____ (填“>”“=”或“<”)ZX3。
(4)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有___________ ,该化合物中σ键和π键的个数之比为___________ 。
| X元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| Y元素基态原子的最外层中p能级的电子数等于前一能层电子 |
| Z元素基态原子的未成对电子数目是同周期最多的 |
| W元素基态原子最外能层的p能级中有一个轨道填充2个电子 |
| Q在周期表的第七列 |
(2)离子ZW
 的空间结构为:
的空间结构为:(3)比较ZX
 和ZX3的键角∠XZX的大小:ZX
和ZX3的键角∠XZX的大小:ZX
(4)化合物X3Y–Y≡Z中,Y元素原子的杂化形式有
您最近一年使用:0次
2023-03-14更新
|
109次组卷
|
2卷引用:山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题
名校
解题方法
8 . “万能还原剂”硼氢化钠( )具有很强的还原性,
)具有很强的还原性, 在催化剂钌(
在催化剂钌(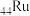 )表面与水反应的历程如图所示。下列说法错误的是
)表面与水反应的历程如图所示。下列说法错误的是
 )具有很强的还原性,
)具有很强的还原性, 在催化剂钌(
在催化剂钌(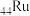 )表面与水反应的历程如图所示。下列说法错误的是
)表面与水反应的历程如图所示。下列说法错误的是
A.元素钌(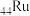 )位于元素周期表的d区 )位于元素周期表的d区 |
B.键角: |
| C.反应过程中仅氢元素化合价发生变化 |
D.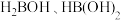 和 和 中B的 中B的 模型相同 模型相同 |
您最近一年使用:0次
2023-02-11更新
|
374次组卷
|
5卷引用:山东省烟台市2022-2023学年高二上学期期末考试化学试题
22-23高三上·广东茂名·期末
名校
解题方法
9 . 硫的化合物很多,如 、
、 、
、 、
、 、三聚的
、三聚的 等,三聚的
等,三聚的 的结构如图所示。下列说法正确的是。
的结构如图所示。下列说法正确的是。

 、
、 、
、 、
、 、三聚的
、三聚的 等,三聚的
等,三聚的 的结构如图所示。下列说法正确的是。
的结构如图所示。下列说法正确的是。
A. 为正四面体结构 为正四面体结构 | B. 、 、 分子的VSEPR模型不一样 分子的VSEPR模型不一样 |
C. 、 、 中S原子都是 中S原子都是 杂化 杂化 | D.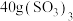 分子中含有 分子中含有 键 键 |
您最近一年使用:0次
2023-02-03更新
|
838次组卷
|
9卷引用:山东省青岛市2023届高三下学期一模化学试题变式题(选择题1-5)
(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(选择题1-5)广东省茂名市第一中学2022-2023学年高三上学期期末化学诊断检测题黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题贵州省凯里市第一中学2022-2023学年高二下学期第一次月考化学试题广东省揭阳市惠来县第一中学2022-2023学年高二下学期第一次月考化学试题山西省孝义市2022-2023学年高二4月月考化学试卷重庆市2023届高三第一次联合诊断检测(一模)(康德卷)化学试题河北省邯郸市磁县第一中学2023-2024学年高二上学期七调月考化学试题重庆市西南大学附属中学校2023-2024学年高二下学期3月联合考试化学试题
名校
解题方法
10 . Zn、V、Cu、In、S和Se等原子是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1)49In的价层电子排布式为_______ 。
(2)Zn、O、S和Se的电负性由大到小的顺序为_______ 。制备荧光材料过程中会产生少量SO 、VO
、VO ,其中V原子采用
,其中V原子采用_______ 杂化,VO 空间结构为
空间结构为_______ ,SO 的空间构型为
的空间构型为_______ 。
(3)C、N、S分别与H形成的简单氢化物中键角最小的是_______ ,其原因是_______ 。
(4)H、C、N、S四种元素可形成硫氰酸(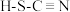 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为_______ ,异硫氰酸沸点较高,原因是_______ 。
(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为_______ 。
(1)49In的价层电子排布式为
(2)Zn、O、S和Se的电负性由大到小的顺序为
 、VO
、VO ,其中V原子采用
,其中V原子采用 空间结构为
空间结构为 的空间构型为
的空间构型为(3)C、N、S分别与H形成的简单氢化物中键角最小的是
(4)H、C、N、S四种元素可形成硫氰酸(
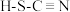 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
您最近一年使用:0次



