1 . 在催化剂作用下,环己酮氧化反应的可能机理如图所示。下列说法正确的是
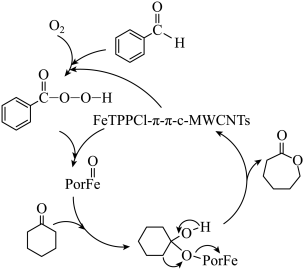

| A.产物中环上O原子的VSEPR模型为角形 |
B.用 代替环己酮所得产物为 代替环己酮所得产物为 |
C.每消耗 环己酮,转移电子数为 环己酮,转移电子数为 |
| D.用丙酮代替环己酮所得产物为乙酸甲酯 |
您最近一年使用:0次
名校
解题方法
2 .  (砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成
(砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成 ,
, 和
和 反应的产物之一为
反应的产物之一为 。下列说法错误的是
。下列说法错误的是
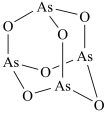
 (砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成
(砒霜)是两性氧化物,分子结构如图所示,与盐酸反应能生成 ,
, 和
和 反应的产物之一为
反应的产物之一为 。下列说法错误的是
。下列说法错误的是
A. 分子中As原子的杂化方式为 分子中As原子的杂化方式为 |
B. 的分子空间构型为平面正三角形 的分子空间构型为平面正三角形 |
C. 的价层电子对互斥模型是四面体形 的价层电子对互斥模型是四面体形 |
D. 分子的键角小于 分子的键角小于 |
您最近一年使用:0次
2023-07-06更新
|
506次组卷
|
4卷引用:江西省吉安市2022-2023学年高二下学期6月期末考试化学试题
解题方法
3 . 含硅化合物在生活中的应用非常广泛。请回答下列问题:
(1)祖母绿宝石的主要成分化学式为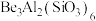 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
___________  。
。
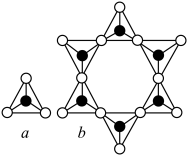
(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是___________ (不能用最简式表示)。
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为___________ , 的空间构型为
的空间构型为___________ 。
(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是___________ 。
(5)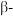 石英是晶质石英(
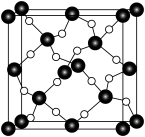
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为___________ ,请用价层电子对互斥模型解释图中键角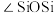 并不是
并不是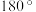 的原因是
的原因是___________ 。
(1)祖母绿宝石的主要成分化学式为
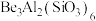 ,
, 与
与 的第一电离能大小关系为:
的第一电离能大小关系为:
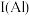 。
。(2)硅酸盐的阴离子结构丰富多样,有些是有限数目的硅氧四面体构建的简单阴离子,如图所示,最简单的硅酸盐阴离子a的化学式为
 ,则六元环状硅酸盐阴离子b的化学式是
,则六元环状硅酸盐阴离子b的化学式是
(3)工业制备高纯硅,先用焦炭在电炉中将石英还原为粗硅,再将粗硅与
 在300℃反应生成
在300℃反应生成 ,氯原子的价层电子排布式为
,氯原子的价层电子排布式为 的空间构型为
的空间构型为(4)硅的各种卤化物的沸点如下表,沸点依次升高的原因是
 |  | 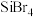 |  | |
| 沸点/K | 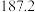 | 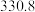 | 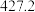 | 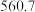 |
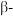 石英是晶质石英(
石英是晶质石英( )的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为
)的一种变体,其晶胞结构如图所示,一个晶胞中含有的硅原子数为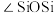 并不是
并不是 的原因是
的原因是
您最近一年使用:0次
4 . 甲醛(HCHO)、过氧乙酸(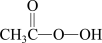 )、次氯酸钙
)、次氯酸钙 均可用于杀菌消毒,下列说法正确的是
均可用于杀菌消毒,下列说法正确的是
| A.甲醛分子的空间结构:三角锥形 |
B.过氧乙酸分子中所有碳原子的杂化类型: 、 、 |
C.基态氯原子的价层电子排布式: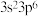 |
| D.基态钙原子占据的最高能级轨道形状:哑铃形 |
您最近一年使用:0次
名校
解题方法
5 . MBTH(熔点 )常用于检测室内空气中甲醛(HCHO)含量,结构如图所示:
)常用于检测室内空气中甲醛(HCHO)含量,结构如图所示:

回答下列问题
(1)甲醛所含元素的电负性由小到大的顺序为___________ (用元素符号表示),基态 原子的价层电子轨道表示式为
原子的价层电子轨道表示式为___________
(2)甲醛分子的VSEPR模型为___________ ,甲醛沸点(19.5℃)低于甲醇沸点(64.8℃),其原因是___________ 。
(3)甲醛能和一些极性试剂如 进行加成反应(氢原子加到电负性相对大的氧原子上),该反应的化学方程式为
进行加成反应(氢原子加到电负性相对大的氧原子上),该反应的化学方程式为___________ 。
(4)MBTH分子中碳原子采取的杂化类型为___________ ,基态 原子核外电子有
原子核外电子有___________ 种空间运动状态(原子轨道)。
(5) 与
与 的比较,熔点更高的是
的比较,熔点更高的是___________ 。
(6)下列现代分析手段中,可用于检测MBTH的分子结构的是___________。
 )常用于检测室内空气中甲醛(HCHO)含量,结构如图所示:
)常用于检测室内空气中甲醛(HCHO)含量,结构如图所示:
回答下列问题
(1)甲醛所含元素的电负性由小到大的顺序为
 原子的价层电子轨道表示式为
原子的价层电子轨道表示式为(2)甲醛分子的VSEPR模型为
(3)甲醛能和一些极性试剂如
 进行加成反应(氢原子加到电负性相对大的氧原子上),该反应的化学方程式为
进行加成反应(氢原子加到电负性相对大的氧原子上),该反应的化学方程式为(4)MBTH分子中碳原子采取的杂化类型为
 原子核外电子有
原子核外电子有(5)
 与
与 的比较,熔点更高的是
的比较,熔点更高的是(6)下列现代分析手段中,可用于检测MBTH的分子结构的是___________。
| A.X射线衍射 | B.原子光谱 | C.元素分析 | D.红外光谱 |
您最近一年使用:0次
2023-05-15更新
|
228次组卷
|
2卷引用:广东省广州市第六十五中学2022-2023学年高二下学期期中考试化学试题
解题方法
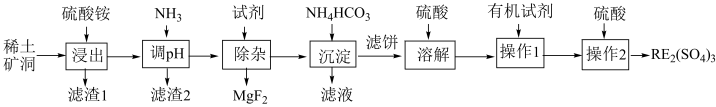
6 . 我国稀土工艺技术水平世界领先。从离子型稀土矿中(含RE、K、Al、Mg、Si、F等多种铝硅酸盐化合物,RE代表稀土元素)通过阳离子交换法提取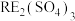 工艺流程如图。
工艺流程如图。
已知:①稀土矿中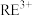 、
、 、
、 等主要吸附于铝硅酸盐中,稀土元素离子
等主要吸附于铝硅酸盐中,稀土元素离子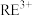
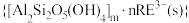 和杂质离子
和杂质离子 在矿洞中可与加入的盐溶液发生阳离子交换,将
在矿洞中可与加入的盐溶液发生阳离子交换,将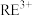 与
与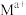 从铝硅酸盐中交换出来。
从铝硅酸盐中交换出来。
②常温下部分难溶物的溶度积如表:
③pH对稀土和铝浸出率的影响如图:

回答下列问题:
(1)“滤渣1”中存在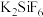 ,其阴离子的空间构型为
,其阴离子的空间构型为___________ 。“浸出”时最佳 为4.5,大于4.5稀土浸出率降低,解释原因
为4.5,大于4.5稀土浸出率降低,解释原因___________ 。
(2)矿洞中“浸出”时发生复杂反应,写出稀土离子交换的离子方程式___________ (注明物质状态)。
(3)“沉淀”稀土离子的离子方程式为___________ 。
(4)回收利用“滤液”的操作单元是___________ 。
(5)“操作2”的名称为___________ ,实验室进行该步操作需要用到的玻璃仪器有___________ 。
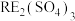 工艺流程如图。
工艺流程如图。
已知:①稀土矿中
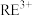 、
、 、
、 等主要吸附于铝硅酸盐中,稀土元素离子
等主要吸附于铝硅酸盐中,稀土元素离子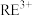
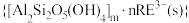 和杂质离子
和杂质离子 在矿洞中可与加入的盐溶液发生阳离子交换,将
在矿洞中可与加入的盐溶液发生阳离子交换,将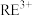 与
与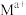 从铝硅酸盐中交换出来。
从铝硅酸盐中交换出来。②常温下部分难溶物的溶度积如表:
| 物质 |  |  | 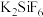 |
 | 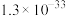 |  |  |

回答下列问题:
(1)“滤渣1”中存在
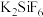 ,其阴离子的空间构型为
,其阴离子的空间构型为 为4.5,大于4.5稀土浸出率降低,解释原因
为4.5,大于4.5稀土浸出率降低,解释原因(2)矿洞中“浸出”时发生复杂反应,写出稀土离子交换的离子方程式
(3)“沉淀”稀土离子的离子方程式为
(4)回收利用“滤液”的操作单元是
(5)“操作2”的名称为
您最近一年使用:0次
名校
解题方法
7 . 第二周期主族元素X、Y,基态原子均有两个未成对电子,可形成化学式为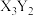 ,且分子中每个原子均满足8电子稳定结构。下列叙述错误的是
,且分子中每个原子均满足8电子稳定结构。下列叙述错误的是
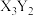 ,且分子中每个原子均满足8电子稳定结构。下列叙述错误的是
,且分子中每个原子均满足8电子稳定结构。下列叙述错误的是A.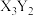 的结构式为 的结构式为 |
| B.X与Y的氢化物的熔、沸点一定是前者低于后者 |
C.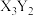 分子中所有原子都在一条直线上 分子中所有原子都在一条直线上 |
D.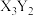 分子很活泼,能与 分子很活泼,能与 、HCl等发生加成反应 、HCl等发生加成反应 |
您最近一年使用:0次
2023-05-06更新
|
694次组卷
|
3卷引用:辽宁省2023届高三第二次全省统考化学试题
辽宁省2023届高三第二次全省统考化学试题(已下线)第06练 元素“位—构—性”的综合推断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)辽宁省沈阳市等3地2023届高三下学期三模考试化学试题
8 . 氟及其化合物在生产、生活中十分重要,人们对它的研究和应用过程十分曲折。回答下列问题:
(1)1670年,德国人玻璃工斯瓦恩哈德无意中将萤石(CaF2)与浓硫酸1∶1混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。写出这种刺激性气味的烟雾腐蚀玻璃(含 )的化学反应方程式:
)的化学反应方程式:___________ 。
(2)单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命。终于,1886年法国化学家莫瓦桑在低温下电解熔融的氟化氢钾(KHF2)制得单质氟,同时得到另一种气体单质。写出电解制备单质氟的阴极反应方程式:___________ 。
(3)氟单质的反应性非常强,可与稀有气体氙(Xe)发生反应。已知:
在标准压强 条件下
条件下
Ⅰ.
Ⅱ.
以反应Ⅰ为例,用 代表某组分的平衡分压,则
代表某组分的平衡分压,则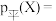 平衡时X的体积分数
平衡时X的体积分数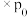 ,
,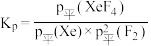 。
。
①根据上述数据判断反应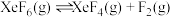 的焓变
的焓变
___________ (填“>”“<”或“=”)0。
②在一定压强下,提高平衡时 选择性的方法为
选择性的方法为___________ 或___________ 。
③若在标准压强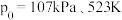 条件下以
条件下以 和
和 制取
制取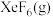 ,并使产物中
,并使产物中 ,则
,则 的平衡分压为标准压强(
的平衡分压为标准压强( )的
)的___________ 倍(用分数表示)。
(4)氟元素可以与很多元素形成化合物,其中氟与氧形成的 是一种比较稳定的化合物,经测定其键角小于
是一种比较稳定的化合物,经测定其键角小于 的键角,试解释原因
的键角,试解释原因___________ 。
(1)1670年,德国人玻璃工斯瓦恩哈德无意中将萤石(CaF2)与浓硫酸1∶1混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。写出这种刺激性气味的烟雾腐蚀玻璃(含
 )的化学反应方程式:
)的化学反应方程式:(2)单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命。终于,1886年法国化学家莫瓦桑在低温下电解熔融的氟化氢钾(KHF2)制得单质氟,同时得到另一种气体单质。写出电解制备单质氟的阴极反应方程式:
(3)氟单质的反应性非常强,可与稀有气体氙(Xe)发生反应。已知:
在标准压强
 条件下
条件下Ⅰ.

Ⅱ.

以反应Ⅰ为例,用
 代表某组分的平衡分压,则
代表某组分的平衡分压,则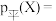 平衡时X的体积分数
平衡时X的体积分数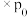 ,
,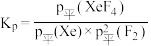 。
。①根据上述数据判断反应
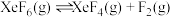 的焓变
的焓变
②在一定压强下,提高平衡时
 选择性的方法为
选择性的方法为③若在标准压强
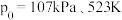 条件下以
条件下以 和
和 制取
制取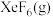 ,并使产物中
,并使产物中 ,则
,则 的平衡分压为标准压强(
的平衡分压为标准压强( )的
)的(4)氟元素可以与很多元素形成化合物,其中氟与氧形成的
 是一种比较稳定的化合物,经测定其键角小于
是一种比较稳定的化合物,经测定其键角小于 的键角,试解释原因
的键角,试解释原因
您最近一年使用:0次
解题方法
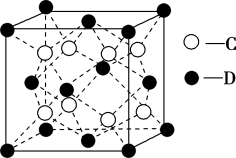
9 . A、B、C、D、E是原子序数依次增大的五种元素,且原子序数均小于30、A的基态原子2p能级有3个电子;C的基态原子2p能级有1个未成对电子;基态D原子的结构示意图为 ;E的原子最外层有1个单电子,其次外层有3个能级且均排满电子。
;E的原子最外层有1个单电子,其次外层有3个能级且均排满电子。
(1)A元素是_________ ,在周期表中的位置是______________ 。
(2)B元素的氢化物在同主族元素的氢化物中沸点最高,原因是________________ 。
(3)A的最简单氢化物分子的空间构型为______ 。
(4)向E的硫酸盐溶液中通入A的最简单氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出深蓝色晶体。
①产生蓝色沉淀的离子方程式是____________________ 。
②深蓝色溶液中的深蓝色是由于存在______________ (填化学式),加入乙醇的目的是____________ 。
(5)C和D形成的化合物甲的晶胞结构如图,甲的化学式是______________ ,晶体中距离D最近的C有_______ 个。已知晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,求晶胞边长a=
,求晶胞边长a=____ cm(用含ρ、 的计算式表示)。
的计算式表示)。
 ;E的原子最外层有1个单电子,其次外层有3个能级且均排满电子。
;E的原子最外层有1个单电子,其次外层有3个能级且均排满电子。(1)A元素是
(2)B元素的氢化物在同主族元素的氢化物中沸点最高,原因是
(3)A的最简单氢化物分子的空间构型为
(4)向E的硫酸盐溶液中通入A的最简单氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出深蓝色晶体。
①产生蓝色沉淀的离子方程式是
②深蓝色溶液中的深蓝色是由于存在
(5)C和D形成的化合物甲的晶胞结构如图,甲的化学式是
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,求晶胞边长a=
,求晶胞边长a= 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题
(1)对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应键角如图所示。
的空间结构和相应键角如图所示。

 的VSEPR模型为
的VSEPR模型为_______ ; 的沸点比
的沸点比 的
的_______ (填写“高”或“低”),原因是_______ ; 的键角小于
的键角小于 的键角,原因是
的键角,原因是_______ 。
(3) 和NaClO均可作化工生产的氧化剂或氯化剂。制备
和NaClO均可作化工生产的氧化剂或氯化剂。制备 的反应为
的反应为 。
。
①上述方程式中涉及的非金属元素电负性由大到小的顺序是_______ (用元素符号表示)。
②常温时 是一种易溶于
是一种易溶于 的液体,则
的液体,则 分子属于
分子属于_______ 分子(填“极性”或“非极性”)。
③配合物 中心离子
中心离子 的配位数为6,向含
的配位数为6,向含 的溶液中滴加
的溶液中滴加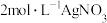 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液
溶液 ,则该配合物的化学式为
,则该配合物的化学式为_______ 。
(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应键角如图所示。
的空间结构和相应键角如图所示。
 的VSEPR模型为
的VSEPR模型为 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的键角,原因是
的键角,原因是(3)
 和NaClO均可作化工生产的氧化剂或氯化剂。制备
和NaClO均可作化工生产的氧化剂或氯化剂。制备 的反应为
的反应为 。
。①上述方程式中涉及的非金属元素电负性由大到小的顺序是
②常温时
 是一种易溶于
是一种易溶于 的液体,则
的液体,则 分子属于
分子属于③配合物
 中心离子
中心离子 的配位数为6,向含
的配位数为6,向含 的溶液中滴加
的溶液中滴加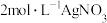 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液
溶液 ,则该配合物的化学式为
,则该配合物的化学式为
您最近一年使用:0次



