名校
解题方法
1 . 某同学欲探究H2O2的氧化还原性:
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,探究H2O2的氧化性可以选取的物质是:___________ (填序号)
①淀粉KI溶液(酸性) ②酸性KMnO4溶液 ③Cl2 ④HNO3溶液
任选一个你所选的物质进行实验,观察到___________ 现象,证明H2O2有氧化性,反应的离子方程式为___________ 。
(2)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有___________ 性,能与H2O2反应产生MnO2
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
(1)该同学从化合价的角度分析H2O2既有氧化性又有还原性,探究H2O2的氧化性可以选取的物质是:
①淀粉KI溶液(酸性) ②酸性KMnO4溶液 ③Cl2 ④HNO3溶液
任选一个你所选的物质进行实验,观察到
(2)继续探究:
资料:Na2O2+2H2O=2NaOH+H2O2、2H2O2=2H2O+O2↑
①制备H2O2:将Na2O2溶于冰水中,产生少量气泡,得溶液A。
向A中加入过量稀H2SO4,得溶液B。
②检验H2O2:向溶液A、B中分别滴加适量KMnO4溶液。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含MnO2,对其产生的原因提出猜想:
猜想1.KMnO4,有氧化性,能被还原为MnO2
猜想2.Mn2+有
猜想3……
③探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i | 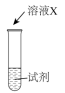 | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii | H2O2溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是MnO2。
综上所述,H2O2体现氧化性还是还原性与反应对象的性质和溶液的酸碱性有关。
您最近一年使用:0次
名校
解题方法
2 . 某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
则以下判断错误的是
| 实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
 | ① |  NaClO溶液 NaClO溶液 | 饱和 溶液 溶液 | 产生白色沉淀,继而转化为棕黑色沉淀 |
| ② |  溶液 溶液 | 光照管壁有无色气泡产生 | ||
| ③ |   酸性溶液和KSCN溶液 酸性溶液和KSCN溶液 | 溶液变红 | ||
| ④ |   溶液 溶液 | 产生白色沉淀 |
A.实验①:发生的反应为 |
B.实验②:无色气体为 |
C.实验③:还原性强弱顺序: |
D.实验④: 与 与 的水解相互促进 的水解相互促进 |
您最近一年使用:0次
名校
3 . 探究 与水的反应,实验如下(实验中加入的溶液均过量):
与水的反应,实验如下(实验中加入的溶液均过量):
已知:i. 是二元弱酸,能电离出
是二元弱酸,能电离出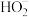 和
和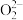
ii.②中发生反应: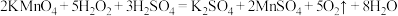
iii. 可以溶解在稀
可以溶解在稀 中
中
下列说法中不正确的是
 与水的反应,实验如下(实验中加入的溶液均过量):
与水的反应,实验如下(实验中加入的溶液均过量):
已知:i.
 是二元弱酸,能电离出
是二元弱酸,能电离出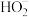 和
和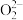
ii.②中发生反应:
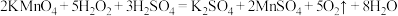
iii.
 可以溶解在稀
可以溶解在稀 中
中下列说法中不正确的是
A.③中生成 的离子反应方程式为 的离子反应方程式为 |
| B.①、⑤中产生的气体能使带火星的木条复燃 |
| C.①、④中均只发生了氧化还原反应 |
D.②、⑤中 与 与 的作用不相同,产生气体的量也不同 的作用不相同,产生气体的量也不同 |
您最近一年使用:0次
名校
解题方法
4 . 实验小组对氯气的制备和性质进行探究。
Ⅰ.实验室制备和收集氯气的常用装置如下图。
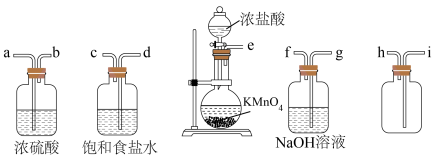
(1)盛放KMnO4固体的仪器名称是___________ 。
(2)实验装置接口的连接顺序为e→____→____→____→____→____→____→g→f,______ 。
(3)在实验过程中饱和食盐水的作用是___________ 。
(4)利用该装置制备氯气的化学方程式为___________ 。
Ⅱ.现利用如下装置进行 的性质探究,并制备家用消毒液(主要成分为
的性质探究,并制备家用消毒液(主要成分为 )。
)。
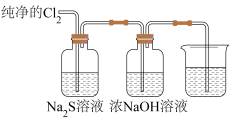
(5)B中出现黄色浑浊现象,产生此现象的离子方程式为________ ,该实验说明了氧化性:
___ S(填“>、<、=”)。
(6)制备家用消毒液的离子方程式为___________ 。
(7)家用消毒液请勿与洁厕灵(主要成分为盐酸)同时使用,否则会产生有毒气体。写出该反应的化学方程式______ 。
Ⅰ.实验室制备和收集氯气的常用装置如下图。

(1)盛放KMnO4固体的仪器名称是
(2)实验装置接口的连接顺序为e→____→____→____→____→____→____→g→f,
(3)在实验过程中饱和食盐水的作用是
(4)利用该装置制备氯气的化学方程式为
Ⅱ.现利用如下装置进行
 的性质探究,并制备家用消毒液(主要成分为
的性质探究,并制备家用消毒液(主要成分为 )。
)。
(5)B中出现黄色浑浊现象,产生此现象的离子方程式为

(6)制备家用消毒液的离子方程式为
(7)家用消毒液请勿与洁厕灵(主要成分为盐酸)同时使用,否则会产生有毒气体。写出该反应的化学方程式
您最近一年使用:0次
名校
5 . 化学教材上提出:当火灾现场存放有大量活泼金属时,不能用水而需要用干燥的沙土来灭火。王老师上课讲到, 能在
能在 中剧烈燃烧。某化学小组对
中剧烈燃烧。某化学小组对 在
在 气体中燃烧的产物进行了实验探究。
气体中燃烧的产物进行了实验探究。
【提出猜想】 与
与 反应可能生成4种物质:
反应可能生成4种物质: 、
、 、
、 和
和
【查阅资料】①向 溶液中通入
溶液中通入 ,能产生黑色沉淀
,能产生黑色沉淀 ;
;
②将酚酞溶液分别滴入 、
、 、
、 、
、 四种溶液中的现象如下:
四种溶液中的现象如下:
【设计实验、验证猜想】某化学小组设计了如图所示装置(部分夹持仪器已略去);
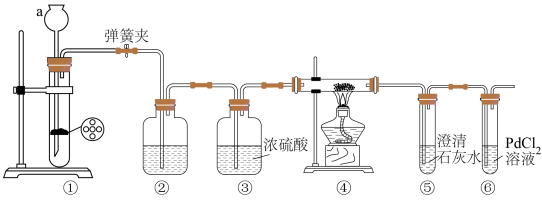
实验步骤及实验记录:
(1)检查装置气密性。装置①气密性检查的方法是___________ ,则装置气密性良好。
(2)装入药品。②中应装入___________ 。
(3)打开弹簧夹,由长颈漏斗注入稀盐酸,①中产生大量气泡,①中反应的离子方程式是___________ 。
(4)当⑤中出现浑浊时,点燃酒精灯。④中 剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有
剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有___________ 。⑥中产生黑色沉淀的化学方程式是___________ 。
(5)关闭弹簧夹,待玻璃管冷却后,拆卸装置。取④中白色固体于试管中,加水完全溶解,再加入过量 溶液,产生白色沉淀,则产物中还有
溶液,产生白色沉淀,则产物中还有___________ 。过滤,向滤液中滴加几滴酚酞溶液,溶液未变红,则产物中不含 。加入过量
。加入过量 溶液的目的是
溶液的目的是___________ 。
【实验讨论】能在 气体中剧烈燃烧。
气体中剧烈燃烧。
(6)若 在
在 气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出
气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出 在
在 气体中燃烧的化学反应方程式
气体中燃烧的化学反应方程式___________ 。
 能在
能在 中剧烈燃烧。某化学小组对
中剧烈燃烧。某化学小组对 在
在 气体中燃烧的产物进行了实验探究。
气体中燃烧的产物进行了实验探究。【提出猜想】
 与
与 反应可能生成4种物质:
反应可能生成4种物质: 、
、 、
、 和
和
【查阅资料】①向
 溶液中通入
溶液中通入 ,能产生黑色沉淀
,能产生黑色沉淀 ;
;②将酚酞溶液分别滴入
 、
、 、
、 、
、 四种溶液中的现象如下:
四种溶液中的现象如下:| 溶液 |  |  |  |  |
| 现象 | 无变化 | 无变化 | 溶液变为红色 | 溶液变为红色 |

实验步骤及实验记录:
(1)检查装置气密性。装置①气密性检查的方法是
(2)装入药品。②中应装入
(3)打开弹簧夹,由长颈漏斗注入稀盐酸,①中产生大量气泡,①中反应的离子方程式是
(4)当⑤中出现浑浊时,点燃酒精灯。④中
 剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有
剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有(5)关闭弹簧夹,待玻璃管冷却后,拆卸装置。取④中白色固体于试管中,加水完全溶解,再加入过量
 溶液,产生白色沉淀,则产物中还有
溶液,产生白色沉淀,则产物中还有 。加入过量
。加入过量 溶液的目的是
溶液的目的是【实验讨论】能在
 气体中剧烈燃烧。
气体中剧烈燃烧。(6)若
 在
在 气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出
气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出 在
在 气体中燃烧的化学反应方程式
气体中燃烧的化学反应方程式
您最近一年使用:0次
6 . Ⅰ.某化学实验小组为了探究在实验室制备 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时证明氯气的某些性质,设计了如图所示的实验装置(氯气易溶于
挥发出来,同时证明氯气的某些性质,设计了如图所示的实验装置(氯气易溶于 ,
, 不溶于
不溶于 )。
)。

回答下列问题:
(1)装置A中发生反应的离子方程式为______ ,装置B中盛放的药品是______ 。
(2)一段时间后,根据装置D与E中出现的不同现象可得出的结论是______ 。
(3)装置F的作用是______ 。
(4)乙同学认为上述实验装置有缺陷,不能确保最终通入 溶液中的气体只有一种,为了确保实验结论的可靠性,乙同学提出可在
溶液中的气体只有一种,为了确保实验结论的可靠性,乙同学提出可在______ (填字母)装置之前再加一个装有湿润的淀粉KI试纸的装置,发生反应的离子方程式为______ 。
Ⅱ.常温下,A是黄绿色单质气体,A、B、C、D、E都含 元素,其转化关系如图所示。
元素,其转化关系如图所示。
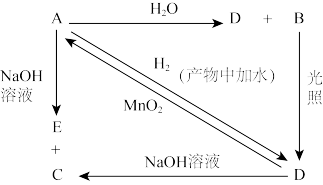
(5)请分别写出A、B、C、D的化学式(如为溶液请填溶质的化学式):A______ 、B______ 、C______ 、D______ 。
(6) 在A中燃烧的现象是
在A中燃烧的现象是______ 。
(7)写出下列反应的化学方程式或离子方程式(请注明条件 ):
①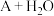 (离子方程式)
(离子方程式) ______ ;
②A+NaOH(离子方程式)______ ;
 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时证明氯气的某些性质,设计了如图所示的实验装置(氯气易溶于
挥发出来,同时证明氯气的某些性质,设计了如图所示的实验装置(氯气易溶于 ,
, 不溶于
不溶于 )。
)。
回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)一段时间后,根据装置D与E中出现的不同现象可得出的结论是
(3)装置F的作用是
(4)乙同学认为上述实验装置有缺陷,不能确保最终通入
 溶液中的气体只有一种,为了确保实验结论的可靠性,乙同学提出可在
溶液中的气体只有一种,为了确保实验结论的可靠性,乙同学提出可在Ⅱ.常温下,A是黄绿色单质气体,A、B、C、D、E都含
 元素,其转化关系如图所示。
元素,其转化关系如图所示。
(5)请分别写出A、B、C、D的化学式(如为溶液请填溶质的化学式):A
(6)
 在A中燃烧的现象是
在A中燃烧的现象是(7)写出下列反应的化学方程式或离子方程式(
①
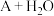 (离子方程式)
(离子方程式) ②A+NaOH(离子方程式)
您最近一年使用:0次
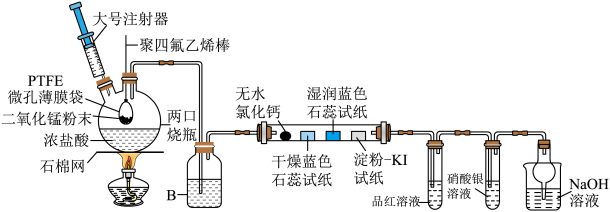
7 . 实验室通常采用二氧化锰与浓盐酸反应来制取氯气,其中最突出的问题在于:一是无法及时终止氯气的继续产生,二是反应后装置内残留的氯气容易外泄。某实验小组设计如图所示装置(夹持仪器已省略)可以有效地解决这些问题。
回答下列问题:
(1)反应开始前在两口烧瓶内加入浓盐酸,将二氧化锰粉末置于PTFE微孔薄膜袋内(利用聚四氟乙烯线将薄膜袋固定在聚四氟乙烯棒上),移动聚四氟乙烯棒使其伸入浓盐酸中,点燃酒精灯(附石棉网),反应的化学方程式为:_________ 。
(2)装置B中加入的试剂为________ ,装置中无水氯化钙的作用是________ 。
(3)对比干燥的蓝色石蕊试纸和湿润的蓝色石蕊试纸出现的现象可得出的结论是_________ 。
(4)通过实验可得, 、
、 、
、 的氧化性由强到弱依次是
的氧化性由强到弱依次是________ 。
(5)硝酸银溶液中发生反应的离子方程式有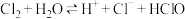 、
、___________ 。
(6)当所有实验结束后,熄灭酒精灯,将聚四氟乙烯棒向上拉起,PTFE微孔薄膜袋脱离浓盐酸,反应终止;最后还需进行的操作是________ 。
(7)若将 通入热的烧碱溶液中,可以得到
通入热的烧碱溶液中,可以得到 、
、 和
和 的混合液。当
的混合液。当 和
和 的物质的量之比为
的物质的量之比为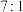 时,混合液中
时,混合液中 和
和 的物质的量之比为
的物质的量之比为________ 。

回答下列问题:
(1)反应开始前在两口烧瓶内加入浓盐酸,将二氧化锰粉末置于PTFE微孔薄膜袋内(利用聚四氟乙烯线将薄膜袋固定在聚四氟乙烯棒上),移动聚四氟乙烯棒使其伸入浓盐酸中,点燃酒精灯(附石棉网),反应的化学方程式为:
(2)装置B中加入的试剂为
(3)对比干燥的蓝色石蕊试纸和湿润的蓝色石蕊试纸出现的现象可得出的结论是
(4)通过实验可得,
 、
、 、
、 的氧化性由强到弱依次是
的氧化性由强到弱依次是(5)硝酸银溶液中发生反应的离子方程式有
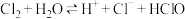 、
、(6)当所有实验结束后,熄灭酒精灯,将聚四氟乙烯棒向上拉起,PTFE微孔薄膜袋脱离浓盐酸,反应终止;最后还需进行的操作是
(7)若将
 通入热的烧碱溶液中,可以得到
通入热的烧碱溶液中,可以得到 、
、 和
和 的混合液。当
的混合液。当 和
和 的物质的量之比为
的物质的量之比为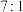 时,混合液中
时,混合液中 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2024-01-30更新
|
71次组卷
|
2卷引用:安徽省阜阳市2023-2024学年高一上学期期末联考化学试卷
名校
解题方法
8 . 为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
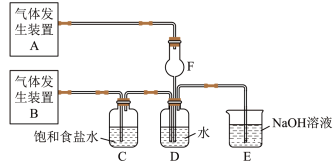
(1) SO2和Cl2通入H2O中发生反应的离子方程式是_______ 。装置E的作用:_______ 。
(2)为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④苯酚溶液 ⑤品红溶液 ⑥酸性高锰酸钾溶液
a.若Cl2过量:取适量装置D中溶液滴入盛有___________ (选填一个序号,下同)的试管内,再加入___________ 试剂,实验现象是___________ 。
b.若SO2过量:取适量装置D中溶液滴入盛有___________ (选填一个序号)的试管内,实验现象是___________ ,再加热,实验现象是___________ 。
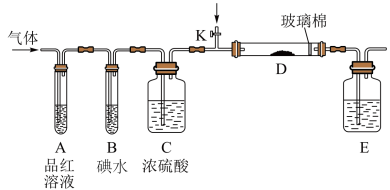
(3)另一小组设计如图所示的装置图(夹持和加热装置略去),分别探究SO2和Cl2的性质。若从左端分别通入SO2和Cl2,硬质玻璃管D中为湿润的pH试纸,观察到的现象是否相同?___________ (填“相同”或“不同”)。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为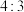 ;当Cl2与含X的溶液(1:1)完全反应后,有黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:
;当Cl2与含X的溶液(1:1)完全反应后,有黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:___________ 。

(1) SO2和Cl2通入H2O中发生反应的离子方程式是
(2)为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④苯酚溶液 ⑤品红溶液 ⑥酸性高锰酸钾溶液
a.若Cl2过量:取适量装置D中溶液滴入盛有
b.若SO2过量:取适量装置D中溶液滴入盛有
(3)另一小组设计如图所示的装置图(夹持和加热装置略去),分别探究SO2和Cl2的性质。若从左端分别通入SO2和Cl2,硬质玻璃管D中为湿润的pH试纸,观察到的现象是否相同?

(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为
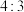 ;当Cl2与含X的溶液(1:1)完全反应后,有黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:
;当Cl2与含X的溶液(1:1)完全反应后,有黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:
您最近一年使用:0次
9 . 次氯酸(HClO)消毒液高效安全,适用于一般物体表面消毒、手部消毒,以及地面、空间和环境消毒。如图,在装置D中制得颜色类似于氯气的 气体,装置E中得到次氯酸(HClO)。已知
气体,装置E中得到次氯酸(HClO)。已知 气体在42℃以上会发生分解,与水反应生成HClO。
气体在42℃以上会发生分解,与水反应生成HClO。 与浓盐酸反应制取氯气的装置,则装置A中发生反应的
与浓盐酸反应制取氯气的装置,则装置A中发生反应的离子方程式 为___________ ,装置A为下图的___________ (填标号)。 与潮湿的碳酸钠反应制备
与潮湿的碳酸钠反应制备 ,为获得干燥纯净的
,为获得干燥纯净的 ,装置B、C中应分别盛放
,装置B、C中应分别盛放___________ 、___________ 。
(3)D中反应生成的 气体进入E装置中生成HClO,该反应的化学方程式为
气体进入E装置中生成HClO,该反应的化学方程式为___________ 。
(4)装置F中盛装的试剂为___________ ,该装置的作用为___________ 。
(5)实验时,需持续通入干燥空气的作用是___________ 。
 气体,装置E中得到次氯酸(HClO)。已知
气体,装置E中得到次氯酸(HClO)。已知 气体在42℃以上会发生分解,与水反应生成HClO。
气体在42℃以上会发生分解,与水反应生成HClO。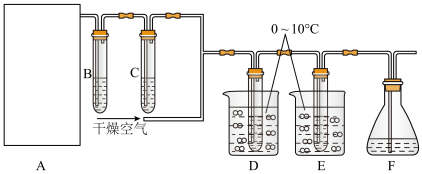
 与浓盐酸反应制取氯气的装置,则装置A中发生反应的
与浓盐酸反应制取氯气的装置,则装置A中发生反应的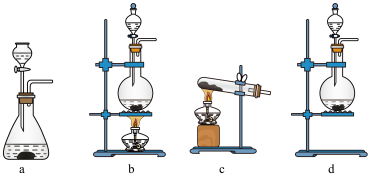
 与潮湿的碳酸钠反应制备
与潮湿的碳酸钠反应制备 ,为获得干燥纯净的
,为获得干燥纯净的 ,装置B、C中应分别盛放
,装置B、C中应分别盛放(3)D中反应生成的
 气体进入E装置中生成HClO,该反应的化学方程式为
气体进入E装置中生成HClO,该反应的化学方程式为(4)装置F中盛装的试剂为
(5)实验时,需持续通入干燥空气的作用是
您最近一年使用:0次
2024-01-29更新
|
46次组卷
|
2卷引用:广东省广州市白云中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
10 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。资料i. 在一定条件下被
在一定条件下被 或
或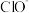 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色);ⅱ.浓碱条件下,
(紫色);ⅱ.浓碱条件下, 可被
可被 还原为
还原为 ;ⅲ.
;ⅲ. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)。
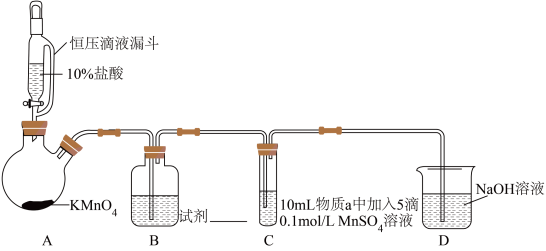
(1)B中试剂是___________ 。
(2)通 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为___________ 。
(3)对比实验I、Ⅱ通 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是___________ 。
(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:________ 。但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入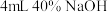 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为________ ,溶液绿色缓慢加深,原因是 被
被________ (填化学式)氧化,可证明Ⅲ中的悬浊液中氧化剂过量。
③取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入 水,溶液紫色缓慢加深,发生的反应是
水,溶液紫色缓慢加深,发生的反应是________ 。
 在一定条件下被
在一定条件下被 或
或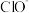 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色);ⅱ.浓碱条件下,
(紫色);ⅱ.浓碱条件下, 可被
可被 还原为
还原为 ;ⅲ.
;ⅲ. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。实验装置如图(夹持装置略)。

| 序号 | 物质a | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 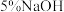 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 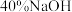 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)B中试剂是
(2)通
 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为(3)对比实验I、Ⅱ通
 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入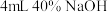 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 被
被③取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入 水,溶液紫色缓慢加深,发生的反应是
水,溶液紫色缓慢加深,发生的反应是
您最近一年使用:0次
2024-01-29更新
|
97次组卷
|
2卷引用:山东省菏泽外国语学校2023-2024学年高三上学期第一次月考化学试卷



