名校
1 . 工业上由黄铜矿(主要成分为CuFeS2)冶炼铜的主要流程如下:

(1)步骤Ⅰ是在反射炉中进行的。把黄铜矿和石英砂混合加热到1 000 ℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是________________ 、________________ 。
(2)步骤Ⅱ是在转炉中发生的。冰铜含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂),在1 200 ℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的泡铜,该过程发生反应的化学方程式分别是__________________ 、__________________ 。气体A中的大气污染物可选用下列试剂中的________ 吸收(填字母)。
a.浓硫酸 b.稀硝酸
c.NaOH溶液 d.氨水
(3)步骤Ⅲ是由泡铜冶炼粗铜的反应,反应方程式为____________________ 。

(1)步骤Ⅰ是在反射炉中进行的。把黄铜矿和石英砂混合加热到1 000 ℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是
(2)步骤Ⅱ是在转炉中发生的。冰铜含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂),在1 200 ℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的泡铜,该过程发生反应的化学方程式分别是
a.浓硫酸 b.稀硝酸
c.NaOH溶液 d.氨水
(3)步骤Ⅲ是由泡铜冶炼粗铜的反应,反应方程式为
您最近一年使用:0次
名校
2 . 工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水。现模拟该过程用图示装置进行实验:
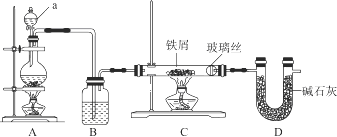
(1)仪器a的名称为________ ,装置A的圆底烧瓶中发生反应的化学方程式为___________ ,为保持装置C为无水环境,装置B中加入的试剂是________ 。
(2)实验步骤:如图连接装置后,先___________ (填实验操作),再点燃_____ 处的酒精灯。(填A或C)
(3)装置D的作用是____________________________ ,____________________________ 。
(4)甲同学认为进入装置C的气体中混有HCl,应在装置B前增加装有________ (填试剂名称)的洗气装置除去;乙同学认为不需要除去HCl,理由为_________________________ 。

(1)仪器a的名称为
(2)实验步骤:如图连接装置后,先
(3)装置D的作用是
(4)甲同学认为进入装置C的气体中混有HCl,应在装置B前增加装有
您最近一年使用:0次
解题方法
3 . 氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理。某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性。
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用)。
查阅资料知:氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl。

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法: 。
(2)气流从左至右,装置接口连接顺序是:
A→ ( )→( )→( )→( )→( )
(3)装置C中干燥管中所盛试剂的名称是: ,作用是: 。
(4)装置C中酒精灯的作用是: 。
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol·L-1酸性KMnO4标准溶液滴定至终点。(已知还原性Fe2+>Cl-)滴定结果如下表所示:
①写出滴定过程中所发生的2个离子方程式:
、
。
②样品中氯化亚铁的质量分数为 。
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用)。
查阅资料知:氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2和HCl。

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法: 。
(2)气流从左至右,装置接口连接顺序是:
A→ ( )→( )→( )→( )→( )
(3)装置C中干燥管中所盛试剂的名称是: ,作用是: 。
(4)装置C中酒精灯的作用是: 。
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol·L-1酸性KMnO4标准溶液滴定至终点。(已知还原性Fe2+>Cl-)滴定结果如下表所示:
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
、
。
②样品中氯化亚铁的质量分数为 。
您最近一年使用:0次
2016-12-09更新
|
283次组卷
|
3卷引用:河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题
2013·河北邯郸·一模
4 . 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) → 2AlCl3+ 3H2。完成下列填空:
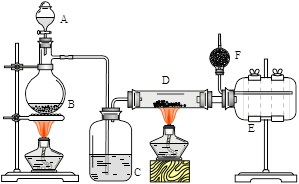
(1)写出B处烧瓶中发生反应的化学方程式:_______________________________________ 。
(2)C中盛有的试剂为__________ 。进行实验时应先点燃_____ (选填“B”或“D”)处酒精灯。
(3) 用粗短导管连接D、E的目的是_________ (选填序号)。
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
E瓶的作用是_______________________________________________________ 。
(4)F中盛有碱石灰,其目的是_________ (选填序号)。
a. 吸收HCl b. 吸收Cl2c. 吸收CO2d. 吸收H2O
(5)①将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_____________________________________________ 。
②若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______ 。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变,也能制备无水AlCl3。事实证明这样做比较危险,请简述理由_________________________ 。

(1)写出B处烧瓶中发生反应的化学方程式:
(2)C中盛有的试剂为
(3) 用粗短导管连接D、E的目的是
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
E瓶的作用是
(4)F中盛有碱石灰,其目的是
a. 吸收HCl b. 吸收Cl2c. 吸收CO2d. 吸收H2O
(5)①将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是
②若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变,也能制备无水AlCl3。事实证明这样做比较危险,请简述理由
您最近一年使用:0次
5 . 苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应和水解反应的原理,可以进行苯甲酸甲酯的合成和皂化反应。有关物质的物理性质见下表所示:
Ⅰ.苯甲酸甲酯的合成和提纯
相关的实验步骤为:
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应
第二步:水洗提纯
第三步:蒸馏提纯
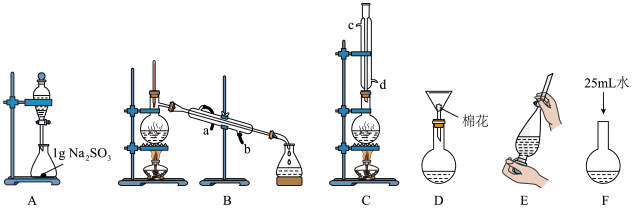
(1)上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字母)_________ 。
(2)C装置中除了装有15g苯甲酸和20mL过量的甲醇外还需要_________ ,_________ 。
(3)C装置中冷凝管的作用是____________ ,A装置中固体Na2CO3作用是_________ 。
Ⅱ.苯甲酸甲酯的皂化反应,装置依次是G、H、I。

(4)能说明G装置中反应完全的现象是________________________ 。
(5)在Ⅱ中得到白色固体的质量为5g。假设反应I和反应Ⅱ中:蒸馏提纯的效率为66.7%,加浓盐酸苯甲酸钠生成白色固体的转化率为80%,酯化反应中苯甲酸的转化率为X。其他步骤的转化效率为100%。则X=______________ 。
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
相关的实验步骤为:
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应
第二步:水洗提纯
第三步:蒸馏提纯

(1)上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字母)
(2)C装置中除了装有15g苯甲酸和20mL过量的甲醇外还需要
(3)C装置中冷凝管的作用是
Ⅱ.苯甲酸甲酯的皂化反应,装置依次是G、H、I。

(4)能说明G装置中反应完全的现象是
(5)在Ⅱ中得到白色固体的质量为5g。假设反应I和反应Ⅱ中:蒸馏提纯的效率为66.7%,加浓盐酸苯甲酸钠生成白色固体的转化率为80%,酯化反应中苯甲酸的转化率为X。其他步骤的转化效率为100%。则X=
您最近一年使用:0次



