解题方法
1 . 钒、钛、铝组成的金属合金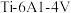 常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为
常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为 ,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下:
,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下:
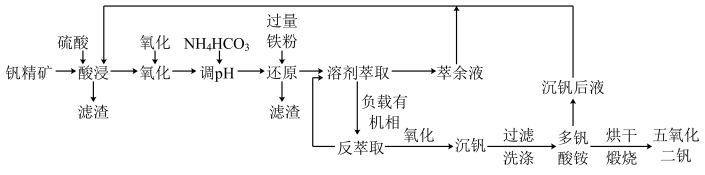
已知:①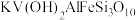 中
中 为
为 价。
价。
②“氧化”后的溶液中钒以 存在,反萃取后的溶液中钒以
存在,反萃取后的溶液中钒以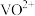 存在。
存在。
③ 为萃取剂。
为萃取剂。
回答下列问题:
(1)将钒精矿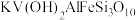 写成氧化物的形式
写成氧化物的形式____________________________ 。
(2)写出“氧化”过程中反应的离子方程式____________________________ 。
(3)加入 调节溶液
调节溶液 的目的是
的目的是____________________________ 。
(4)“还原”过程中主要反应的离子反应方程式为____________________________ 。
(5)为了提高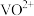 的产率,反萃取剂应该呈
的产率,反萃取剂应该呈_________ (填“酸性”“碱性”或“中性”)。
(6)若用氧化剂 “氧化沉钒”时,生成
“氧化沉钒”时,生成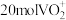 ,至少需要
,至少需要
_________ 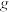 。
。
(7)写出煅烧多钒酸铵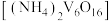 的化学反应方程式
的化学反应方程式__________________ 。
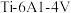 常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为
常用于飞机发动机、宇航船舱骨架、导弹、军舰的水翼等。钒精矿可表示为 ,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下:
,还含有其他难溶硫酸盐杂质。“萃取”钒工艺流程路线图如下:
已知:①
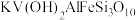 中
中 为
为 价。
价。②“氧化”后的溶液中钒以
 存在,反萃取后的溶液中钒以
存在,反萃取后的溶液中钒以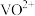 存在。
存在。③
 为萃取剂。
为萃取剂。回答下列问题:
(1)将钒精矿
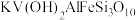 写成氧化物的形式
写成氧化物的形式(2)写出“氧化”过程中反应的离子方程式
(3)加入
 调节溶液
调节溶液 的目的是
的目的是(4)“还原”过程中主要反应的离子反应方程式为
(5)为了提高
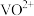 的产率,反萃取剂应该呈
的产率,反萃取剂应该呈(6)若用氧化剂
 “氧化沉钒”时,生成
“氧化沉钒”时,生成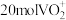 ,至少需要
,至少需要
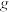 。
。(7)写出煅烧多钒酸铵
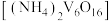 的化学反应方程式
的化学反应方程式
您最近一年使用:0次
解题方法
2 . 实验室中,可由钙在纯氧下加热制得 ,反应装置如图所示,关于实验操作或叙述错误的是
,反应装置如图所示,关于实验操作或叙述错误的是
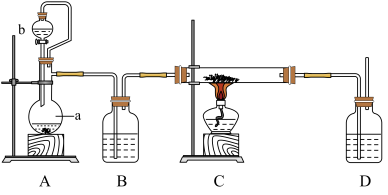
 ,反应装置如图所示,关于实验操作或叙述错误的是
,反应装置如图所示,关于实验操作或叙述错误的是
| A.若a中装有少量二氧化锰固体,则b中试剂为过氧化氢溶液 |
| B.打开分液漏斗活塞,当A中产生的气体充满整个装置后,再点燃C处酒精灯 |
C.反应结束后,将装置C中所得固体物质加入过量水中,有无色无味气体生成,说明C中所得固体全部为 |
| D.装置D中装有的浓硫酸可以防止空气中的水蒸气和二氧化碳进入C中 |
您最近一年使用:0次
3 . 过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).___ ,反应过程中持续通入氮气的目的是___ 。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___ 。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___ 。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
①在___ (填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___ 。
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___ ;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2 )。
)。
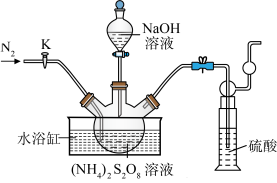
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH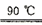 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在
②中性氧化时,会产生大量气泡,其原因为
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
 )。
)。
您最近一年使用:0次
2020-06-06更新
|
486次组卷
|
4卷引用:河北省邯郸市2020届高三第一次模拟考试理科综合化学试题
解题方法
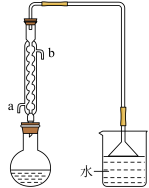
4 . 溴乙烷是无色油状液体沸点为38.4℃,难溶于水,能溶于多种有机溶剂.以NaBr固体、C2H5OH、浓H2SO4、水为原料,对反应后的混合液微热可在烧杯中得到粗产品(溴乙烷),反应装置如图(已略去夹持和加热装置),反应原理:①NaBr+H2SO4(浓)=NaHSO4+HBr;②CH3CH2OH+HBr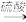 CH3CH2Br+H2O。下列有关说法正确的是( )
CH3CH2Br+H2O。下列有关说法正确的是( )
 CH3CH2Br+H2O。下列有关说法正确的是( )
CH3CH2Br+H2O。下列有关说法正确的是( )
| A.烧瓶中试剂加入的先后顺序:浓硫酸、水、溴化钠、乙醇 |
B.可用 装置代替倒置漏斗装置 装置代替倒置漏斗装置 |
| C.冷凝水从b口进a口出 |
| D.粗产品经水洗涤、蒸发结晶得到纯净的溴乙烷 |
您最近一年使用:0次
名校
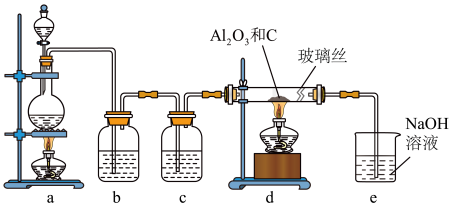
5 . 在一定条件下,向 和过量C粉的混合物中通入氯气,可制得易水解的
和过量C粉的混合物中通入氯气,可制得易水解的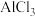 ,实验装置如图所示。下列说法不正确的是
,实验装置如图所示。下列说法不正确的是 

 和过量C粉的混合物中通入氯气,可制得易水解的
和过量C粉的混合物中通入氯气,可制得易水解的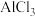 ,实验装置如图所示。下列说法不正确的是
,实验装置如图所示。下列说法不正确的是 


| A.c中盛装的是浓硫酸 |
| B.实验结束时,应先熄灭d处酒精灯,待装置冷却后再熄灭a处酒精灯 |
| C.此反应中的尾气除氯气外都可直接排放到大气中 |
| D.该装置不完善,其中应改进的一项是在d、e之间添加一个干燥装置 |
您最近一年使用:0次
2020-01-27更新
|
96次组卷
|
7卷引用:河北省大名县第一中学(清北班,一)2020届高三9月月考化学试题
河北省大名县第一中学(清北班,一)2020届高三9月月考化学试题【全国市级联考】河北省唐山市2018届高三第三次模拟考试理综化学试题(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础备考突破2020高三化学专题强化集训——基于气体的实验流程题(已下线)专题3.2 铝及其重要化合物(练)——2020年高考化学一轮复习讲练测重庆市第七中学校2020-2021学年高一上学期12月月考化学试题新疆 乌鲁木齐市第十二中学2023-2024学年高一上学期1月期末化学试题
名校
6 . 硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为加快反应速率,提高镍元素的浸出率,可以采取的措施有:________ 。
(2)“滤渣Ⅰ”的主要成分为__ (填化学式),该物质在工业上的用途为_________ (任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,其目的是_________ 。
(4)“氨解”发生反应的离子方程式为________ 。“净化”时通入H2S的目的是_______ 。
(5)“氧化”时发生反应的化学方程式为_________ 。
(6)“系列操作”具体是指_________ 、过滤、洗涤、干燥。

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为加快反应速率,提高镍元素的浸出率,可以采取的措施有:
(2)“滤渣Ⅰ”的主要成分为
(3)“一次碱析”时,加入的NaOH溶液需过量,其目的是
(4)“氨解”发生反应的离子方程式为
(5)“氧化”时发生反应的化学方程式为
(6)“系列操作”具体是指
您最近一年使用:0次
2019-10-29更新
|
279次组卷
|
2卷引用:河北省大名县第一中学2020届高三11月月考(重点班)化学试题
7 . 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③ ,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是____ 。
(2)写出实验步骤②中的化学方程式____ 。
(3)补全实验步骤③的操作名称____ 。
(4)实验步骤④中用少量冰水洗涤晶体,其目的是___ 。
(5)乙同学认为甲的实验方案中存在明显的不合理之处,你___ (填“是”或“否”)同意乙的观点。
(6)丙同学经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为___ 。
(7)取已有部分氧化的绿矾固体(硫酸亚铁的相对原子质量用M表示)wg,配制成100mL用cmol/L KMnO4标准溶液滴定,终点时消耗标准液的体积为VmL,则:若在滴定终点读取滴定管读数时,俯视滴定管液面,使测定结果___ (填“偏高”、“偏低”或“无影响”)
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③ ,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是
(2)写出实验步骤②中的化学方程式
(3)补全实验步骤③的操作名称
(4)实验步骤④中用少量冰水洗涤晶体,其目的是
(5)乙同学认为甲的实验方案中存在明显的不合理之处,你
(6)丙同学经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
温度/ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶度积/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为
(7)取已有部分氧化的绿矾固体(硫酸亚铁的相对原子质量用M表示)wg,配制成100mL用cmol/L KMnO4标准溶液滴定,终点时消耗标准液的体积为VmL,则:若在滴定终点读取滴定管读数时,俯视滴定管液面,使测定结果
您最近一年使用:0次
8 . PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。
(1)仪器乙的名称是________ ;其中,与自来水进水管连接的接口编号是________ 。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________ 。实验过程中,为减少PCl5的生成,应控制____________ 。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________ 。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________ 。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________ 。若滴定终点时俯视读数,则PCl3的质量分数________ (填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________ 。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)
| 熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量)  2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量)  2PCl5 2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。
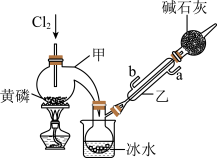
(1)仪器乙的名称是
(2)实验室制备Cl2的离子方程式
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为
(三)探究
(6)设计实验证明PCl3具有还原性:
您最近一年使用:0次
2019-10-02更新
|
129次组卷
|
2卷引用:河北省大名县第一中学(清北班,一)2020届高三9月月考化学试题
9 . 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)B装置有三种功能:①控制气流速度; ②均匀混合气体; ③____________ 。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x取值范围________ 。
(3)E装置的作用是________ (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________ 。
(5)E装置中除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________ 。
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________ (填编号)。
A CH4 B CH3Cl C CH2Cl2 D CHCl3 E CCl4

根据设计要求回答:
(1)B装置有三种功能:①控制气流速度; ②均匀混合气体; ③
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x取值范围
(3)E装置的作用是
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:
(5)E装置中除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为
A CH4 B CH3Cl C CH2Cl2 D CHCl3 E CCl4
您最近一年使用:0次
解题方法
10 . Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O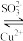 Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______ 。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:____ Cu2++ ____ SO32-+ ____ =____ Cu2O↓+ ____ + ____ HSO3-
【实验探究】
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______ 。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______ 。
(5)iii中砖红色沉淀消失的原因是_______ 。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______ 。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______ 、_______ 。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O
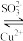 Cu(SO3)23-(无色)
Cu(SO3)23-(无色) (1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:
【实验探究】
| 操作 | 现象 |
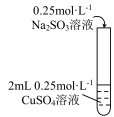 | i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是
(5)iii中砖红色沉淀消失的原因是
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是
您最近一年使用:0次



