解题方法
1 . 钛和钛合金被认为是21世纪的重要金属材料,广泛用于火箭、飞机制造业等。工业上利用钛铁矿制备金属钛的工艺流程示意图如下:
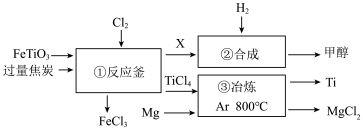
下列说法正确的是

下列说法正确的是
A.①反应釜中生成物X的电子式为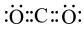 |
| B.FeCl3和TiCl4的沸点相差大,实验室可以使用分液法进行分离 |
| C.②是原子利用率100%的反应,则每得到1mol甲醇转移电子数4NA |
| D.③反应类型为置换反应,其中Ar作保护气,也可以换为N2 |
您最近一年使用:0次
解题方法
2 . 对羟基苯甲酸酯是一类高效低毒的新一代消毒杀菌防腐剂,它的抗菌能力比苯甲酸和山梨酸及其盐类强。利用如图装置制备并提纯对羟基苯甲酸乙酯,相关有机物的物理性质如表所示。

实验步骤:
①在装置A中加入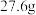 对羟基苯甲酸、
对羟基苯甲酸、 乙醇和
乙醇和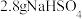 (作催化剂),放入磁力搅拌子,开动搅拌器,在
(作催化剂),放入磁力搅拌子,开动搅拌器,在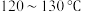 下反应
下反应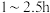 ;
;
②反应结束后,将反应后液体转移至装置D中,用图2装置进行水蒸气蒸馏,蒸馏余液倒入干净的烧杯内,冷却析晶,用质量分数为 的碳酸氢钠溶液洗涤晶体至洗涤液
的碳酸氢钠溶液洗涤晶体至洗涤液 为7.5~8.0,用图3装置抽滤,用蒸馏水冲洗滤饼,干燥,得到白色固体产品对羟基苯甲酸乙酯。
为7.5~8.0,用图3装置抽滤,用蒸馏水冲洗滤饼,干燥,得到白色固体产品对羟基苯甲酸乙酯。
请回答下列问题:
(1)仪器B的名称为___________ 。
(2)写出制备对羟基苯甲酸乙酯的化学方程式:___________ ,在此实验中,一般加入的乙醇稍微过量,原因是___________ 。
(3)图2中,加热装置C产生水蒸气,该装置中玻璃管的作用为___________ ,用水蒸气蒸馏可除去的物质是___________ 。
(4)用碳酸氢钠溶液洗涤晶体是为了除去杂质___________ ,检验晶体是否洗涤干净的操作为___________ 。
(5)经干燥后,得到对羟基苯甲酸乙酯约 ,则对羟基苯甲酸乙酯的产率为
,则对羟基苯甲酸乙酯的产率为___________ (保留三位有效数字)。
| 物质 | 相对分子质量 | 密度/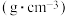 | 熔点/ | 沸点/ | 常温下状态 | 溶解性 |
| 对羟基苯甲酸 | 138 | 1.46 | 214~216 | 336 | 固态 | 微溶于水,易溶于热水和乙醇、乙醚等 |
| 乙醇 | 46 | 0.79 | 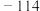 | 78 | 液态 | 与水混溶,可混溶于乙醚等 |
| 对羟基苯甲酸乙酯 | 166 | 1.08 | 116~118 | 固态 | 微溶于水,易溶于乙醇等 |

实验步骤:
①在装置A中加入
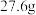 对羟基苯甲酸、
对羟基苯甲酸、 乙醇和
乙醇和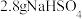 (作催化剂),放入磁力搅拌子,开动搅拌器,在
(作催化剂),放入磁力搅拌子,开动搅拌器,在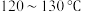 下反应
下反应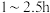 ;
;②反应结束后,将反应后液体转移至装置D中,用图2装置进行水蒸气蒸馏,蒸馏余液倒入干净的烧杯内,冷却析晶,用质量分数为
 的碳酸氢钠溶液洗涤晶体至洗涤液
的碳酸氢钠溶液洗涤晶体至洗涤液 为7.5~8.0,用图3装置抽滤,用蒸馏水冲洗滤饼,干燥,得到白色固体产品对羟基苯甲酸乙酯。
为7.5~8.0,用图3装置抽滤,用蒸馏水冲洗滤饼,干燥,得到白色固体产品对羟基苯甲酸乙酯。请回答下列问题:
(1)仪器B的名称为
(2)写出制备对羟基苯甲酸乙酯的化学方程式:
(3)图2中,加热装置C产生水蒸气,该装置中玻璃管的作用为
(4)用碳酸氢钠溶液洗涤晶体是为了除去杂质
(5)经干燥后,得到对羟基苯甲酸乙酯约
 ,则对羟基苯甲酸乙酯的产率为
,则对羟基苯甲酸乙酯的产率为
您最近一年使用:0次
名校
3 . 实验室以锈蚀程度很大的废铁屑为原料制备FeCl3·6H2O晶体的流程可简要表示如下:
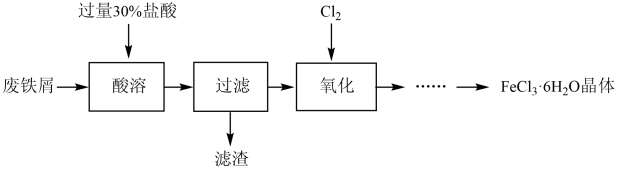
已知:在水溶液中Fe2+能与K3Fe(CN)6反应生成蓝色沉淀Fe3[Fe(CN)6]2,而Fe3+则不能。
回答下列问题:
(1)酸溶”过程中发生的主要反应有:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、________ (用离子方程式表示)。
(2)“酸溶”需控制温度在40℃左右,最佳的加热方式为_____________ 。
(3)“氧化”过程可在如图所示装置中进行。
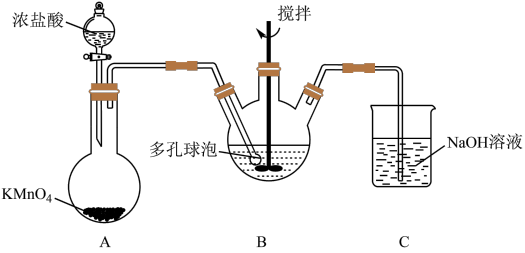
①写出装置B中发生的主要反应的离子方程式____________________________ 。
②为了使Cl2能充分反应,除在B中使用多孔球泡和搅拌外,实验中还可采取的措施是______________ 。
③证明装置B溶液中的Fe2+已经完全被氧化为Fe3+的实验方案为____________________ 。
④装置C的作用是________________ 。

已知:在水溶液中Fe2+能与K3Fe(CN)6反应生成蓝色沉淀Fe3[Fe(CN)6]2,而Fe3+则不能。
回答下列问题:
(1)酸溶”过程中发生的主要反应有:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、
(2)“酸溶”需控制温度在40℃左右,最佳的加热方式为
(3)“氧化”过程可在如图所示装置中进行。

①写出装置B中发生的主要反应的离子方程式
②为了使Cl2能充分反应,除在B中使用多孔球泡和搅拌外,实验中还可采取的措施是
③证明装置B溶液中的Fe2+已经完全被氧化为Fe3+的实验方案为
④装置C的作用是
您最近一年使用:0次
2023-04-25更新
|
115次组卷
|
2卷引用:河北省邯郸市大名县第一中学2022-2023学年高一下学期5月月考化学试题
名校
解题方法
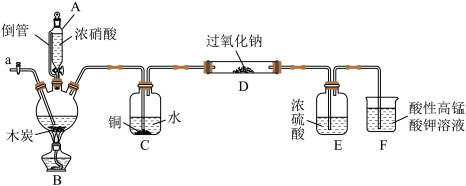
4 . 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。某兴趣小组利用如图装置(夹持及加热装置已省略)制备NaNO2。
已知:①室温下, 、
、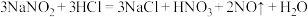
②酸性条件下, 和
和 与
与 反应生成
反应生成 和
和 ;
;
③C中铜过量。
回答下列问题:
(1)仪器A侧管的作用是______ 。
(2)写出B装置中的三颈烧瓶内化学方程式:______ ,C装置的作用为______ ,C装置中涉及的化学反应为______ (写一个化学方程式)。
(3)检验D中产物是否有亚硝酸钠的方法是______ 、F装置的作用为______ 。
(4)预测 中反应开始阶段,固体产物除
中反应开始阶段,固体产物除 外,还含副产物
外,还含副产物 和
和 ,为避免产生这些副产物,应在C、D装置间增加装置
,为避免产生这些副产物,应在C、D装置间增加装置 ,则
,则 中盛放的试剂名称为
中盛放的试剂名称为______ 。
(5)测定NaNO2的纯度:准确称取反应后的固体3.00g于烧杯中,加入煮沸并冷却的蒸水溶解,配成 的溶液;取出
的溶液;取出 于锥形瓶中,加入
于锥形瓶中,加入 的酸性高锰酸钾溶液至刚好反应完全,用去
的酸性高锰酸钾溶液至刚好反应完全,用去 的酸性
的酸性 溶液。则测得固体中
溶液。则测得固体中 的纯度为
的纯度为______ 。

已知:①室温下,
 、
、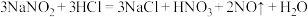
②酸性条件下,
 和
和 与
与 反应生成
反应生成 和
和 ;
;③C中铜过量。
回答下列问题:
(1)仪器A侧管的作用是
(2)写出B装置中的三颈烧瓶内化学方程式:
(3)检验D中产物是否有亚硝酸钠的方法是
(4)预测
 中反应开始阶段,固体产物除
中反应开始阶段,固体产物除 外,还含副产物
外,还含副产物 和
和 ,为避免产生这些副产物,应在C、D装置间增加装置
,为避免产生这些副产物,应在C、D装置间增加装置 ,则
,则 中盛放的试剂名称为
中盛放的试剂名称为(5)测定NaNO2的纯度:准确称取反应后的固体3.00g于烧杯中,加入煮沸并冷却的蒸水溶解,配成
 的溶液;取出
的溶液;取出 于锥形瓶中,加入
于锥形瓶中,加入 的酸性高锰酸钾溶液至刚好反应完全,用去
的酸性高锰酸钾溶液至刚好反应完全,用去 的酸性
的酸性 溶液。则测得固体中
溶液。则测得固体中 的纯度为
的纯度为
您最近一年使用:0次
解题方法
5 . 某化学兴趣小组利用如图所示实验装置(夹持及加热装置省略)在实验室制备 并测定其纯度。
并测定其纯度。

回答下列问题:
(1)与分液漏斗相比,使用滴液漏斗a的优点是___________ 。
(2)装置B中发生反应的离子方程式为___________ 。
(3)若装置B温度控制不当会有 生成,且反应生成的
生成,且反应生成的 、
、 的物质的量均为
的物质的量均为 ,则消耗的
,则消耗的 的物质的量为
的物质的量为___________ mol。
(4)某同学认为该装置设计有缺陷,改进措施为___________ ,否则会使产率偏低。
(5)测定所得 样品的纯度:该小组同学认为可以利用一定质量
样品的纯度:该小组同学认为可以利用一定质量 样品与过量
样品与过量 在酸性条件下发生反应,再以淀粉溶液为指示剂,用
在酸性条件下发生反应,再以淀粉溶液为指示剂,用 标准溶液滴定产生的
标准溶液滴定产生的 测定
测定 样品的纯度。
样品的纯度。
①预设滴定终点时溶液的颜色为___________ 。
②在接近滴定终点时,使用“半滴操作”可提高测定的准确度,其操作方法是将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,___________ (请在横线上补全操作),继续摇动锥形瓶,观察溶液颜色变化。
③在方案可行性分析时,实验发现在 溶液和稀硫酸的混合溶液中加入
溶液和稀硫酸的混合溶液中加入 溶液,最终得到了无色溶液而没有得到预设中的碘溶液,可能的原因是
溶液,最终得到了无色溶液而没有得到预设中的碘溶液,可能的原因是___________ 。
④有同学提出可以使用质量分析法测定 样品的纯度:称量
样品的纯度:称量 样品mg、
样品mg、 ng,混合加热至质量不再改变,剩余固体质量为pg,则样品中
ng,混合加热至质量不再改变,剩余固体质量为pg,则样品中 的纯度为
的纯度为___________ (用含m、n、p的代数式表达)。
 并测定其纯度。
并测定其纯度。
回答下列问题:
(1)与分液漏斗相比,使用滴液漏斗a的优点是
(2)装置B中发生反应的离子方程式为
(3)若装置B温度控制不当会有
 生成,且反应生成的
生成,且反应生成的 、
、 的物质的量均为
的物质的量均为 ,则消耗的
,则消耗的 的物质的量为
的物质的量为(4)某同学认为该装置设计有缺陷,改进措施为
(5)测定所得
 样品的纯度:该小组同学认为可以利用一定质量
样品的纯度:该小组同学认为可以利用一定质量 样品与过量
样品与过量 在酸性条件下发生反应,再以淀粉溶液为指示剂,用
在酸性条件下发生反应,再以淀粉溶液为指示剂,用 标准溶液滴定产生的
标准溶液滴定产生的 测定
测定 样品的纯度。
样品的纯度。①预设滴定终点时溶液的颜色为
②在接近滴定终点时,使用“半滴操作”可提高测定的准确度,其操作方法是将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,
③在方案可行性分析时,实验发现在
 溶液和稀硫酸的混合溶液中加入
溶液和稀硫酸的混合溶液中加入 溶液,最终得到了无色溶液而没有得到预设中的碘溶液,可能的原因是
溶液,最终得到了无色溶液而没有得到预设中的碘溶液,可能的原因是④有同学提出可以使用质量分析法测定
 样品的纯度:称量
样品的纯度:称量 样品mg、
样品mg、 ng,混合加热至质量不再改变,剩余固体质量为pg,则样品中
ng,混合加热至质量不再改变,剩余固体质量为pg,则样品中 的纯度为
的纯度为
您最近一年使用:0次
名校
解题方法
6 . 环己烯是重要的化工原料。其实验室制备流程如下:

回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)“操作1”的装置如图所示(加热和夹持装置已略去)。

烧瓶A中的化学方程式为_______ 。
(2)下列玻璃仪器中,“操作2”需使用的有_______ (填标号),不需使用的有_______ (填名称)。
A. B.
B. C.
C. D.
D.
(3)在安装蒸馏装置时,仪器选择及安装都正确的是_______ 。
a. b.
b. c.
c. d.
d.
Ⅱ.环己烯含量的测定
在一定条件下,向ag环己烯样品中加入定量制得的x mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,以淀粉溶液为指示剂,用y mol/L的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液w mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应为:①Br2+

 ②
② ③
③
(4)判断达到滴定终点的现象是_______ ;样品中环己烯的质量分数为_______ (用字母表示)。
(5)下列情况会导致测定结果偏低的是_______ (填序号)。
a.样品中含有苯酚杂质 b.在测定过程中部分环己烯挥发 c.Na2S2O3标准溶液部分被氧化

回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)“操作1”的装置如图所示(加热和夹持装置已略去)。

烧瓶A中的化学方程式为
(2)下列玻璃仪器中,“操作2”需使用的有
A.
 B.
B. C.
C. D.
D.
(3)在安装蒸馏装置时,仪器选择及安装都正确的是
a.
 b.
b. c.
c. d.
d.
Ⅱ.环己烯含量的测定
在一定条件下,向ag环己烯样品中加入定量制得的x mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,以淀粉溶液为指示剂,用y mol/L的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液w mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应为:①Br2+


 ②
② ③
③
(4)判断达到滴定终点的现象是
(5)下列情况会导致测定结果偏低的是
a.样品中含有苯酚杂质 b.在测定过程中部分环己烯挥发 c.Na2S2O3标准溶液部分被氧化
您最近一年使用:0次
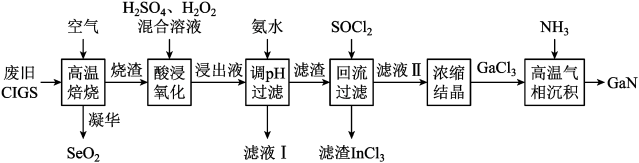
7 . 废旧太阳能电池 具有较高的回收利用价值,其主要组成为
具有较高的回收利用价值,其主要组成为 。某探究小组回收处理流程如图:
。某探究小组回收处理流程如图:
回答下列问题:
(1)硒(Se)与硫为同族元素,基态Se原子的简化电子排布式为_______ ;镓(Ga)和铟(In)位于元素周期表第ⅢA族,属于_______ 区;基态Cu原子的价电子排布图为_______ 。
(2)高温焙烧得到的烧渣主要成分是氧化物,则“酸浸氧化”发生的主要氧化还原反应的离子方程式为_______ 。
(3)滤液Ⅰ中所含金属元素名称为_______ 。
(4)“回流过滤”中加入的 是一种液态化合物,极易与水反应,写出
是一种液态化合物,极易与水反应,写出 与水反应的化学反应方程式
与水反应的化学反应方程式_______ ; 的作用是将氢氧化物转化为氯化物和
的作用是将氢氧化物转化为氯化物和_______ 。
(5)如图表示氮化镓与铜组装成的人工光合系统的电池工作原理。电池工作时 向
向_______ (填“左”或“右”)池移动;当电路中转移1.6 电子时,电池中液体质量
电子时,电池中液体质量_______ (填“增重”还是“减轻”)_______ g。

 具有较高的回收利用价值,其主要组成为
具有较高的回收利用价值,其主要组成为 。某探究小组回收处理流程如图:
。某探究小组回收处理流程如图:
回答下列问题:
(1)硒(Se)与硫为同族元素,基态Se原子的简化电子排布式为
(2)高温焙烧得到的烧渣主要成分是氧化物,则“酸浸氧化”发生的主要氧化还原反应的离子方程式为
(3)滤液Ⅰ中所含金属元素名称为
(4)“回流过滤”中加入的
 是一种液态化合物,极易与水反应,写出
是一种液态化合物,极易与水反应,写出 与水反应的化学反应方程式
与水反应的化学反应方程式 的作用是将氢氧化物转化为氯化物和
的作用是将氢氧化物转化为氯化物和(5)如图表示氮化镓与铜组装成的人工光合系统的电池工作原理。电池工作时
 向
向 电子时,电池中液体质量
电子时,电池中液体质量
您最近一年使用:0次
8 . 草酸亚铁晶体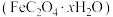 是一种浅黄色固体,难溶于水。某课题组制备草酸亚铁晶体并验证其化学性质。回答下列问题:
是一种浅黄色固体,难溶于水。某课题组制备草酸亚铁晶体并验证其化学性质。回答下列问题:
(1)制备草酸亚铁晶体,所用装置(夹持仪器已省略)如图所示。
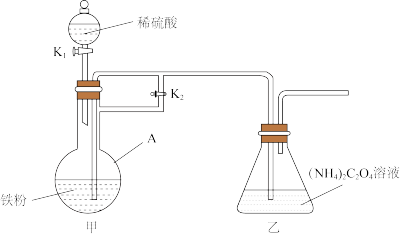
①仪器A的名称为_________ 。
②装置甲中生成物的作用是_________ 、_________ 。
③草酸亚铁在装置乙中生成,简述实验操作:_________ 。
(2)验证草酸亚铁晶体分解产物中含有 、
、 ,实验装置如图。
,实验装置如图。

①装置连接顺序为C→_________ (填字母符号,装置可重复使用)。
②证明分解产物中有 的现象是
的现象是_________ 。
③若装置C中固体变为红色,写出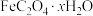 分解反应化学方程式:
分解反应化学方程式:_________ 。
④若验证 、
、 并同时测定
并同时测定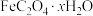 中x的值,则装置连接顺序和需要已知条件分别是
中x的值,则装置连接顺序和需要已知条件分别是_________ 、_________ 。
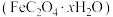 是一种浅黄色固体,难溶于水。某课题组制备草酸亚铁晶体并验证其化学性质。回答下列问题:
是一种浅黄色固体,难溶于水。某课题组制备草酸亚铁晶体并验证其化学性质。回答下列问题:(1)制备草酸亚铁晶体,所用装置(夹持仪器已省略)如图所示。

①仪器A的名称为
②装置甲中生成物的作用是
③草酸亚铁在装置乙中生成,简述实验操作:
(2)验证草酸亚铁晶体分解产物中含有
 、
、 ,实验装置如图。
,实验装置如图。
①装置连接顺序为C→
②证明分解产物中有
 的现象是
的现象是③若装置C中固体变为红色,写出
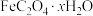 分解反应化学方程式:
分解反应化学方程式:④若验证
 、
、 并同时测定
并同时测定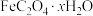 中x的值,则装置连接顺序和需要已知条件分别是
中x的值,则装置连接顺序和需要已知条件分别是
您最近一年使用:0次
2022-11-25更新
|
175次组卷
|
4卷引用:河北省邯郸市部分学校2022-2023学年高三上学期11月月考化学试题
名校
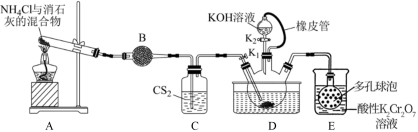
9 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用逾广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
已知① 不溶于水,密度比水的大;②
不溶于水,密度比水的大;② 不于
不于 ;③硫氧化钾熔点172℃;④三颈烧瓶内盛放有
;③硫氧化钾熔点172℃;④三颈烧瓶内盛放有 、水和催化剂,回答下列问题:
、水和催化剂,回答下列问题:
Ⅰ、制餐NH4SCN溶液:
(1)实验前,检查装置气密性良好后,装入药品。装置B中的试剂是___________ ;三颈烧瓶的下层 液体必须浸没导气管口,目的是
液体必须浸没导气管口,目的是___________ 。
(2)实验开始时,打开K1,加热装置A、D.将A中产生的气体缓缓通入D中,发生反应 (该反应比较缓慢)当看到
(该反应比较缓慢)当看到___________ 现象时说明该反应接近完全。
Ⅱ、制备KSCN溶液:
(3)熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当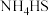 完全分解后(
完全分解后(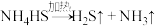 ),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为___________ 。
(4)装置E可用于处理尾气,多孔球泡的作用是:___________ 。已知酸性重铬酸钾溶液能将 氧化生成浅黄色沉淀,铬元素被还原为
氧化生成浅黄色沉淀,铬元素被还原为 ,写出其氧化
,写出其氧化 的离子方程式
的离子方程式___________ 。
Ⅲ、制备KSCN晶体
(5)先滤去三颈烧瓶中的固体催化剂,再在减压条件下,___________ 、过滤、洗涤、干燥,得到硫氰化钾晶体。

已知①
 不溶于水,密度比水的大;②
不溶于水,密度比水的大;② 不于
不于 ;③硫氧化钾熔点172℃;④三颈烧瓶内盛放有
;③硫氧化钾熔点172℃;④三颈烧瓶内盛放有 、水和催化剂,回答下列问题:
、水和催化剂,回答下列问题:Ⅰ、制餐NH4SCN溶液:
(1)实验前,检查装置气密性良好后,装入药品。装置B中的试剂是
 液体必须浸没导气管口,目的是
液体必须浸没导气管口,目的是(2)实验开始时,打开K1,加热装置A、D.将A中产生的气体缓缓通入D中,发生反应
 (该反应比较缓慢)当看到
(该反应比较缓慢)当看到Ⅱ、制备KSCN溶液:
(3)熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当
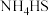 完全分解后(
完全分解后(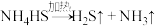 ),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为(4)装置E可用于处理尾气,多孔球泡的作用是:
 氧化生成浅黄色沉淀,铬元素被还原为
氧化生成浅黄色沉淀,铬元素被还原为 ,写出其氧化
,写出其氧化 的离子方程式
的离子方程式Ⅲ、制备KSCN晶体
(5)先滤去三颈烧瓶中的固体催化剂,再在减压条件下,
您最近一年使用:0次
2022-11-23更新
|
528次组卷
|
2卷引用:河北省邯郸市第一中学2022-2023学年高三上学期一轮复习收官考试(二)化学试题
名校
解题方法
10 . 合成环已酮缩乙二醇的原理为
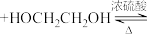
 +H2O。在反应体系中加入适量苯,利用如图装置(加热及夹持装置省略)制备环已酮缩乙二醇。下列说法错误的是
+H2O。在反应体系中加入适量苯,利用如图装置(加热及夹持装置省略)制备环已酮缩乙二醇。下列说法错误的是


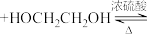
 +H2O。在反应体系中加入适量苯,利用如图装置(加热及夹持装置省略)制备环已酮缩乙二醇。下列说法错误的是
+H2O。在反应体系中加入适量苯,利用如图装置(加热及夹持装置省略)制备环已酮缩乙二醇。下列说法错误的是
| A.b是冷却水的进水口 |
| B.苯可将反应产生的水及时带出 |
| C.当苯即将回流至烧瓶中时,应将分水器中的水和苯放出 |
| D.利用分水器分离出水,可提高环己酮缩乙二醇的产率 |
您最近一年使用:0次
2022-09-05更新
|
527次组卷
|
3卷引用:河北省邯郸市第一中学2022-2023学年高二下学期3月月考化学试题



