海南省2021-2022学年高二上学期期末学业水平诊断化学试题
海南
高二
期末
2022-01-18
606次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理、认识化学科学、化学实验基础
海南省2021-2022学年高二上学期期末学业水平诊断化学试题
海南
高二
期末
2022-01-18
606次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
1. 化学与科学、技术、社会密切相关,下列说法错误的是
| A.增加清洁能源的开发利用,有利于社会可持续发展 |
| B.“嫦娥五号”使用的太阳能电池是将化学能转化成电能 |
| C.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 |
| D.氯碱工业中采用阳离子交换膜可以提高烧碱的纯度 |
【知识点】 硅的物理性质与用途解读 金属的电化学腐蚀与防护 氯碱工业解读
您最近一年使用:0次
2022-01-13更新
|
143次组卷
|
2卷引用:海南省2021-2022学年高二上学期期末学业水平诊断化学试题
单选题
|
较易(0.85)
解题方法
2. 下列有关化学用语表示正确的是
A.HS-水解:HS-+H2O S2-+H3O+ S2-+H3O+ |
B.H2S电离:H2S 2H++S2- 2H++S2- |
C.BaSO4的沉淀溶解平衡:BaSO4(s) Ba2+(aq)+SO Ba2+(aq)+SO (aq) (aq) |
| D.钢铁发生电化学腐蚀的负极反应式:Fe-3e-=Fe3+ |
您最近一年使用:0次
3. A2(g)+B2(g)=2AB(g)在反应过程中的能量变化如图所示,下列相关说法正确的是


| A.A2(g)+B2(g)=2AB(g) △H<0 |
| B.该反应的焓变△H=(a-b)kJ·mol-1 |
| C.生成2 mol A(g)和2 mol B(g)的过程中放出a kJ的能量 |
| D.加入催化剂,该反应的焓变减小 |
您最近一年使用:0次
单选题
|
较易(0.85)
4. 下列关于反应热的说法正确的是
| A.使用催化剂只改变可逆反应中正反应的活化能 |
| B.反应物的总键能小于生成物的总键能,则反应为吸热反应 |
| C.反应热与反应体系的始态和终态有关,而与反应的途径无关 |
| D.2H2(g)+O2(g)=2H2O(l) △H=−571.6 kJ∙mol−1,则H2的燃烧热为571.6 kJ∙mol−1 |
您最近一年使用:0次
2022-01-13更新
|
182次组卷
|
2卷引用:海南省2021-2022学年高二上学期期末学业水平诊断化学试题
单选题
|
较易(0.85)
名校
5. 盐在生产、生活中有广泛应用。下列盐的性质与用途及对应关系均正确的是
| A.KAl(SO4)2溶液呈酸性,可用于吸附水中杂质 |
| B.Na2CO3溶液呈碱性,可用于治疗胃酸过多 |
| C.NH4Cl溶液呈酸性,可用于除铁锈 |
| D.FeCl3溶液呈酸性,可用于蚀刻铜电路板 |
【知识点】 盐类水解规律理解及应用解读
您最近一年使用:0次
2022-01-13更新
|
146次组卷
|
2卷引用:海南省2021-2022学年高二上学期期末学业水平诊断化学试题
6. 化学实验在学科中有着非常重要的作用,结合图示实验装置,下列相关分析错误的是
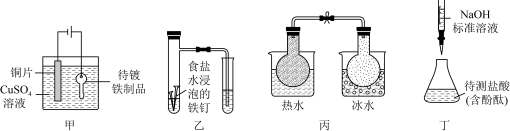

| A.用甲装置在铁制品表面镀铜 |
| B.用乙装置可验证铁的吸氧腐蚀 |
C.用丙装置可判断反应2NO2(g) N2O4(g)的△H<0 N2O4(g)的△H<0 |
| D.用丁装置可测定盐酸的浓度 |
您最近一年使用:0次
2022-01-13更新
|
118次组卷
|
2卷引用:海南省2021-2022学年高二上学期期末学业水平诊断化学试题
单选题
|
适中(0.65)
7. 常温下,向0.1mol·L-1醋酸溶液中加水稀释,下列叙述错误的是
| A.醋酸的电离程度增大 | B.溶液中的 增大 增大 |
| C.醋酸的电离常数不变 | D.溶液中的c(OH-)减小 |
【知识点】 电离平衡常数及影响因素解读 浓度对电离平衡的影响解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
8. 甲醇是重要的化工原料,利用CO2与H2反应可以合成甲醇,反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0。下列说法正确的是
CH3OH(g)+H2O(g) △H<0。下列说法正确的是
 CH3OH(g)+H2O(g) △H<0。下列说法正确的是
CH3OH(g)+H2O(g) △H<0。下列说法正确的是| A.因有气体生成,故该反应的△S>0 |
| B.升高温度,平衡逆向移动,正反应速率减慢 |
| C.恒温恒压条件下,加入催化剂,平衡常数增大 |
| D.恒温条件下,增大压强,可提高CO2的平衡转化率 |
您最近一年使用:0次
2022-01-13更新
|
207次组卷
|
2卷引用:海南省2021-2022学年高二上学期期末学业水平诊断化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 下列说法正确的是
| A.向CH3COOH溶液中加入少量醋酸钠固体,CH3COOH的电离程度增大 |
| B.电解精炼铜时,阳极质量减少3.2 g,反应过程中一定转移6.02×1022个电子 |
| C.室温下,向0.1 mol·L-1NH4Cl溶液中加水,促进水解,溶液的pH变小 |
| D.锅炉水垢中的CaSO4可用Na2CO3溶液浸泡后再用盐酸清洗 |
您最近一年使用:0次
2022-01-13更新
|
136次组卷
|
2卷引用:海南省2021-2022学年高二上学期期末学业水平诊断化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
解题方法
10. 氢氰酸(HCN)与NaOH溶液反应生成NaCN、H2O。已知NaCN溶液呈碱性,下列叙述正确的是
| A.0.01 mol·L-1HCN溶液的pH=2 |
| B.HCN溶液的pH随温度的升高而减小 |
| C.0.01 mol·L-1NaCN溶液中:c(H+)+c(Na+)=c(CN-)+c(OH-) |
| D.0.01 mol·L-1NaCN溶液中:c(CN-)>c(Na+)>c(OH-)>c(H+) |
您最近一年使用:0次
多选题
|
适中(0.65)
11. 将H2S废气资源化的反应原理为2H2S(g)+O2(g)=S2(s)+2H2O(1) △H=-632 kJ·mol-1。如图为H2S燃料电池的示意图,下列说法正确的是
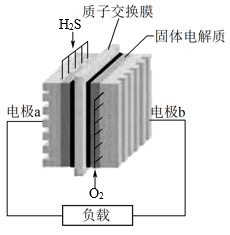

| A.电极a上发生还原反应 |
| B.电极b上发生的电极反应为O2+4H++4e-=2H2O |
| C.电路中每通过2 mol电子,电池内部释放316 kJ热量 |
| D.H+经质子交换膜由a极区移向b极区 |
您最近一年使用:0次
三、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
12. 根据下列实验操作和现象所得到的实验结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向NaHCO3溶液中滴入酚酞,溶液变成红色 | HCO 的水解程度大于其电离程度 的水解程度大于其电离程度 |
| B | 向NaOH固体中加入少量稀盐酸,测得温度高于室温 | 盐酸与NaOH的反应为放热反应 |
| C | 室温下,测得相同浓度的NaX和NaY溶液的pH分别为8和9 | 酸性:HX<HY |
| D | 向等浓度的NaCl、KI的混合溶液中滴加少量AgNO3溶液,得到黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
四、多选题 添加题型下试题
多选题
|
适中(0.65)
解题方法
13. 室温下,向20mL0.1mol·L-1HA溶液中滴加0.1mol·L-1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。下列说法正确的是


| A.室温下,Ka(HA)=1×10-3 |
| B.B点溶液中:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C.C点溶液中溶质为NaA,且c(Na+)>c(A-) |
| D.溶液中水的电离程度:D>B>A |
您最近一年使用:0次
五、单选题 添加题型下试题
单选题
|
适中(0.65)
14. 温度为T时,向容积为2 L的恒容密闭容器中通入NO2,发生反应:2NO2(g) N2O4(g)。实验测得:v正=k正·c2(NO2),v逆=k逆·c(N2O4),k正、k逆为速率常数,受温度的影响,不同时刻测得容器中n(NO2)如图所示。下列说法正确的是
N2O4(g)。实验测得:v正=k正·c2(NO2),v逆=k逆·c(N2O4),k正、k逆为速率常数,受温度的影响,不同时刻测得容器中n(NO2)如图所示。下列说法正确的是

 N2O4(g)。实验测得:v正=k正·c2(NO2),v逆=k逆·c(N2O4),k正、k逆为速率常数,受温度的影响,不同时刻测得容器中n(NO2)如图所示。下列说法正确的是
N2O4(g)。实验测得:v正=k正·c2(NO2),v逆=k逆·c(N2O4),k正、k逆为速率常数,受温度的影响,不同时刻测得容器中n(NO2)如图所示。下列说法正确的是
| A.0~2 s内,该反应的平均速率v(NO2)=0.50 mol·L-1·s-1 |
| B.该温度下,平衡时k正=10k逆 |
| C.其他条件不变,往容器中再通入2 mol NO2,平衡时NO2体积分数增大 |
| D.其他条件不变,移走部分N2O4,则平衡正向移动,平衡常数增大 |
您最近一年使用:0次
六、解答题 添加题型下试题
15. 金属镁广泛用于航空航天、汽车等行业。以镁合金废料(主要含Mg,少量的Al、Fe及其氧化物)为原料制取金属镁的工艺流程如图:

(1)酸溶前对镁合金废料粉碎的目的是______ 。
(2)酸溶时,铁溶解的离子方程式是______ 。
(3)加入H2O2氧化的目的是______ 。
(4)简述如何由MgCl2·6H2O获得无水MgCl2:______ 。
(5)电解时阴极反应式为______ 。

(1)酸溶前对镁合金废料粉碎的目的是
(2)酸溶时,铁溶解的离子方程式是
(3)加入H2O2氧化的目的是
(4)简述如何由MgCl2·6H2O获得无水MgCl2:
(5)电解时阴极反应式为
您最近一年使用:0次
16. 研究工业合成氨中的副产物CO2的综合利用对于“碳中和”具有重要意义。
(1)合成氨的反应原理为3H2(g)+N2(g) 2NH3(g)ΔH=—92.4kJ·mol-1。
2NH3(g)ΔH=—92.4kJ·mol-1。
①比较不同温度下该反应的平衡常数:K200℃______ K600℃(填“>”“<”或“=”)。
②若N≡N键的键能是akJ·mol-1,H—H键的键能是bkJ·mol-1,则N—H键的键能为______ kJ·mol-1(用含a、b的代数式表示)。
(2)工业上利用NH3制取尿素的反应原理为2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(g)。
CO(NH2)2(1)+H2O(g)。
①写出该反应的平衡常数表达式:K=______ 。
②当起始氨碳比 =3时,反应达到平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3时,反应达到平衡时CO2的转化率为60%,则NH3的平衡转化率为______ 。
(3)通过不同途径将CO2甲烷化具有重要意义。
①热化学转化法:反应原理为CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH,反应中每转移1mol电子,放出21kJ的热量,则ΔH=
CH4(g)+2H2O(g) ΔH,反应中每转移1mol电子,放出21kJ的热量,则ΔH=______ 。
②电化学转化法:在多晶铜的催化下,CO2在碱性介质中电解可直接转化为甲烷,则阴极反应式为______ 。
(1)合成氨的反应原理为3H2(g)+N2(g)
 2NH3(g)ΔH=—92.4kJ·mol-1。
2NH3(g)ΔH=—92.4kJ·mol-1。①比较不同温度下该反应的平衡常数:K200℃
②若N≡N键的键能是akJ·mol-1,H—H键的键能是bkJ·mol-1,则N—H键的键能为
(2)工业上利用NH3制取尿素的反应原理为2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(g)。
CO(NH2)2(1)+H2O(g)。①写出该反应的平衡常数表达式:K=
②当起始氨碳比
 =3时,反应达到平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3时,反应达到平衡时CO2的转化率为60%,则NH3的平衡转化率为(3)通过不同途径将CO2甲烷化具有重要意义。
①热化学转化法:反应原理为CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH,反应中每转移1mol电子,放出21kJ的热量,则ΔH=
CH4(g)+2H2O(g) ΔH,反应中每转移1mol电子,放出21kJ的热量,则ΔH=②电化学转化法:在多晶铜的催化下,CO2在碱性介质中电解可直接转化为甲烷,则阴极反应式为
您最近一年使用:0次
七、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
17. 常温下,几种酸的电离常数如表所示:
(1)常温下,CH3COOH、HClO、H2CO3的酸性由强到弱的顺序为______ 。
(2)HCO 的电离平衡常数表达式为K=
的电离平衡常数表达式为K=______ 。
(3)常温下,实验测得某人血液中c(HCO )=2.3×10-2mol·L-1,c(H2CO3)=2.3×10-3mol·L-1,则该人血液呈
)=2.3×10-2mol·L-1,c(H2CO3)=2.3×10-3mol·L-1,则该人血液呈______ (填“酸性”“中性”或“碱性”)。
(4)常温下,pH=10的Na2CO3溶液中,由水电离的c(OH-)=______ 。
(5)常温下,等浓度的CH3COONa、NaClO、Na2CO3溶液的pH由大到小的顺序为______ (用溶质的化学式表示)。
(6)某温度下,向CH3COOH溶液中滴加NaOH溶液c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,则该温度下Ka(CH3COOH)=______ 。

| 弱酸 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.5×10-7 Ka2=4.7×10-11 |
(2)HCO
 的电离平衡常数表达式为K=
的电离平衡常数表达式为K=(3)常温下,实验测得某人血液中c(HCO
 )=2.3×10-2mol·L-1,c(H2CO3)=2.3×10-3mol·L-1,则该人血液呈
)=2.3×10-2mol·L-1,c(H2CO3)=2.3×10-3mol·L-1,则该人血液呈(4)常温下,pH=10的Na2CO3溶液中,由水电离的c(OH-)=
(5)常温下,等浓度的CH3COONa、NaClO、Na2CO3溶液的pH由大到小的顺序为
(6)某温度下,向CH3COOH溶液中滴加NaOH溶液c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,则该温度下Ka(CH3COOH)=

【知识点】 电离平衡常数及影响因素解读 盐类水解规律理解及应用解读
您最近一年使用:0次
八、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
18. I.常温下,用0.1mol·L-1NaOH溶液滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到如图所示的滴定曲线:

(1)用NaOH溶液滴定醋酸溶液通常选择的指示剂为_______ 。
(2)符合NaOH溶液滴定醋酸溶液滴定曲线的是_______ (填“甲”或“乙”)。
II.某兴趣小组使用酸碱中和滴定法测定某品牌白醋中醋酸的含量,主要步骤如下:
①量取10.00mL食用白醋,稀释后准确配制100mL白醋溶液。
②配制100mL0.100mol·L-1NaOH标准溶液。
③用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴指示剂。
④进行滴定,重复滴定三次,三次消耗NaOH标准溶液的体积分别为14.95mL、15.00mL、15.05mL。
(3)配制100mL白醋溶液,所使用的玻璃仪器除量筒、烧杯和玻璃棒外,还有_______ 。
(4)滴定终点的现象是_______ 。
(5)下列操作会使测定结果偏小的是_______ (填序号)。
a.未用标准溶液润洗滴定管
b.标准溶液漏滴在锥形瓶外一滴
c.滴定前平视,滴定后俯视滴定管读数
d.待测液溅出锥形瓶外一滴
(6)该白醋中醋酸的含量为_______ mg·mL-1。

(1)用NaOH溶液滴定醋酸溶液通常选择的指示剂为
(2)符合NaOH溶液滴定醋酸溶液滴定曲线的是
II.某兴趣小组使用酸碱中和滴定法测定某品牌白醋中醋酸的含量,主要步骤如下:
①量取10.00mL食用白醋,稀释后准确配制100mL白醋溶液。
②配制100mL0.100mol·L-1NaOH标准溶液。
③用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴指示剂。
④进行滴定,重复滴定三次,三次消耗NaOH标准溶液的体积分别为14.95mL、15.00mL、15.05mL。
(3)配制100mL白醋溶液,所使用的玻璃仪器除量筒、烧杯和玻璃棒外,还有
(4)滴定终点的现象是
(5)下列操作会使测定结果偏小的是
a.未用标准溶液润洗滴定管
b.标准溶液漏滴在锥形瓶外一滴
c.滴定前平视,滴定后俯视滴定管读数
d.待测液溅出锥形瓶外一滴
(6)该白醋中醋酸的含量为
【知识点】 酸碱中和滴定的综合考查解读
您最近一年使用:0次
19. 将氮氧化物进行无害化处理对治理大气污染、建设生态文明具有重要意义。
(1)O3的氧化性强于O2,能更有效地氧化NO。已知:
2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284 kJ·mol-1
则NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=_______ kJ·mol-1。
(2)在汽车排气管上安装催化转化器,能有效消除尾气对环境的污染:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0,该反应能自发进行所需的温度条件是
N2(g)+2CO2(g) △H<0,该反应能自发进行所需的温度条件是_______ (填“高温”或“低温”)。
(3)某温度下,在催化剂的作用下发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g),测得密闭容器中不同时间时CO和NO的浓度如表。
N2(g)+2CO2(g),测得密闭容器中不同时间时CO和NO的浓度如表。
①该温度下,达到平衡时NO的转化率为_______ 。
②该温度下,该反应的平衡常数为_______ 。
③恒温恒容条件下,下列能说明该反应达到化学平衡状态的是_______ (填序号)。
a.体系的压强保持不变
b.v(NO)=2v(N2)
c.混合气体的密度不变
d.NO的转化率保持不变
④下列措施能提高该反应中NO平衡转化率的是_______ (填序号)。
a.恒温恒容时,提高CO的浓度
b.恒温恒容时,填充更多的催化剂
c.恒温时,压缩容器的体积
d.将恒温恒容容器改为绝热恒容容器
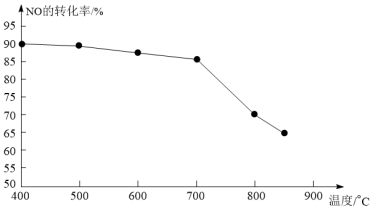
⑤恒容条件下,上述反应中若NO和CO的起始浓度一定,催化反应相同时间,测得NO的转化率随温度的变化如图所示,当温度超过700℃时,随温度的升高,NO的转化率下降明显,原因是_______ 。
(1)O3的氧化性强于O2,能更有效地氧化NO。已知:
2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284 kJ·mol-1
则NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=
(2)在汽车排气管上安装催化转化器,能有效消除尾气对环境的污染:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0,该反应能自发进行所需的温度条件是
N2(g)+2CO2(g) △H<0,该反应能自发进行所需的温度条件是(3)某温度下,在催化剂的作用下发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g),测得密闭容器中不同时间时CO和NO的浓度如表。
N2(g)+2CO2(g),测得密闭容器中不同时间时CO和NO的浓度如表。| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO)/(10-4mol·L-1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
| c(NO)/(10-4mol·L-1) | 10.0 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
②该温度下,该反应的平衡常数为
③恒温恒容条件下,下列能说明该反应达到化学平衡状态的是
a.体系的压强保持不变
b.v(NO)=2v(N2)
c.混合气体的密度不变
d.NO的转化率保持不变
④下列措施能提高该反应中NO平衡转化率的是
a.恒温恒容时,提高CO的浓度
b.恒温恒容时,填充更多的催化剂
c.恒温时,压缩容器的体积
d.将恒温恒容容器改为绝热恒容容器
⑤恒容条件下,上述反应中若NO和CO的起始浓度一定,催化反应相同时间,测得NO的转化率随温度的变化如图所示,当温度超过700℃时,随温度的升高,NO的转化率下降明显,原因是

您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学反应原理、认识化学科学、化学实验基础
试卷题型(共 19题)
题型
数量
单选题
11
多选题
3
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 硅的物理性质与用途 金属的电化学腐蚀与防护 氯碱工业 | |
| 2 | 0.85 | 离子方程式的正误判断 弱电解质的电离方程式 水解的离子方程式书写 金属的电化学腐蚀与防护 | |
| 3 | 0.65 | 化学键与化学反应中的能量关系 吸热反应和放热反应 反应热与焓变概念比较 | |
| 4 | 0.85 | 焓变产生原因及表示 燃烧热概念 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |
| 5 | 0.85 | 盐类水解规律理解及应用 | |
| 6 | 0.65 | 温度对化学平衡移动的影响 酸碱中和滴定实质、原理 电镀 吸氧腐蚀 | |
| 7 | 0.65 | 电离平衡常数及影响因素 浓度对电离平衡的影响 | |
| 8 | 0.65 | 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 压强对化学平衡移动的影响 化学平衡常数的影响因素及应用 | |
| 9 | 0.65 | 弱电解质在水溶液中的电离平衡 盐类水解的应用 沉淀转化 铜的电解精炼 | |
| 12 | 0.65 | 盐类水解规律理解及应用 溶度积规则及其应用 物质性质实验方案的设计 | |
| 14 | 0.65 | 化学反应速率计算 压强对化学平衡移动的影响 化学平衡常数的影响因素及应用 转化率的相关计算及判断 | |
| 二、多选题 | |||
| 10 | 0.65 | 弱电解质在水溶液中的电离平衡 温度对电离平衡的影响 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 11 | 0.65 | 原电池正负极判断 原电池电极反应式书写 新型电池 原电池有关计算 | |
| 13 | 0.65 | 水溶液中水的电离程度及的计算 盐溶液中离子浓度大小的比较 弱电解质的电离平衡常数 | |
| 三、解答题 | |||
| 15 | 0.85 | 有关铁及其化合物转化的流程题型 电解池电极反应式及化学方程式的书写与判断 物质分离、提纯综合应用 物质制备的探究 | 工业流程题 |
| 16 | 0.4 | 根据△H=反应物的键能之和-生成物的键能之和进行计算 化学平衡常数的影响因素及应用 转化率的相关计算及判断 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |
| 18 | 0.65 | 酸碱中和滴定的综合考查 | 原理综合题 |
| 19 | 0.65 | 盖斯定律与热化学方程式 化学平衡状态的判断方法 化学平衡常数的有关计算 反应进行方向判据的应用 | 原理综合题 |
| 四、填空题 | |||
| 17 | 0.65 | 电离平衡常数及影响因素 盐类水解规律理解及应用 | |



