名校
1 . 铜是人类最早使用的金属之一,用黄铜矿(主要成分为 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下:
(1)第三周期主族元素中电负性比 小的元素有
小的元素有___________ 种, 的沸点比
的沸点比 的
的___________ (填“高”或“低”),原因是___________ 。
(2) 和
和 均为
均为___________ 晶体, 的熔点为
的熔点为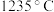 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是___________ 。
(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示___________ 填化学式),图2中,A原子坐标参数为(0,0,0),B原子为 ,则C原子的坐标参数为
,则C原子的坐标参数为___________ 。
 )生产粗铜的反应原理如下:
)生产粗铜的反应原理如下: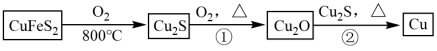
(1)第三周期主族元素中电负性比
 小的元素有
小的元素有 的沸点比
的沸点比 的
的(2)
 和
和 均为
均为 的熔点为
的熔点为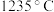 ,
, 的熔点为
的熔点为 ,
, 熔点较高的原因是
熔点较高的原因是(3)铜的两种氧化物的晶胞如图1、图2所示,图1表示
 ,则C原子的坐标参数为
,则C原子的坐标参数为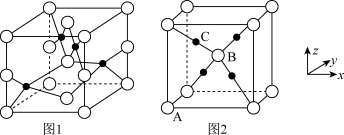
您最近一年使用:0次
名校
解题方法
2 . 下列说法错误的是
| A.碘易溶于四氯化碳、甲烷难溶于水,二者都可用相似相溶原理解释 |
B.乳酸分子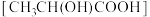 中含有一个手性碳原子 中含有一个手性碳原子 |
| C.氟的电负性大于氯的电负性,导致三氟乙酸的酸性大于三氯乙酸的酸性 |
| D.水很稳定是因为水中含有大量氢键 |
您最近一年使用:0次
10-11高三·山东济宁·阶段练习
名校
解题方法
3 . 一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)⇌CO(g)+H2(g)。下列叙述中不能说明该反应已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成n molCO的同时生成n molH2 |
| D.1mol H-H键断裂的同时断裂2mol H-O键 |
您最近一年使用:0次
2024-01-19更新
|
289次组卷
|
64卷引用:吉林省四平市普通高中2021-2022学年高二上学期期中考试化学试题
吉林省四平市普通高中2021-2022学年高二上学期期中考试化学试题(已下线)2014秋河北省成安一中、临漳一中、永年二中高二上学期期中联考化学试卷2015-2016学年辽宁省沈阳市东北育才学校高二上化学试卷2015-2016学年四川省香港马会第五中学高二上10月月考化学试卷2015-2016学年山东省淄博市淄川一中高二上第一次阶段测化学试卷2015-2016学年湖南省株洲十八中高二上学期期末理化学试卷贵州省遵义航天高级中学2017-2018学年高二上学期第三次月考理综(理)化学试题江西省吉安县第三中学2017-2018学年高二1月月考化学试题步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡浙江省台州市书生中学2019-2020学年高二年级上学期第一次月考化学试题云南省河口县高级中学2019-2020学年高二上学期期末考试化学试题山西省大同市天镇一中2019-2020学年高二上学期期中考试化学试题贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高二上学期期末考试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)2.3.1化学平衡状态(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二上学期10月月考化学试题吉林省长春外国语学校2021-2022学年高二上学期期初考试化学试题安徽省亳州市第二中学2021-2022学年高二上学期第一次月考化学试题辽宁省朝阳育英高考补习学校2021-2022学年高二10月月考化学试题贵州省平塘民族中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题重庆市青木关中学校2021-2022学年高二上学期期中考试化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题甘肃省徽县第一中学2021-2022学年高二上学期11月月考化学试题河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题上海市民办新虹桥中学2023-2024学年高二上学期期中考试化学试卷 山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期第一次月考化学试题 安徽省淮北市国泰中学2023-2024学年高二上学期期末考试化学试题(已下线)2012届山东省济宁市邹城二中高三第二次月考化学试卷(已下线)2011-2012学年湖北武汉部分重点中学高一下学期期末考试化学题2015-2016学年新疆生产建设兵团二中高一下期中化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷四川省资阳中学2016-2017学年高一下学期期中化学试题福建省师范大学附属中学2016-2017学年高一下学期期末考试化学试题2017-2018学年高一化学人教版必修2:第二章检测题山东省师范大学附属中学2017-2018学年高一下学期第三次学分认定考试(期中)化学试题山东师范大学附属中学2017-2018学年高一下学期期中考试化学试题【全国市级联考】山东省德州市2017-2018学年高一下学期期末考试化学试题【全国市级联考】广东省潮州市2017-2018学年高一下学期期末考试化学试题(已下线)2018年9月30日 《每日一题》一轮复习-每周一测福建省漳州市东山县第二中学2019届高三上学期第三次月考化学试题河北省邢台市第二中学2018-2019学年下学期高一第四次月考化学试题6.2.2 化学反应的限度化学反应条件的控制——2020年春高一新人教版第二册化学一课一练湖南省双峰县第一中学2019-2020学年高一下学期入学考试化学试题2020年春高一化学新人教版第二册课后同步:6.2.2 化学反应的限度化学反应条件的控制山西省运城市临猗县临晋中学2019-2020学年高一下学期开学复课摸底考试化学试题黑龙江省大庆中学2019-2020学年高一下学期期中考试化学试题安徽省亳州市涡阳县第九中学2018-2019学年高一下学期第三次月考化学试题吉林省白城市第一中学2019-2020学年高一下学期期末考试化学试题广东省汕头市金山中学2019-2020学年高一下学期期中考试化学试题安徽省合肥市第一中学2019—2020学年高一下学期期末考试化学试题河北省保定市高碑店市高碑店一中2019---2020学年高一下学期第二次月考化学试题(已下线)6.2.2 化学反应的限度(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)【浙江新东方】双师155高一下.吉林省白城市第一中学2020-2021学年高一下学期期中考试化学试题福建省福州第四中学2021-2022学年高一下学期3月月考化学试题(已下线)6.2.1 化学平衡(第1课时 可逆反应和化学平衡状态)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)浙江省杭州市源清中学2021-2022学年高一下学期期中考试化学试题吉林省延边第二中学2022-2023学年高三上学期第三次阶段测试化学试题吉林省洮南市第一中学2021-2022学年高一下学期第一次月考化学试题甘肃省天水市秦安县第一中学2022-2023学年高一下学期4月期中化学试题新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题
名校
4 . 下列说法正确的是
①Na核外电子存在6种空间运动状态;②金属锌比铜活泼,因此Zn的第一电离能小于Cu;③杂化轨道用于形成 键或用来容纳孤电子对;④邻羟基苯甲醛的沸点高于对羟基苯甲醛;⑤键角:
键或用来容纳孤电子对;④邻羟基苯甲醛的沸点高于对羟基苯甲醛;⑤键角: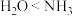
①Na核外电子存在6种空间运动状态;②金属锌比铜活泼,因此Zn的第一电离能小于Cu;③杂化轨道用于形成
 键或用来容纳孤电子对;④邻羟基苯甲醛的沸点高于对羟基苯甲醛;⑤键角:
键或用来容纳孤电子对;④邻羟基苯甲醛的沸点高于对羟基苯甲醛;⑤键角: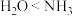
| A.①③⑤ | B.②③⑤ | C.③④⑤ | D.①②④ |
您最近一年使用:0次
2024-01-13更新
|
273次组卷
|
4卷引用:吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题
名校
解题方法
5 . 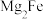 是目前储氢密度最高的材料之一,其晶胞结构如图所示,晶胞边长为apm。Mg原子占据Fe形成的所有四面体空隙,储氢后,
是目前储氢密度最高的材料之一,其晶胞结构如图所示,晶胞边长为apm。Mg原子占据Fe形成的所有四面体空隙,储氢后, 分子占据Fe形成的八面体空隙,化学式为
分子占据Fe形成的八面体空隙,化学式为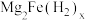 。下列说法正确的是
。下列说法正确的是
 是目前储氢密度最高的材料之一,其晶胞结构如图所示,晶胞边长为apm。Mg原子占据Fe形成的所有四面体空隙,储氢后,
是目前储氢密度最高的材料之一,其晶胞结构如图所示,晶胞边长为apm。Mg原子占据Fe形成的所有四面体空隙,储氢后, 分子占据Fe形成的八面体空隙,化学式为
分子占据Fe形成的八面体空隙,化学式为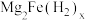 。下列说法正确的是
。下列说法正确的是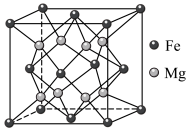
A.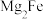 晶胞中,存在的化学键类型为金属键和离子键 晶胞中,存在的化学键类型为金属键和离子键 |
B.氢气储满后晶体的化学式为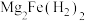 |
C.氢气储满后, 和 和 的最短距离为 的最短距离为 |
| D.晶胞中Fe与Mg的配位数均为4 |
您最近一年使用:0次
2024-01-13更新
|
638次组卷
|
5卷引用:吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题
吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题湖南省长沙市第一中学2023-2024学年高三上学期月考(五)化学试题(已下线)选择题6-10(已下线)选择题11-14(已下线)微题型02 晶体结构及相关计算-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
解题方法
6 . 下列关于物质结构或性质及解释存在错误的是
| 选项 | 物质结构或性质 | 解释 |
| A | 键角: | CO2中C原子为sp杂化,为直线形分子;CH4中C原子为sp3杂化,为正四面体形分子 |
| B | 稳定性: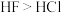 |  分子间可以形成氢键, 分子间可以形成氢键, 没有氢键 没有氢键 |
 | BF3与NH3形成[H3N→BF3] |  中的 中的 有空轨道接受 有空轨道接受 中 中 的孤电子对 的孤电子对 |
| D | 冠醚能加快KMnO4与环己烯的反应速率 | 冠醚上不同大小的空穴适配不同大小的碱金属离子,冠醚通过与K+结合将 带入有机相,起到催化剂的作用 带入有机相,起到催化剂的作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-13更新
|
445次组卷
|
5卷引用:吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题
吉林省四平市第一高级中学2023-2024学年高二下学期第一次月考化学试题湖北省襄阳市第一中学2023-2024学年高二下学期3月月考化学试题黑龙江省哈尔滨市重点三校(哈九中、哈六中、哈一中)2023-2024学年高三上学期期末联考化学试题黑龙江省哈尔滨市重点三校(哈九中、哈六中、哈一中)2023-2024学年高三上学期 期末化学试卷(已下线)专题04 物质结构与性质-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
7 . 电子工业中,可用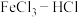 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
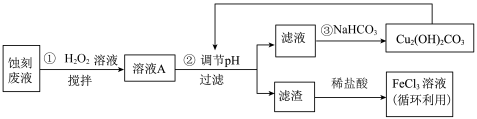
回答下列问题:
(1)把 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是___________ 。(填写化学式)
(2) 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是___________ 。
(3)步骤①中加入 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)___________ 。
(4)已知:生成氢氧化物沉淀的 如下表。
如下表。
根据表中数据推测调节 的范围是
的范围是___________ 。
(5)上述流程路线中,除 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是___________ 。
(6)在 ,向浓度均为
,向浓度均为 的
的 溶液中逐滴加入氨水,若镁离子浓度为
溶液中逐滴加入氨水,若镁离子浓度为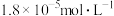 时溶液的
时溶液的 为
为___________ 。(已知 时
时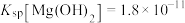 )。
)。
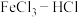 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
回答下列问题:
(1)把
 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是(2)
 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是(3)步骤①中加入
 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)(4)已知:生成氢氧化物沉淀的
 如下表。
如下表。| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
 的范围是
的范围是(5)上述流程路线中,除
 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是(6)在
 ,向浓度均为
,向浓度均为 的
的 溶液中逐滴加入氨水,若镁离子浓度为
溶液中逐滴加入氨水,若镁离子浓度为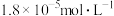 时溶液的
时溶液的 为
为 时
时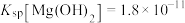 )。
)。
您最近一年使用:0次
8 .  和
和 在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:
在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:
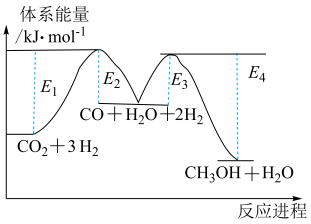
(1)25℃、100kPa二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示(25℃、100kPa)。总反应的焓变
___________  (用
(用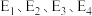 表示),写出决速步骤反应的热化学方程式
表示),写出决速步骤反应的热化学方程式___________ 。
(2)
合成总反应在起始物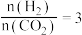 时发生反应
时发生反应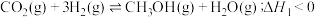 ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在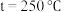 条件下的
条件下的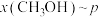 、在
、在 条件下的
条件下的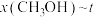 (温度)如图所示。图中对应等温过程的曲线是
(温度)如图所示。图中对应等温过程的曲线是___________ ,原因是___________ 。
(3)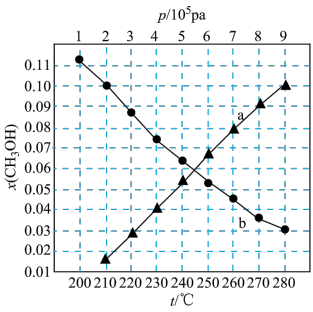
在刚性容器压强为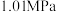 时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应:
时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应: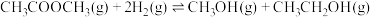 。一定温度下,以
。一定温度下,以
 的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
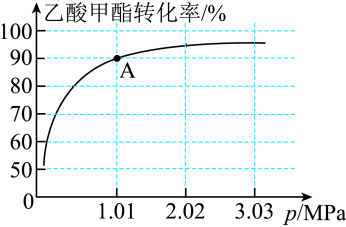
①A点时,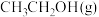 的体积分数为
的体积分数为___________ %(保留一位小数)。
②此温度下,该反应的化学平衡常数
___________  (Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
 和
和 在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:
在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:(1)25℃、100kPa二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示(25℃、100kPa)。总反应的焓变

 (用
(用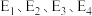 表示),写出决速步骤反应的热化学方程式
表示),写出决速步骤反应的热化学方程式(2)

合成总反应在起始物
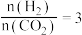 时发生反应
时发生反应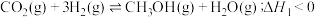 ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在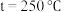 条件下的
条件下的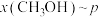 、在
、在 条件下的
条件下的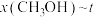 (温度)如图所示。图中对应等温过程的曲线是
(温度)如图所示。图中对应等温过程的曲线是(3)

在刚性容器压强为
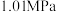 时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应:
时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应: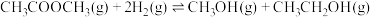 。一定温度下,以
。一定温度下,以
 的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
①A点时,
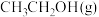 的体积分数为
的体积分数为②此温度下,该反应的化学平衡常数

 (Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
您最近一年使用:0次
名校
解题方法
9 . 电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为___________ 。
②下列方法中,可以使醋酸稀溶液中 电离程度减小的是
电离程度减小的是___________ (填字母序号)。
a.滴加浓盐酸 b.微热溶液 c.加水稀释 d.加入醋酸钠晶体 e.加入冰醋酸
(2)用 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
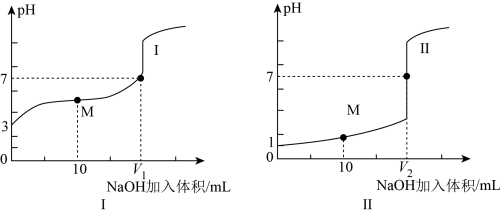
①滴定开始前,三种溶液中由水电离出的 最大的是
最大的是___________ 。
②已知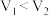 ,则滴定醋酸的曲线是
,则滴定醋酸的曲线是___________ (填“I”或“II”)。
(3)酸碱中和滴定可用于测定酸或碱的物质的量浓度,取 未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用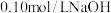 标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①滴定达到终点的标志是___________ 。
②根据上述数据,可计算出该盐酸的浓度约为___________  (保留两位有效数字)。
(保留两位有效数字)。
③在上述实验中,下列操作会造成测定结果偏高的有___________ 。(填字母序号)。
A.滴定终点读数时俯视
B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用待测盐酸润洗
D.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为
②下列方法中,可以使醋酸稀溶液中
 电离程度减小的是
电离程度减小的是a.滴加浓盐酸 b.微热溶液 c.加水稀释 d.加入醋酸钠晶体 e.加入冰醋酸
(2)用
 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
①滴定开始前,三种溶液中由水电离出的
 最大的是
最大的是②已知
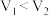 ,则滴定醋酸的曲线是
,则滴定醋酸的曲线是(3)酸碱中和滴定可用于测定酸或碱的物质的量浓度,取
 未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用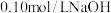 标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。| 实验编号 | NaOH溶液的浓度(mo1·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 25.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
 (保留两位有效数字)。
(保留两位有效数字)。③在上述实验中,下列操作会造成测定结果偏高的有
A.滴定终点读数时俯视
B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用待测盐酸润洗
D.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
名校
10 . 下列实验方案中,不能达到相应实验目的的是
 |  |  |  |
| A.研究温度对化学平衡的影响 | B.蒸干AlCl3溶液获得AlCl3晶体 | C.测定酸碱中和的热效应 | D.碱式滴定管排气泡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



