解题方法
1 . 乙炔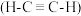 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
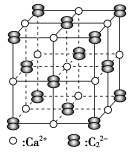
碳化钙晶胞示意图: 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。
①反应的化学方程式为_______ 。
②上述反应中碳原子轨道杂化类型的变化为_______ 。
③乙炔分子中 键和
键和 键数目之比为
键数目之比为_______ 。
(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
① 基态核外电子排布式为
基态核外电子排布式为_______ 。
②碳化钙晶体中哑铃形 的存在,使晶胞沿一个方向拉长。碳化钙晶体中1个
的存在,使晶胞沿一个方向拉长。碳化钙晶体中1个 周围距离
周围距离最近 的 围成的几何图形为
围成的几何图形为_______ (填正方形、正四面体或正八面体)。
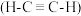 是有机合成工业的一种重要原料。下列两种方法可生产乙炔。
是有机合成工业的一种重要原料。下列两种方法可生产乙炔。碳化钙晶胞示意图:
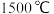 电弧中经极短时间加热分解产生乙炔。
电弧中经极短时间加热分解产生乙炔。①反应的化学方程式为
②上述反应中碳原子轨道杂化类型的变化为
③乙炔分子中
 键和
键和 键数目之比为
键数目之比为(2)工业上曾用电石(主要成分为碳化钙)与水反应生成乙炔。
①
 基态核外电子排布式为
基态核外电子排布式为②碳化钙晶体中哑铃形
 的存在,使晶胞沿一个方向拉长。碳化钙晶体中1个
的存在,使晶胞沿一个方向拉长。碳化钙晶体中1个 周围距离
周围距离 围成的几何图形为
围成的几何图形为
您最近一年使用:0次
名校
解题方法
2 . 为探究过氧化氢分解反应快慢的影响因素,某学习小组设计了下列实验:
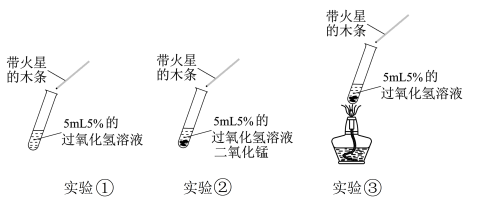
| A.综合实验①、②和③,可得出5%的过氧化氢溶液最适合用于分解制氧气 |
| B.对比实验①和③,可研究升温对过氧化氢分解反应快慢的影响 |
| C.综合实验②和③,可得出过氧化氢分解制氧气的最佳反应条件 |
| D.对比实验①和②,可研究催化剂对化学反应快慢的影响 |
您最近一年使用:0次
2024-04-06更新
|
548次组卷
|
4卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
3 . 最近,科学家开发一种宽温域的锂离子电池,其工作原理如图所示。错误 的是
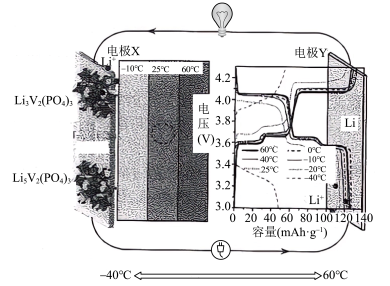
| A.X极电势高于Y极电势 |
B.放电时,X极电极反应式为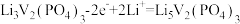 |
| C.充电时,电极Y与电源负极连接 |
D.充电时,每生成1.4 g Li时理论上转移电子数约为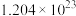 |
您最近一年使用:0次
2024-04-06更新
|
549次组卷
|
4卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
2024届河南省焦作市博爱县第一中学高三下学期三模化学试题2024届河南省创新联盟TOP二十名校质检二(二模)考试理综试题-高中化学(已下线)通关练09 重温“两池”原理及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题06?电化学原理综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
4 . 下列叙述中,事实与对应解释不正确的是
| 事实 | 解释 | |
| A | 第一电离能:N>O | N的价层电子排布是2s22p3,为半充满较稳定 |
| B | 在氯化钠晶体中,每个Na+周围与它最近且等距的Cl-有6个 | 离子键具有饱和性 |
| C | 熔点:晶体硅<碳化硅 | 晶体硅和碳化硅均属于共价晶体,原子半径:Si>C,键长:Si-Si>Si-C,键能:Si-Si<Si-C |
| D | 酸性:HCOOH>CH3COOH | H3C-是推电子基团,使羧基中羟基的极性减小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-05更新
|
115次组卷
|
2卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
5 . 近期好多人被流感困扰,冯老段长也未能幸免,鉴于自己丰富的经历,他第一时间去药店买子达菲,吃了药几天后就康复了。达菲的主要成分为磷酸奥司他韦,奥司他韦被称为流感特效药,具有抗病毒的生物学活性,结构简式如图所示,下列关于奥司他韦的说法不正确的是
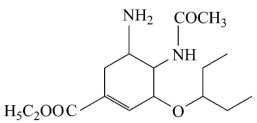
| A.分子中含有手性碳原子 |
| B.分子中环上的一溴代物只有2种 |
| C.能使溴水和酸性KMnO4溶液褪色 |
| D.1mol奥司他韦最多能与2molNaOH反应 |
您最近一年使用:0次
2024-04-04更新
|
1089次组卷
|
5卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题福建省福州市福建师范大学附属中学2024届高三一模化学试题(已下线)题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)河南省漯河市高级中学2023-2024学年高三下学期4月月考化学试题(已下线)压轴题08?有机物的结构与性质(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
6 . X、Y、Z、W、Q为原子序数依次增大的前四周期元素,Y元素原子的价层电子排布是 ,Z元素原子与X元素原子形成的XZ分子与
,Z元素原子与X元素原子形成的XZ分子与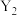 分子的价电子总数相同,W元素原子的M层只有一个电子,Q元素为金属元素,且Q元素原子的+1价离子的M层电子轨道全充满,下列说法正确的是
分子的价电子总数相同,W元素原子的M层只有一个电子,Q元素为金属元素,且Q元素原子的+1价离子的M层电子轨道全充满,下列说法正确的是
 ,Z元素原子与X元素原子形成的XZ分子与
,Z元素原子与X元素原子形成的XZ分子与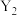 分子的价电子总数相同,W元素原子的M层只有一个电子,Q元素为金属元素,且Q元素原子的+1价离子的M层电子轨道全充满,下列说法正确的是
分子的价电子总数相同,W元素原子的M层只有一个电子,Q元素为金属元素,且Q元素原子的+1价离子的M层电子轨道全充满,下列说法正确的是| A.Q元素位于元素周期表的d区 | B.简单离子半径:W>Y>Z |
| C.元素的第一电离能:Y>Z>X | D.X、Z形成的化合物一定是极性分子 |
您最近一年使用:0次
2024-04-04更新
|
91次组卷
|
2卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
7 . 短周期主族元素R、X、Y、Z的原子序数依次增大,基态R原子核外电子占据3个能级且每个能级上电子数相等,基态Y原子核外s、p能级上电子总数相等。X、Z至少能形成两种化合物,其中一种化合物能使品红溶液褪色,加热褪色后的溶液又恢复至原来红色。下列叙述错误 的是
| A.X和Z分别与Y形成的两种化合物的离子键的百分数:YX<YZ |
| B.简单氢化物分子的键角:R>X>Z |
| C.简单氢化物中键能:X>Z |
| D.上述四种元素中,第一电离能最大的元素是X |
您最近一年使用:0次
2024-04-03更新
|
361次组卷
|
4卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
名校
解题方法
8 . 用“—”表示一对共用电子对,省略未成键电子即可得到结构式,例如NH3的结构式为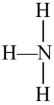 。已知一种麻醉剂的分子结构式如图所示,其中,X、Y、Z、W、E为原子序数依次增大的短周期元素,元素E的原子比W原子多8个电子。下列说法不正确的是
。已知一种麻醉剂的分子结构式如图所示,其中,X、Y、Z、W、E为原子序数依次增大的短周期元素,元素E的原子比W原子多8个电子。下列说法不正确的是
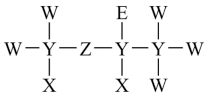
| A.XEZ是一种强氧化性弱酸 |
| B.X分别与Y、Z都能形成含非极性键的化合物 |
| C.原子半径:Y>Z>W>X |
| D.该分子中所有原子均满足8电子稳定结构 |
您最近一年使用:0次
2024-04-03更新
|
145次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
9 . 氟化钾镁是一种具有优良光学性能的材料,主要应用于激光领域,其立方晶胞结构如图。 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是
 表示阿伏加德罗常数的值。下列说法错误的是
表示阿伏加德罗常数的值。下列说法错误的是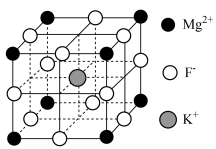
A. 的配位数为12 的配位数为12 |
B.每个 位于距其最近且等距的 位于距其最近且等距的 构成的正四面体空隙中 构成的正四面体空隙中 |
C.若 位于晶胞的体心,则 位于晶胞的体心,则 位于晶胞的面心 位于晶胞的面心 |
D.若晶胞参数为a nm,则晶体的密度是 |
您最近一年使用:0次
2024-04-02更新
|
1058次组卷
|
9卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
2024届河南省焦作市博爱县第一中学高三下学期三模化学试题东北三省2024届高三下学期三校二模联考化学试题黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)押题卷02(15+4题型) -2024高考化学考点必杀300题(新高考通用)重庆市渝西中学2023-2024学年高二下学期4月月考化学试题(已下线)压轴题10?晶体结构及相关计算(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)黑龙江省大庆市让胡路区大庆中学2024届高三下学期5月期中化学试题
名校
10 . Na2S2O3∙5H2O是重要的化工原料,有关制备和应用如下。
Ⅰ.制备Na2S2O3∙5H2O反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15gNa2SO3加入圆底烧瓶中,再加入80mL蒸馏水。另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60min。回答下列问题:
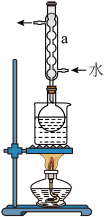
(1)硫粉在反应前用乙醇润湿的目的是_______ 。
(2)仪器a的作用是_________ 。
(3)产品中除了有未反应的Na2SO3外,还可能存在的无机杂质是________ ,检验是否存在该杂质的方法是________ 。
Ⅱ.分离Na2S2O3∙5H2O。已知:Na2S2O3∙5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。
分离Na2S2O3∙5H2O晶体的流程如图所示:
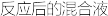

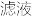




回答下列问题:
(4)为减少产品的损失,操作①要_______ (填操作),其目的是________ ;操作②的包括的过程是快速过滤、洗涤、干燥,其中洗涤操作是用_______ (填试剂)作洗涤剂。
(5)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时要控制温度不宜过高原因________ 。
Ⅲ.研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为10mL):
(6)探究浓度对化学反应速率的影响,应选择________ (填实验编号)。
(7)探究温度对化学反应速率的影响,应选择________ (填实验编号)。
Ⅰ.制备Na2S2O3∙5H2O反应原理:Na2SO3(aq)+S(s)
 Na2S2O3(aq)
Na2S2O3(aq)实验步骤:
①称取15gNa2SO3加入圆底烧瓶中,再加入80mL蒸馏水。另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60min。回答下列问题:

(1)硫粉在反应前用乙醇润湿的目的是
(2)仪器a的作用是
(3)产品中除了有未反应的Na2SO3外,还可能存在的无机杂质是
Ⅱ.分离Na2S2O3∙5H2O。已知:Na2S2O3∙5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。
分离Na2S2O3∙5H2O晶体的流程如图所示:
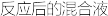

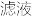




回答下列问题:
(4)为减少产品的损失,操作①要
(5)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时要控制温度不宜过高原因
Ⅲ.研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(6)探究浓度对化学反应速率的影响,应选择
(7)探究温度对化学反应速率的影响,应选择
您最近一年使用:0次



