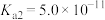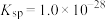解题方法
1 . 下列分子中,键能最小的是
| A.F2 | B.Br2 | C.Cl2 | D.N2 |
您最近一年使用:0次
2 . 目前,全世界镍(Ni)的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___________ 晶体;基态Ni原子的电子排布式为___________ 。
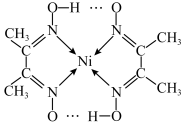
(2)某配合物结构如图所示,分子内含有的作用力有___________ (填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键___________ 。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于
(2)某配合物结构如图所示,分子内含有的作用力有
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
您最近一年使用:0次
解题方法
3 . 镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有___________ 。
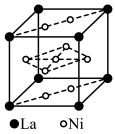
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:___________ 。___________ 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
解释表中氟化物熔点差异的原因:___________ 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:___________ 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异___________ 。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:
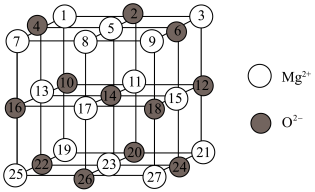
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:

| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: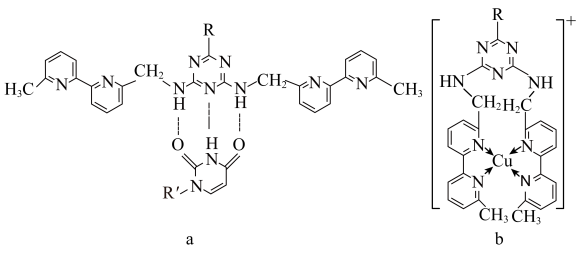
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异
您最近一年使用:0次
4 . 现有部分前四周期元素的性质或原子结构如下表:
(1)B单质分子中,含有___________ 个 键和
键和___________ 个 键,元素B的气态氢化物的空间型为
键,元素B的气态氢化物的空间型为___________ 。
(2)C单质的熔点___________ A单质的熔点(填“高于”或“低于”),其原因是:___________
(3)写出元素D基态原子的电子排布式:___________ 。
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 第三周期主族元素中其第一电离能最大 |
| D | 前四周期呀中其未成对电子数最多 |
 键和
键和 键,元素B的气态氢化物的空间型为
键,元素B的气态氢化物的空间型为(2)C单质的熔点
(3)写出元素D基态原子的电子排布式:
您最近一年使用:0次
5 . 下列化合物中既存在离子键,又存在极性键的是
| A.H2O | B.NH4Cl | C.Na2O | D.Na2O2 |
您最近一年使用:0次
名校
6 . 工业上利用图1流程制备的亚硝酸钠中常含有一定量的硝酸钠杂质,二者的溶解度随温度变化如图2所示。下列说法正确的是
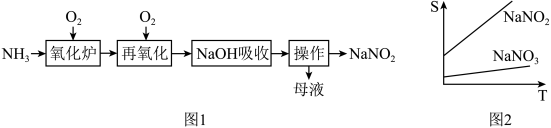

A.氧化炉中发生反应的化学方程式为: |
B.再氧化时氧气用量越多 产率越高 产率越高 |
| C.操作为蒸发浓缩、趁热过滤 |
D. 保护条件下,低温蒸干母液所得固体主要是 保护条件下,低温蒸干母液所得固体主要是 |
您最近一年使用:0次
7 . 下列陈述I和陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | HCl的酸性强于CH3COOH | 盐酸的pH一定小于醋酸溶液 |
| B | 通过煤的干馏可获得苯、甲苯等化工原料 | 煤的干馏属于化学变化 |
| C | 将Cl2通入溴水中,溴水褪色 | Cl2具有漂白性 |
| D | 将金属Na加入CuSO4溶液中,析出红色固体 | 还原性:Na>Cu |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-23更新
|
845次组卷
|
2卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
名校
解题方法
8 . 硒 是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:
是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:_______ 区。
(2) 与S同主族,则基态硒原子的核外电子排布式为
与S同主族,则基态硒原子的核外电子排布式为_______ 。
(3) 、O、N的第一电离能由大到小的顺序为
、O、N的第一电离能由大到小的顺序为_______ 。
(4)比较键角大小:气态 分子
分子_______  离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
(5)根据价层电子对互斥理论,可以推知 的空间构型为
的空间构型为_______ (用文字描述),其中 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为_______ 。
(6)甲硒醇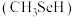 可增加抗癌效力,下表中有机物沸点不同的原因是
可增加抗癌效力,下表中有机物沸点不同的原因是_______ 。
(7)化合物X是通过理论计算的方法筛选出的潜在热电材料之一,其晶胞结构如题图1,沿x、y、z轴方向的投影均为题图2。则X的化学式为_______ 。
 是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示:
是人体必需微量元素之一,含硒化合物在药物和材料等领域具有广泛的应用。乙烷硒啉是一种抗癌新药,其结构式如下图所示: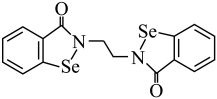
(2)
 与S同主族,则基态硒原子的核外电子排布式为
与S同主族,则基态硒原子的核外电子排布式为(3)
 、O、N的第一电离能由大到小的顺序为
、O、N的第一电离能由大到小的顺序为(4)比较键角大小:气态
 分子
分子 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(5)根据价层电子对互斥理论,可以推知
 的空间构型为
的空间构型为 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为(6)甲硒醇
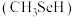 可增加抗癌效力,下表中有机物沸点不同的原因是
可增加抗癌效力,下表中有机物沸点不同的原因是| 有机物 | 甲醇 | 甲硫醇 | 甲硒醇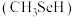 |
| 沸点/℃ | 64.7 | 5.95 | 25.05 |
(7)化合物X是通过理论计算的方法筛选出的潜在热电材料之一,其晶胞结构如题图1,沿x、y、z轴方向的投影均为题图2。则X的化学式为
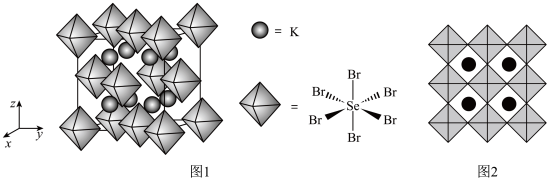
您最近一年使用:0次
2024-04-19更新
|
294次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
9 . 碳酸铈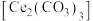 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示:
①“酸浸”后铈元素主要以 的形式存在;
的形式存在;
② 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。
(1)“焙烧”时,从焙烧室的底部通入空气的目的是____________________ 。
(2)“滤渣1”的主要成分为__________ 。
(3)“还原”时,加入硫脲( )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为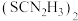 。
。
①该反应的离子方程式为____________________ 。
②硫脲属于__________ (填“极性”或“非极性”)分子,该分子中键角
__________ 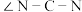 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为______________________________________________________________________ 。
(5)若“沉淀”后,溶液的pH为6,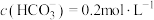 ,此时
,此时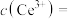
__________ 。已知常温下:
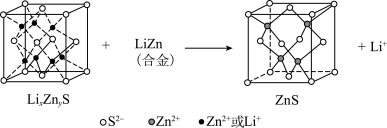
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示: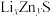 中,
中,
__________ 。
②ZnS晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为__________  (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为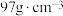 )。
)。
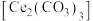 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示: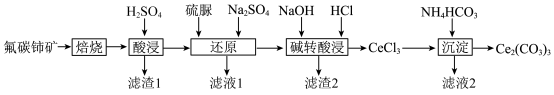
①“酸浸”后铈元素主要以
 的形式存在;
的形式存在;②
 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。(1)“焙烧”时,从焙烧室的底部通入空气的目的是
(2)“滤渣1”的主要成分为
(3)“还原”时,加入硫脲(
 )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为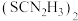 。
。①该反应的离子方程式为
②硫脲属于

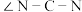 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(5)若“沉淀”后,溶液的pH为6,
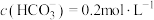 ,此时
,此时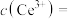
|
| |
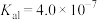 |
|
|
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示:
 中,
中,
②ZnS晶胞中,
 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为 (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为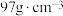 )。
)。
您最近一年使用:0次
2024-04-15更新
|
316次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
10 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确 的是
实验目的 | 方案设计 | 现象和结论 | |
A | 探究 与 与 反应的限度 反应的限度 | 取5mL  溶液于试管中,加入1mL 溶液于试管中,加入1mL  溶液,充分反应后滴入5滴15% 溶液,充分反应后滴入5滴15% 溶液 溶液 | 若溶液变血红色,则 与 与 的反应有一定限度 的反应有一定限度 |
B | 探究乙酰水杨酸样品中是否含有水杨酸 | 取少量样品,加入3mL蒸馏水和少量乙醇,振荡,再加入1-2滴 溶液 溶液 | 若有紫色沉淀生成,则该产品中含有水杨酸 |
C | 检验家里空气中是否含有甲醛 | 用注射器多次抽取空气,慢慢注入盛有酸性 稀溶液的同一试管中,观察溶液颜色变化 稀溶液的同一试管中,观察溶液颜色变化 | 若溶液不变色,说明空气中几乎不含甲醛 |
D | 探究铝配合物的形成 | 取1mL  溶液于试管中,加入2mL饱和 溶液于试管中,加入2mL饱和 溶液,再加入1mL 溶液,再加入1mL  溶液 溶液 | 若无沉淀生成,说明 与 与 形成了稳定的配合物 形成了稳定的配合物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-15更新
|
411次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题