名校
解题方法
1 . X、Y、Z、W为原子序数依次增大的前两周期元素,基态Y原子的s能级电子数是p能级的2倍,基态W原子有两个未成对电子,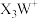 是10电子微粒,可形成离子液体
是10电子微粒,可形成离子液体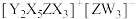 。下列说法正确的是
。下列说法正确的是
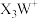 是10电子微粒,可形成离子液体
是10电子微粒,可形成离子液体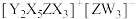 。下列说法正确的是
。下列说法正确的是A.电负性: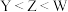 |
B.简单气态氢化物稳定性: |
C.键能: |
D. 中所有原子最外层均满足8电子结构 中所有原子最外层均满足8电子结构 |
您最近一年使用:0次
2024-05-06更新
|
134次组卷
|
2卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
2 . 下列化学反应表示不正确的是
A.硝酸受热分解的化学反应方程式: |
B.ICl与 溶液反应: 溶液反应: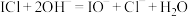 |
C. 溶于 溶于 溶液: 溶液: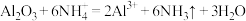 |
D.工业上,可通过电解KF的无水HF溶液(含 和 和 )制取 )制取 ,则 ,则 在阴极放电反应为 在阴极放电反应为 |
您最近一年使用:0次
2024-05-06更新
|
172次组卷
|
2卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
3 . 某研究性学习小组进行某补血剂中铁元素( 价)含量测定的实验,其流程如下:
价)含量测定的实验,其流程如下:不 正确的是
 价)含量测定的实验,其流程如下:
价)含量测定的实验,其流程如下: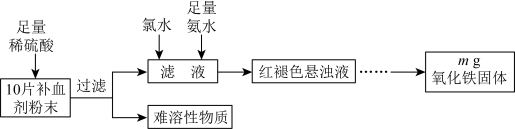
A.向过滤后的滤液中滴加 溶液,溶液可能呈红色 溶液,溶液可能呈红色 |
B.可以用 替代上述流程中的氯水 替代上述流程中的氯水 |
| C.红褐色悬浊液经过滤、洗涤、干燥,得到氧化铁固体 |
D.每片补血剂中铁元素的质量为 |
您最近一年使用:0次
2024-05-06更新
|
300次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
4 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和 ),其反应的化学方程式为
),其反应的化学方程式为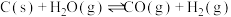 ,请回答下列问题:
,请回答下列问题:
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示: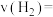
_______ 。
②甲容器中,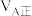
_______ 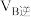 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。
③反应过程中,两个容器温度:甲_______ 乙。
(4)乙容器中C点时,CO的物质的量百分数为_______ 。
 ),其反应的化学方程式为
),其反应的化学方程式为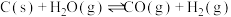 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。

| A.铝粉与氧化铁的反应 | B.氯化铵与 的反应 的反应 |
| C.锌片与稀硫酸的反应 | D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
| A.充入He使容器压强增大,提高反应速率 |
B.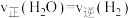 ,说明反应达到平衡状态 ,说明反应达到平衡状态 |
| C.容器中焦炭的质量不再变化,说明反应达到平衡状态 |
D.容器中水蒸气与氢气的体积比为 时,说明反应达到平衡状态 时,说明反应达到平衡状态 |
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示:
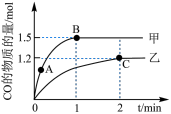
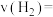
②甲容器中,
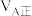
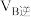 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。③反应过程中,两个容器温度:甲
(4)乙容器中C点时,CO的物质的量百分数为
您最近一年使用:0次
2024-05-03更新
|
304次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
5 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式______________ ;若反应后尾气无残留,则参加反应的 、NO物质的量比值为
、NO物质的量比值为_____ (填字母)。
a.≥1 b.≤1 c.任意值
(2)可使用适量酸性 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(4)有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是___________ 。
(5)羟基自由基( )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程:______________ 。 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加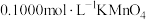 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗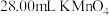 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数__________ 。(写出计算过程)
 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: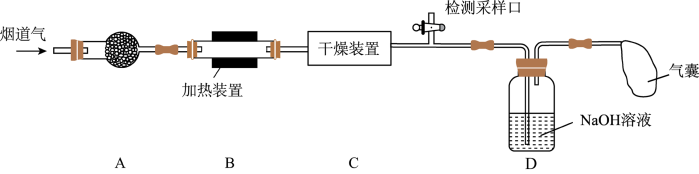
 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
(2)可使用适量酸性
 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性
 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是(4)有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: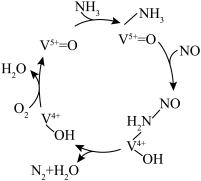
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(5)羟基自由基(
 )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程: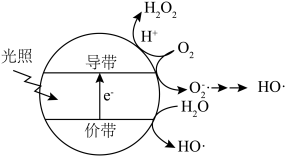
 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加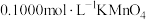 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗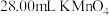 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数
您最近一年使用:0次
2024-05-03更新
|
259次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
6 . 类比推理是化学中常用的思维方法。下列推理正确的是
| A.Al2O3与酸和强碱均反应,Al2O3为两性氧化物,推测SiO2与氢氟酸和碱反应也是两性氧化物。 |
| B.Mg-Al原电池在稀硫酸介质中Mg作负极,推测在稀氢氧化钠溶液介质中Mg也作负极 |
| C.CO2通入Ba(NO3)2溶液中无白色沉淀产生,推测SO2通入Ba(NO3)2溶液中也无白色沉淀产生 |
| D.CO2通入紫色石蕊试液能显红色,推测SO2通入紫色石蕊试液也能显红色 |
您最近一年使用:0次
2024-05-03更新
|
535次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
7 . 下列指定反应的离子方程式书写正确的是
A.将氯气通入水中: |
B. 溶液与少量的 溶液与少量的 溶液混合: 溶液混合: |
C. 通入酸性高锰酸钾溶液:5SO2+2 通入酸性高锰酸钾溶液:5SO2+2 +2H2O = 5 +2H2O = 5 +2Mn2++4H+ +2Mn2++4H+ |
D.向硫酸酸化的 溶液中通入O2: 溶液中通入O2: |
您最近一年使用:0次
2024-05-03更新
|
259次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
8 . 设 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.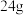 乙烯和丙烯的混合气体中p-p 乙烯和丙烯的混合气体中p-p 键数目为 键数目为 |
B. 氯化铵溶液中 氯化铵溶液中 和 和 数目之和为 数目之和为 |
C.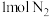 和 和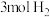 充分反应后的混合气体中原子数小于 充分反应后的混合气体中原子数小于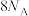 |
D.25℃时,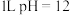 的氨水中含有 的氨水中含有 数目为 数目为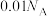 |
您最近一年使用:0次
2024-04-29更新
|
913次组卷
|
4卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
2024届河南省焦作市博爱县第一中学高三下学期三模化学试题贵州省黔西南州部分学校2024届高三一模化学试卷(已下线)题型3 有关NA的综合考查(25题)-2024年高考化学常考点必杀300题(新高考通用)河北省重点高中2023-2024学年高三下学期第三次模拟化学试题
解题方法
9 . 三草酸合铁酸钾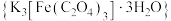 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: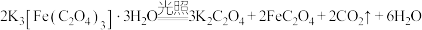 。回答下列问题:
。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ,基态 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)1个 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为___________ , 分子的立体构型为
分子的立体构型为___________ 。
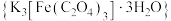 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: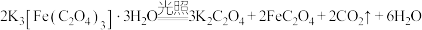 。回答下列问题:
。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)1个
 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为 分子的立体构型为
分子的立体构型为
您最近一年使用:0次
解题方法
10 . 含硼物质在生产生活中有着广泛应用。回答下列问题:
(1)一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于_______ 晶体,熔点比晶体硼_______ (填“高”或“低”)。
(2)N-甲基咪唑的结构为 ,它的某种衍生物与
,它的某种衍生物与 形成的离子化合物
形成的离子化合物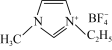 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
(1)一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于
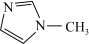
(2)N-甲基咪唑的结构为
 ,它的某种衍生物与
,它的某种衍生物与 形成的离子化合物
形成的离子化合物 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①离子化合物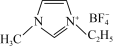 熔点低的原因是
熔点低的原因是
②分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。
)。 中存在大π键,其分子中的大π键可表示为
中存在大π键,其分子中的大π键可表示为
③1mol离子化合物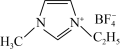 中,阿伏加德罗常数的值为
中,阿伏加德罗常数的值为 ,则根据价电子对互斥(
,则根据价电子对互斥( )理论,空间结构为四面体的原子共有
)理论,空间结构为四面体的原子共有
您最近一年使用:0次



