名校
解题方法
1 . 实验室由1,3,5-三甲苯(密度为0.87gcm3)为主要有机原料制备2,4,6-三甲基苯甲酸的反应原理为 相关信息如下表:
相关信息如下表:
| 物质 | 性状 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1,3,5-三甲苯(Mr=120) | 无色液体 | -44.8 | 164.7 | 难溶于水、酸、碱 |
| 2,4,6-三甲基苯甲酸(Mr=164) | 白色固体 | 155 | 296 | 微溶于冷水,能溶于热水,易溶于碱 |
| 六甲基二苯甲酮 | 白色粉末 | 136 | 340 | 难溶于水、酸、碱 |

①在装置甲仪器a中加入8.0g无水AlCl3、20mL1,3,5-三甲苯,并控制温度40℃。
②打开分液漏斗活塞和K1,通入过量干燥纯净的CO2气体,加热D回流20~30min。
③关闭分液漏斗活塞和K1。取下球形冷凝管,接装置乙加热蒸馏,回收未反应完的1,3,5-三甲苯。
④将仪器a中的混合物倒入NaOH溶液中,调节pH至8~9,过滤。
⑤向滤液中加入稀盐酸调节pH=2,过滤、洗涤干燥,再将粗品进行纯化,得到19.0g白色固体。
回答下列问题:
(1)仪器a的名称为
(2)为获得干燥纯净的CO2气体,装置B、C中所盛试剂分别为
(3)装置乙中,冷凝水的进水口为
(4)步骤④中过滤得到的沉淀中包含Al(OH)3和六甲基二苯甲酮,从该沉淀中获得六甲基二苯甲酮的实验方法为
(5)①2,4,6-三甲基苯甲酸、②苯甲酸、③2,4,6-三氟苯甲酸,三种酸的酸性由强到弱的顺序为
(6)本实验的产率为
您最近一年使用:0次
2024-03-11更新
|
311次组卷
|
3卷引用:2024届河南省焦作市普通高中高三上学期第一次模拟考试理科综合试题-高中化学
名校
2 . 一种双阴极微生物燃料电池的装置如图所示(燃料为C2H4O2)。
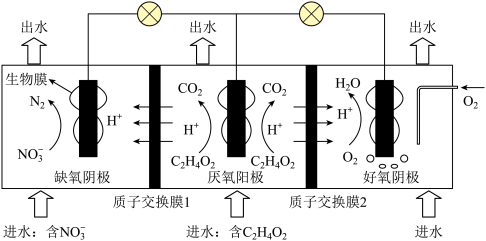
| A.放电时,通过质子交换膜1和2的H+数一定相等 |
B.“缺氧阴极”的电极反应式为 |
| C.“出水”与“进水”相比,“缺氧阴极”区域质量减轻,“好氧阴极”区域质量增加 |
| D.“厌氧阳极”若流出1mol电子,该区域“出水”比“进水”减轻了11g(假设气体全部逸出) |
您最近一年使用:0次
2024-03-11更新
|
399次组卷
|
5卷引用:2024届河南省焦作市普通高中高三上学期第一次模拟考试理科综合试题-高中化学
3 . 甲烷与水蒸气反应可转化为 和
和 ,每有1mol
,每有1mol 生成,反应吸收41.3kJ的热量。向体积为1L的恒容密闭容器中充入1mol
生成,反应吸收41.3kJ的热量。向体积为1L的恒容密闭容器中充入1mol ,同时充入水蒸气,使
,同时充入水蒸气,使 与
与 的物质的量之比分别为4∶1、1∶1、1∶4,在不同温度下充分反应达到平衡,
的物质的量之比分别为4∶1、1∶1、1∶4,在不同温度下充分反应达到平衡, 的平衡转化率
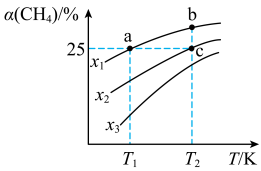
的平衡转化率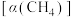 与物料比(x)、温度的关系如图所示。下列说法正确的是
与物料比(x)、温度的关系如图所示。下列说法正确的是
 和
和 ,每有1mol
,每有1mol 生成,反应吸收41.3kJ的热量。向体积为1L的恒容密闭容器中充入1mol
生成,反应吸收41.3kJ的热量。向体积为1L的恒容密闭容器中充入1mol ,同时充入水蒸气,使
,同时充入水蒸气,使 与
与 的物质的量之比分别为4∶1、1∶1、1∶4,在不同温度下充分反应达到平衡,
的物质的量之比分别为4∶1、1∶1、1∶4,在不同温度下充分反应达到平衡, 的平衡转化率
的平衡转化率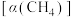 与物料比(x)、温度的关系如图所示。下列说法正确的是
与物料比(x)、温度的关系如图所示。下列说法正确的是
A. 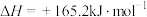 |
B. 时,当充入的 时,当充入的 和 和 的物质的量之比为1∶4时, 的物质的量之比为1∶4时, 的平衡转化率为25% 的平衡转化率为25% |
C.平衡常数: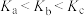 |
| D.当容器中混合气体的密度不变时,反应达到平衡状态 |
您最近一年使用:0次
2024-03-10更新
|
111次组卷
|
2卷引用:河南省焦作市2023-2024学年高二上学期1月期末化学试题
4 . 2-丁炔可发生如下转化,下列说法不正确 的是

| A.2-丁炔分子中最多有6个原子共面 |
| B.X与酸性KMnO4溶液反应可生成CH3COOH |
| C.Y可以发生银镜反应 |
| D.高分子Z可能存在顺式结构和反式结构 |
您最近一年使用:0次
2024-03-08更新
|
533次组卷
|
6卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题
河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题浙江省温州市普通高中2024届高三上学期第一次适应性考试(一模)化学试题(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题06 有机化合物(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)河北省石家庄市第十七中学2023-2024学年高二下学期第一次月考化学试题浙江省部分学校2024届高三下学期模拟考试化学试卷
解题方法
5 . 某天然水中含有 、
、 、
、 、
、 等离子,降低水中部分离子浓度有多种方法。
等离子,降低水中部分离子浓度有多种方法。
方法一:电渗析法。模拟装置如图所示,M、N极均为石墨。
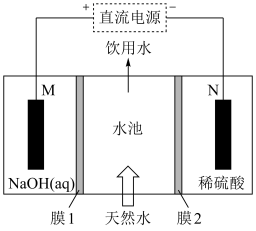
(1)电解一段时间后,_________ (填“M”或“N”)极区产生沉淀,其化学式为___________ 。
(2)M极是________ 极(填“阳”或“阴”)。膜2是_________ 交换膜(填“阳离子”或“阴离子”)。
(3)向M极区迁移的离子总数___________ (填“大于”“小于”或“等于”)向N极区迁移的离子总数。M极的主要电极反应式为___________ 。
方法二:离子交换法。其示意图如图所示。已知:离子交换法净化水的原理:水通过阳离子交换柱时,阳离子被吸附, 被交换到水中;水通过阴离子交换柱时,阴离子被吸附,
被交换到水中;水通过阴离子交换柱时,阴离子被吸附, 被交换到水中。
被交换到水中。
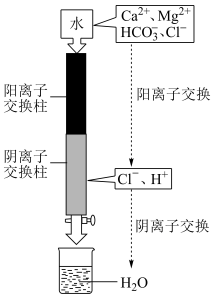
(4)阳离子交换柱中发生化学反应,其离子方程式为___________ 。
(5)天然水在离子交换过程中,导电率___________ (填“增大”“减小”或“不变”)。
(6)阴离子交换柱中发生反应的离子方程式为___________ 。
 、
、 、
、 、
、 等离子,降低水中部分离子浓度有多种方法。
等离子,降低水中部分离子浓度有多种方法。方法一:电渗析法。模拟装置如图所示,M、N极均为石墨。

(1)电解一段时间后,
(2)M极是
(3)向M极区迁移的离子总数
方法二:离子交换法。其示意图如图所示。已知:离子交换法净化水的原理:水通过阳离子交换柱时,阳离子被吸附,
 被交换到水中;水通过阴离子交换柱时,阴离子被吸附,
被交换到水中;水通过阴离子交换柱时,阴离子被吸附, 被交换到水中。
被交换到水中。
(4)阳离子交换柱中发生化学反应,其离子方程式为
(5)天然水在离子交换过程中,导电率
(6)阴离子交换柱中发生反应的离子方程式为
您最近一年使用:0次
6 . 氯气及其某些氧化物均能用于饮用水的消毒杀菌。
(1)1868年,狄肯和洪特发明了用氯化铜作催化剂,在加热时,用空气中的氧气氧化氯化氢气体制取氯气的方法,同时生成水蒸气。
已知:①
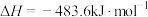
②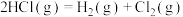
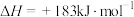
写出上述方法制备氯气的热化学方程式:___________ 。
(2)用 的强氧化性来去除烟气中的
的强氧化性来去除烟气中的 、NO等污染气体,涉及的部分反应如下:
、NO等污染气体,涉及的部分反应如下:
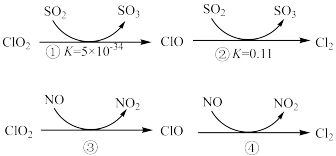
保持其他条件不变,对比添加NO、不添加NO两种情况,测得 氧化率随
氧化率随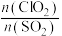 变化关系如图所示。
变化关系如图所示。
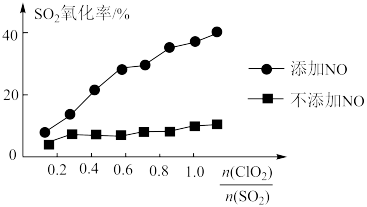
①写出 与NO反应的总化学方程式:
与NO反应的总化学方程式:___________ 。
②添加NO后, 氧化率明显提高,其原因可能是
氧化率明显提高,其原因可能是___________ 。
(3)在5L恒容密闭容器中充入8mol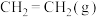 、2mol
、2mol 、4mol
、4mol 发生反应:
发生反应: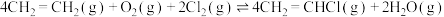
 ,平衡时其中三个组分的物质的量与温度的关系如图所示。
,平衡时其中三个组分的物质的量与温度的关系如图所示。
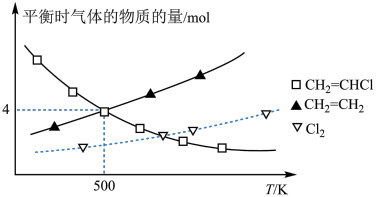
①下列措施既能提高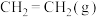 的平衡转化率,又能增大化学反应速率的是
的平衡转化率,又能增大化学反应速率的是_______ (填字母)。
A.升高温度 B.增大压强 C.加入催化剂 D.移出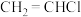
②500K条件下,平衡时 的物质的量浓度是
的物质的量浓度是___________ 。
③500K时,该反应的平衡常数
___________ 。
(1)1868年,狄肯和洪特发明了用氯化铜作催化剂,在加热时,用空气中的氧气氧化氯化氢气体制取氯气的方法,同时生成水蒸气。
已知:①

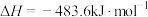
②
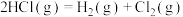
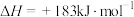
写出上述方法制备氯气的热化学方程式:
(2)用
 的强氧化性来去除烟气中的
的强氧化性来去除烟气中的 、NO等污染气体,涉及的部分反应如下:
、NO等污染气体,涉及的部分反应如下:
保持其他条件不变,对比添加NO、不添加NO两种情况,测得
 氧化率随
氧化率随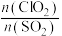 变化关系如图所示。
变化关系如图所示。
①写出
 与NO反应的总化学方程式:
与NO反应的总化学方程式:②添加NO后,
 氧化率明显提高,其原因可能是
氧化率明显提高,其原因可能是(3)在5L恒容密闭容器中充入8mol
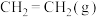 、2mol
、2mol 、4mol
、4mol 发生反应:
发生反应: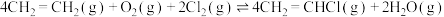
 ,平衡时其中三个组分的物质的量与温度的关系如图所示。
,平衡时其中三个组分的物质的量与温度的关系如图所示。
①下列措施既能提高
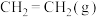 的平衡转化率,又能增大化学反应速率的是
的平衡转化率,又能增大化学反应速率的是A.升高温度 B.增大压强 C.加入催化剂 D.移出
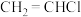
②500K条件下,平衡时
 的物质的量浓度是
的物质的量浓度是③500K时,该反应的平衡常数

您最近一年使用:0次
解题方法
7 . 海水中的闸门易发生腐蚀(如图1),可以通过电化学方法对闸门进行保护(如图2)。下列说法错误的是
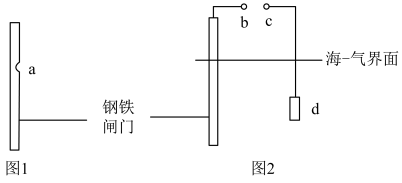

| A.图1中a处在海水常在的水位附近 |
| B.图1中发生析氢腐蚀 |
| C.图2中,若b、c直接用导线连接,d为锌块,则为牺牲阳极法 |
| D.图2中,若b、c外接电源,则d为惰性电极 |
您最近一年使用:0次
解题方法
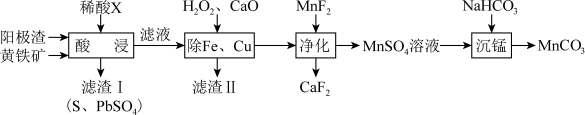
8 . 电解制锰的阳极渣主要成分是 ,还含有少量PbO、CuO及铁的氧化物,以阳极渣和黄铁矿
,还含有少量PbO、CuO及铁的氧化物,以阳极渣和黄铁矿 为原料可制备
为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知常温下,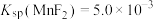 ,
, 。
。
(1)加快“酸浸”速率的措施有___________ (填两条)。稀酸X为___________ (填名称)。“酸浸”时 中的铁元素转化为
中的铁元素转化为 ,则该反应中氧化剂与还原剂的物质的量之比为
,则该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)滤渣Ⅱ的主要成分为 、
、 、
、___________ (填化学式)。
(3)加入 时发生反应的离子方程式为
时发生反应的离子方程式为___________ 。如果“净化”所得溶液中 的浓度为
的浓度为 ,则溶液中
,则溶液中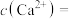
___________  。
。
(4) 溶液中的元素守恒式为
溶液中的元素守恒式为___________ 。加入 溶液进行“沉锰”,写出该反应的离子方程式:
溶液进行“沉锰”,写出该反应的离子方程式:___________ 。
 ,还含有少量PbO、CuO及铁的氧化物,以阳极渣和黄铁矿
,还含有少量PbO、CuO及铁的氧化物,以阳极渣和黄铁矿 为原料可制备
为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知常温下,
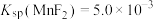 ,
, 。
。(1)加快“酸浸”速率的措施有
 中的铁元素转化为
中的铁元素转化为 ,则该反应中氧化剂与还原剂的物质的量之比为
,则该反应中氧化剂与还原剂的物质的量之比为(2)滤渣Ⅱ的主要成分为
 、
、 、
、(3)加入
 时发生反应的离子方程式为
时发生反应的离子方程式为 的浓度为
的浓度为 ,则溶液中
,则溶液中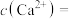
 。
。(4)
 溶液中的元素守恒式为
溶液中的元素守恒式为 溶液进行“沉锰”,写出该反应的离子方程式:
溶液进行“沉锰”,写出该反应的离子方程式:
您最近一年使用:0次
9 . 现有四种弱酸,它们在常温下的电离平衡常数如下表所示:
下列说法错误的是
| 弱酸 | HCOOH |  |  | HCN |
| 电离平衡常数 |  |   | 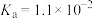 | 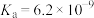 |
A. 、 、 、 、 、 、 结合质子的能力由大到小的顺序为 结合质子的能力由大到小的顺序为 |
B.向 溶液中通入 溶液中通入 时不会反应生成 时不会反应生成 |
C.向NaCN溶液中通入少量 时生成碳酸氢钠和HCN 时生成碳酸氢钠和HCN |
D.常温下,向HCOOH溶液中加入一定量的 ,所得溶液的 ,所得溶液的 ,则混合液中 ,则混合液中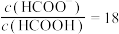 |
您最近一年使用:0次
解题方法
10 . 25℃时两种一元弱酸HA、HB水溶液进行稀释时的pH变化如图所示,其中Ⅰ为HA水溶液,Ⅱ为HB水溶液。下列有关说法正确的是


| A.相同温度下,HA的电离常数小于HB的电离常数 |
B.相同浓度的NaA溶液与NaB溶液中存在: |
| C.图示中a、c点时的氢氧根离子浓度与酸根离子浓度比值关系:a>c |
D.pH相同的NaA溶液和NaB溶液中酸根离子浓度关系: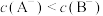 |
您最近一年使用:0次



