名校
1 . Na2S2O3∙5H2O是重要的化工原料,有关制备和应用如下。
Ⅰ.制备Na2S2O3∙5H2O反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15gNa2SO3加入圆底烧瓶中,再加入80mL蒸馏水。另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60min。回答下列问题:
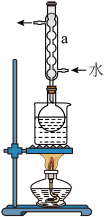
(1)硫粉在反应前用乙醇润湿的目的是_______ 。
(2)仪器a的作用是_________ 。
(3)产品中除了有未反应的Na2SO3外,还可能存在的无机杂质是________ ,检验是否存在该杂质的方法是________ 。
Ⅱ.分离Na2S2O3∙5H2O。已知:Na2S2O3∙5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。
分离Na2S2O3∙5H2O晶体的流程如图所示:





回答下列问题:
(4)为减少产品的损失,操作①要_______ (填操作),其目的是________ ;操作②的包括的过程是快速过滤、洗涤、干燥,其中洗涤操作是用_______ (填试剂)作洗涤剂。
(5)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时要控制温度不宜过高原因________ 。
Ⅲ.研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为10mL):
(6)探究浓度对化学反应速率的影响,应选择________ (填实验编号)。
(7)探究温度对化学反应速率的影响,应选择________ (填实验编号)。
Ⅰ.制备Na2S2O3∙5H2O反应原理:Na2SO3(aq)+S(s)
 Na2S2O3(aq)
Na2S2O3(aq)实验步骤:
①称取15gNa2SO3加入圆底烧瓶中,再加入80mL蒸馏水。另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60min。回答下列问题:

(1)硫粉在反应前用乙醇润湿的目的是
(2)仪器a的作用是
(3)产品中除了有未反应的Na2SO3外,还可能存在的无机杂质是
Ⅱ.分离Na2S2O3∙5H2O。已知:Na2S2O3∙5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。
分离Na2S2O3∙5H2O晶体的流程如图所示:
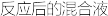

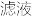




回答下列问题:
(4)为减少产品的损失,操作①要
(5)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时要控制温度不宜过高原因
Ⅲ.研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(6)探究浓度对化学反应速率的影响,应选择
(7)探究温度对化学反应速率的影响,应选择
您最近一年使用:0次
11-12高二下·甘肃天水·阶段练习
名校
解题方法
2 . 碳化硅的一种晶体(SiC)具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列三种晶体:①金刚石②晶体硅③碳化硅中,它们的熔点由高到低的顺序是
| A.①③② | B.②③① | C.③①② | D.②①③ |
您最近一年使用:0次
2024-04-02更新
|
235次组卷
|
16卷引用:河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷
河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷(已下线)2011-2012学年甘肃省甘谷一中高二下学期第二次月考化学试卷(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷2014-2015福建省漳浦县三校高二下学期期中化学试卷2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:3.2 分子晶体与原子晶体(第2课时)贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题福建省莆田第二十五中学2019-2020学年高二下学期返校考试化学试题江苏省泗阳县众兴中学2020-2021学年高二上学期10月月考化学试题江苏省泗阳县实验高级中学2021-2022学年高二上学期第一次质量调研化学试题宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题云南省蒙自一中2021-2022学年高二下学期3月份考试化学试题福建省莆田第十五中学2021-2022学年高二下学期期中考试化学试题(已下线)第三章章节专项提升(已下线)3.2.2 共价晶体课堂例题
名校
3 . Ⅰ.某研究小组利用无水乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如下图所示,请回答:
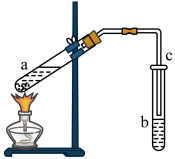
(1)利用无水乙醇、乙酸和浓硫酸制取乙酸乙酯反应的化学方程式为:___________ 。
(2)实验时下列做法正确的是_______ (填序号)
A.先加入浓硫酸,然后边振荡边加入乙醇和乙酸
B.试管a中应加入碎瓷片
C.试管b中应加入饱和 溶液
溶液
D.导管c下端管口不能伸入试管b的溶液中
E.加入过量无水乙醇,可以使乙酸完全反应
F.可以用稀硫酸代替浓硫酸
(3)试管b中溶液作用是:吸收乙醇、_______ 和________ 。
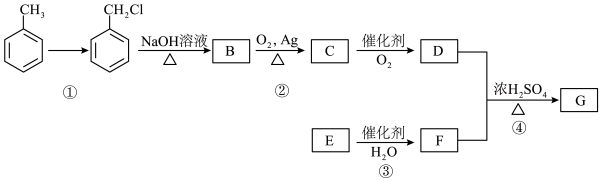
Ⅱ.某有机物G的合成路线如下
已知:① (R代表烃基,下同)
(R代表烃基,下同)
②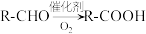
③E的产量可衡量一个国家石油化工的发展水平
回答下列问题:
(4)反应①的反应物(除 外)及反应条件分别是
外)及反应条件分别是_______ 、________ 。
(5)B中所含官能团名称为________ ;G的结构简式为_______ 。
(6)反应②的化学方程式为________ ,属于氧化反应。
(7)写出分子式为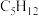 且一氯代物只有1种的有机物的结构简式
且一氯代物只有1种的有机物的结构简式________ ,该有机物的习惯命名是_______ 。

(1)利用无水乙醇、乙酸和浓硫酸制取乙酸乙酯反应的化学方程式为:
(2)实验时下列做法正确的是
A.先加入浓硫酸,然后边振荡边加入乙醇和乙酸
B.试管a中应加入碎瓷片
C.试管b中应加入饱和
 溶液
溶液 D.导管c下端管口不能伸入试管b的溶液中
E.加入过量无水乙醇,可以使乙酸完全反应
F.可以用稀硫酸代替浓硫酸
(3)试管b中溶液作用是:吸收乙醇、
Ⅱ.某有机物G的合成路线如下

已知:①
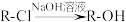 (R代表烃基,下同)
(R代表烃基,下同)②
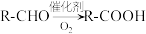
③E的产量可衡量一个国家石油化工的发展水平
回答下列问题:
(4)反应①的反应物(除
 外)及反应条件分别是
外)及反应条件分别是(5)B中所含官能团名称为
(6)反应②的化学方程式为
(7)写出分子式为
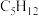 且一氯代物只有1种的有机物的结构简式
且一氯代物只有1种的有机物的结构简式
您最近一年使用:0次
名校
4 . H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。
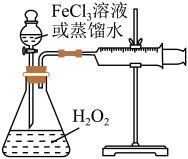
(1)①写出锥形瓶中反应的化学方程式________ 。
②设计实验方案:在不同条件下,测定_______ 。(要求所测得的数据能直接体现反应速率大小)
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
①表格中a=_______ ,b=________ 。
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是________ 。
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为_______ 。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴_______ 溶液,产生蓝色沉淀。
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因______ 。

(1)①写出锥形瓶中反应的化学方程式
②设计实验方案:在不同条件下,测定
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
| 实验序号 | 10%H2O2/mL | 蒸馏水/mL | 0.2mol·LFeCl3溶液/mL | 现象 |
| I | 10 | a | 0 | 无明显变化 |
| Ⅱ | 10 | b | 2 | 锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅 |
| Ⅲ | 5 | 5 | 2 | 锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快 |
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因
您最近一年使用:0次
名校
5 . 二氧化碳加氢制甲醇可以实现温室气体资源化利用,过程中的主要反应为
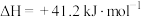

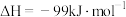
密闭容器中,反应物起始物质的量比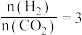 时,在不同条件下(①温度为250℃下压强变化,②压强为
时,在不同条件下(①温度为250℃下压强变化,②压强为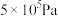 下温度变化)达到平衡时
下温度变化)达到平衡时 物质的量分数变化如图所示。下列有关说法正确的是
物质的量分数变化如图所示。下列有关说法正确的是

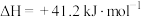

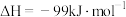
密闭容器中,反应物起始物质的量比
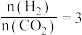 时,在不同条件下(①温度为250℃下压强变化,②压强为
时,在不同条件下(①温度为250℃下压强变化,②压强为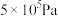 下温度变化)达到平衡时
下温度变化)达到平衡时 物质的量分数变化如图所示。下列有关说法正确的是
物质的量分数变化如图所示。下列有关说法正确的是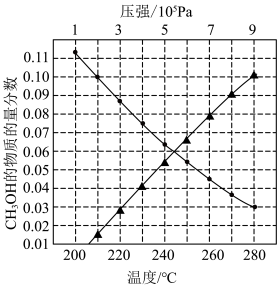
A.反应 的焓变 的焓变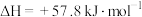 |
B.在250℃、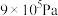 条件下,平衡时甲醇的物质的量分数为0.10 条件下,平衡时甲醇的物质的量分数为0.10 |
C.当甲醇的物质的量分数为0.03时, 的平衡转化率为11.3% 的平衡转化率为11.3% |
D.提高 转化为 转化为 的平衡转化率,需要研发在高温区的高效催化剂 的平衡转化率,需要研发在高温区的高效催化剂 |
您最近一年使用:0次
2024-04-01更新
|
276次组卷
|
3卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
名校
6 . 利用离子液体 可电沉积还原金属Ge,其中
可电沉积还原金属Ge,其中 的结构如图所示。下列有关说法错误的是
的结构如图所示。下列有关说法错误的是
 可电沉积还原金属Ge,其中
可电沉积还原金属Ge,其中 的结构如图所示。下列有关说法错误的是
的结构如图所示。下列有关说法错误的是
| A.该离子液体能导电 | B. 的空间构型为正四面体形 的空间构型为正四面体形 |
C.该物质中碳原子的杂化类型为 | D.电解沉积金属时,金属在阴极析出 |
您最近一年使用:0次
2024-04-01更新
|
246次组卷
|
3卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
2024届河南省焦作市博爱县第一中学高三下学期三模化学试题安徽省池州市2024届高三教学质量统一监测(二模)化学试题(已下线)高二化学下学期期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(江苏专用)
名校
解题方法
7 . 莫尔盐 常被用作氧化还原滴定的基准物,其晶体的部分结构如图所示。下列说法错误的是
常被用作氧化还原滴定的基准物,其晶体的部分结构如图所示。下列说法错误的是
 常被用作氧化还原滴定的基准物,其晶体的部分结构如图所示。下列说法错误的是
常被用作氧化还原滴定的基准物,其晶体的部分结构如图所示。下列说法错误的是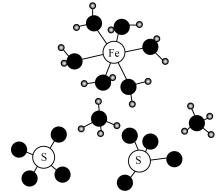
A.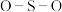 的键角: 的键角: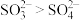 | B.基态原子第一电离能: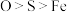 |
C.基态 的未成对电子数为4个 的未成对电子数为4个 | D.晶体中的化学键有离子键、共价键和配位键 |
您最近一年使用:0次
2024-04-01更新
|
372次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
8 . 中国科学院大连化学物理研究所和西湖大学合作合成出一种新的高分子材料(如图所示,硫原子连接的波浪线代表键延长)。下列叙述错误的是
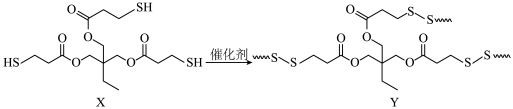
| A.X中的含氧官能团是酯基 | B.X的水解产物之一是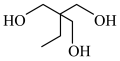 |
| C.Y是线型结构高分子材料,具有热塑性 | D.Y在碱性介质中能降解 |
您最近一年使用:0次
2024-04-01更新
|
680次组卷
|
5卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
2024届河南省焦作市博爱县第一中学高三下学期三模化学试题贵州省黔东南州2024届高三下学期模拟统测(二模)化学试题(已下线)通关练05 有机物的结构与性质-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河北省重点高中2023-2024学年高三下学期第三次模拟化学试题2024届湖北省武昌实验中学高三下学期高考适应性考试化学试卷
名校
9 . 中国科学院化学所研究人员开发一种锂离子电池水性粘结剂(APA),如图所示。
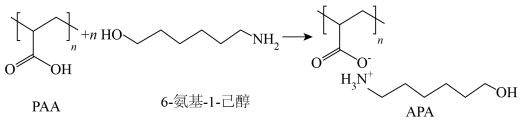
| A.丙烯酸发生加聚反应合成PAA | B.PAA、APA都具有吸湿性 |
| C.PAA的熔点低于APA | D.3-氨基-1-己醇是6-氨基-1-己醇的同系物 |
您最近一年使用:0次
2024-04-01更新
|
159次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
10 . 硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热、遇酸均易分解。下图为实验室制取硫代硫酸钠的装置:
I. 制备:
制备:
装置A制备的 经过三通阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过三通阀通入装置C中的混合溶液,加热、搅拌,至溶液 约为
约为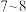 时,停止通入
时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。
Ⅱ.产品分离提纯:
产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到 产品。
产品。
回答下列问题:
(1)装置A中装 的仪器名称为
的仪器名称为___________ 。装置B中的药品可以选择下列物质中的___________ (填字母)。
A.饱和食盐水 B. 溶液 C.饱和
溶液 C.饱和 溶液 D.酸性
溶液 D.酸性 溶液
溶液
(2)为了保证硫代硫酸钠的产量,实验中通入的 不能过量。若
不能过量。若 过量使溶液
过量使溶液 ,产率会降低,请用离子方程式解释原因:
,产率会降低,请用离子方程式解释原因:___________ ;理论上 和
和 的最佳物质的量之比应为
的最佳物质的量之比应为___________ 。
(3)当数据采集处 接近
接近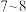 时,三通阀(如图1)的孔路位置应调节为
时,三通阀(如图1)的孔路位置应调节为___________ (填字母)。 的结构如图2所示(可视为一个S原子取代了
的结构如图2所示(可视为一个S原子取代了 中的一个O原子。);
中的一个O原子。);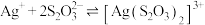 ,常温下,
,常温下,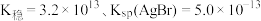 ,
, 溶液溶解
溶液溶解 生成
生成 的离子方程式:
的离子方程式:___________ ,常温下,该反应的化学平衡常数为___________ 。在配合物离子 中,
中,___________ (填字母)不可能作配位原子。
a. 中的中心S原子 b.
中的中心S原子 b. 中的端基S原子
中的端基S原子
(5)向 浸取液中通入空气使
浸取液中通入空气使 转化为稳定性高的
转化为稳定性高的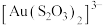 ,同时加入一定量的
,同时加入一定量的 后可加快金的溶解,一种浸金机理如图3所示。则负极区电极反应为
后可加快金的溶解,一种浸金机理如图3所示。则负极区电极反应为___________ 。

I.
 制备:
制备:装置A制备的
 经过三通阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过三通阀通入装置C中的混合溶液,加热、搅拌,至溶液 约为
约为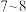 时,停止通入
时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。Ⅱ.产品分离提纯:
产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到
 产品。
产品。回答下列问题:
(1)装置A中装
 的仪器名称为
的仪器名称为A.饱和食盐水 B.
 溶液 C.饱和
溶液 C.饱和 溶液 D.酸性
溶液 D.酸性 溶液
溶液(2)为了保证硫代硫酸钠的产量,实验中通入的
 不能过量。若
不能过量。若 过量使溶液
过量使溶液 ,产率会降低,请用离子方程式解释原因:
,产率会降低,请用离子方程式解释原因: 和
和 的最佳物质的量之比应为
的最佳物质的量之比应为(3)当数据采集处
 接近
接近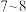 时,三通阀(如图1)的孔路位置应调节为
时,三通阀(如图1)的孔路位置应调节为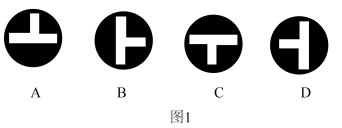
 的结构如图2所示(可视为一个S原子取代了
的结构如图2所示(可视为一个S原子取代了 中的一个O原子。);
中的一个O原子。);
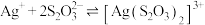 ,常温下,
,常温下,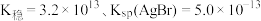 ,
, 溶液溶解
溶液溶解 生成
生成 的离子方程式:
的离子方程式: 中,
中,a.
 中的中心S原子 b.
中的中心S原子 b. 中的端基S原子
中的端基S原子(5)向
 浸取液中通入空气使
浸取液中通入空气使 转化为稳定性高的
转化为稳定性高的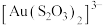 ,同时加入一定量的
,同时加入一定量的 后可加快金的溶解,一种浸金机理如图3所示。则负极区电极反应为
后可加快金的溶解,一种浸金机理如图3所示。则负极区电极反应为
您最近一年使用:0次
2024-04-01更新
|
307次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题



