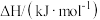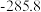1 . 中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料: ,并获得该化合物的LED器件,为白光的应用提供新材料支持。
,并获得该化合物的LED器件,为白光的应用提供新材料支持。
(1)已知 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有__________ 种,基态O原子的电子排布式不能表示为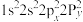 ,因为这违背了
,因为这违背了__________ (填选项)。
A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2) 、P与S是同周期中相邻的元素,
、P与S是同周期中相邻的元素, 、P、S的电负性由大到小的顺序是
、P、S的电负性由大到小的顺序是__________ ,第一电离能由大到小的顺序是__________ .
(3)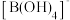 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为__________ 。 中,
中, 与0之间不存在的化学键是
与0之间不存在的化学键是__________ (填选项)。
A. 键 B.
键 B. 键 C.配位键 D.极性键
键 C.配位键 D.极性键
(4)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是__________ ,其原因是_______________ 。
(5)超高热导率半导体材料砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的原子坐标为__________ 。已知阿伏加德罗常数的值为 ,若晶胞中
,若晶胞中 原子到B原子最近距离为
原子到B原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为__________ (列出含a、 的计算式即可)。
的计算式即可)。
 ,并获得该化合物的LED器件,为白光的应用提供新材料支持。
,并获得该化合物的LED器件,为白光的应用提供新材料支持。(1)已知
 与
与 同族,基态
同族,基态 原子价层电子的运动状态有
原子价层电子的运动状态有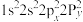 ,因为这违背了
,因为这违背了A.能量最低原理 B.泡利不相容原理 C.洪特规则
(2)
 、P与S是同周期中相邻的元素,
、P与S是同周期中相邻的元素, 、P、S的电负性由大到小的顺序是
、P、S的电负性由大到小的顺序是(3)
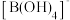 中硼原子的杂化轨道类型为
中硼原子的杂化轨道类型为 中,
中, 与0之间不存在的化学键是
与0之间不存在的化学键是A.
 键 B.
键 B. 键 C.配位键 D.极性键
键 C.配位键 D.极性键(4)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是
(5)超高热导率半导体材料砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的原子坐标为
 ,若晶胞中
,若晶胞中 原子到B原子最近距离为
原子到B原子最近距离为 ,则该晶体的密度为
,则该晶体的密度为 的计算式即可)。
的计算式即可)。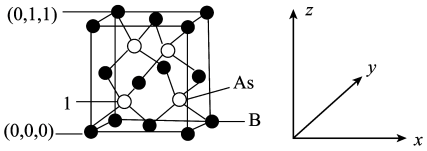
您最近一年使用:0次
2 .  和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为: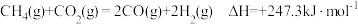 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热( 、
、 ):
):
则 燃烧热
燃烧热
__________  。
。
(2)其它条件相同,在不同催化剂(A、B)作用下,反应 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。__________ ,在催化剂A、B作用下,它们反应活化能分别用 、
、 表示,则
表示,则
________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②速率大小比较:y点对应的
__________ z点对应的 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)将原料 和
和 按等物质的量充入密闭容器中,保持体系压强为
按等物质的量充入密闭容器中,保持体系压强为 发生反应:
发生反应: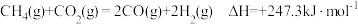 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。 的体积分数,则
的体积分数,则__________ 点对应的平衡常数最小,理由是_______________ 。
②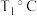 、
、 下,达平衡时
下,达平衡时 转化率=
转化率=__________ ;该温度下,此反应的平衡常数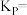
________ 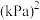 (以分压表示,分压=总压强×气体成分的物质的量分数)。
(以分压表示,分压=总压强×气体成分的物质的量分数)。
 和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为: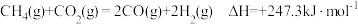 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热(
 、
、 ):
):物质 |
|
|
|
燃烧热 | ? |
|
|
 燃烧热
燃烧热
 。
。(2)其它条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。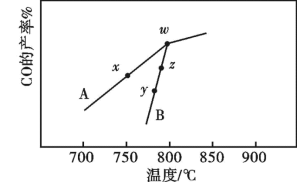
 、
、 表示,则
表示,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②速率大小比较:y点对应的

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)将原料
 和
和 按等物质的量充入密闭容器中,保持体系压强为
按等物质的量充入密闭容器中,保持体系压强为 发生反应:
发生反应: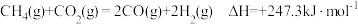 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
 的体积分数,则
的体积分数,则②
 、
、 下,达平衡时
下,达平衡时 转化率=
转化率=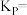
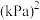 (以分压表示,分压=总压强×气体成分的物质的量分数)。
(以分压表示,分压=总压强×气体成分的物质的量分数)。
您最近一年使用:0次
3 . 常温下,向 的某二元酸(
的某二元酸( )溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与
)溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与 或
或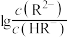 的变化关系如图所示。下列叙述错误的是
的变化关系如图所示。下列叙述错误的是
 的某二元酸(
的某二元酸( )溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与
)溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与 或
或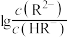 的变化关系如图所示。下列叙述错误的是
的变化关系如图所示。下列叙述错误的是
A.a表示 与pH的关系 与pH的关系 |
B.pH=7时,存在 |
C.常温下,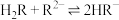 的平衡常数 的平衡常数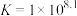 |
| D.加入等体积的NaOH溶液时,溶液显酸性 |
您最近一年使用:0次
4 . Fe(OH)2具有较强的还原性,新制的白色Fe(OH)2会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色Fe(OH)2,某实验小组做了如下探究实验。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、___________ 、___________ 。
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是___________ 。
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:___________ 。___________ (用离子方程式表示)。
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:___________ 。
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
①由以上实验可得到的规律是___________ 。
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为___________ (填“1.0”“1.5”或“2.0”)mol/L。
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为___________ (任写一条)。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:

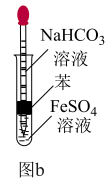
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
c(NaHCO3)/(mol/L) c(FeSO4)/(mol/L) | 1.0 | 1.5 | 2.0 | |
| 1.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 3.5 min | 9 min | 24 min | |
| 1.5 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 13 min | 15 min | 22 min | |
| 2.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率加快 | 常温下无现象,加热后产生白色沉淀 |
| 稳定时间 | 3 min | 8 min | 30 min | |
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为
您最近一年使用:0次
2024-04-16更新
|
335次组卷
|
2卷引用:2024届青海省百所名校高三下学期二模理科综合试题-高中化学
名校
解题方法
5 . 已知蓝色环保颜料 由原子序数依次增大的W、X、Y、Z、R五种短周期主族元素组成,W、R位于同一主族,W元素原子的核外电子数是其周期序数的4倍;X、Y、Z、R位于同一周期,其原子序数之和为54,且只有Y、Z相邻;X的单质可与冷水剧烈反应,下列有关说法正确的是
由原子序数依次增大的W、X、Y、Z、R五种短周期主族元素组成,W、R位于同一主族,W元素原子的核外电子数是其周期序数的4倍;X、Y、Z、R位于同一周期,其原子序数之和为54,且只有Y、Z相邻;X的单质可与冷水剧烈反应,下列有关说法正确的是
 由原子序数依次增大的W、X、Y、Z、R五种短周期主族元素组成,W、R位于同一主族,W元素原子的核外电子数是其周期序数的4倍;X、Y、Z、R位于同一周期,其原子序数之和为54,且只有Y、Z相邻;X的单质可与冷水剧烈反应,下列有关说法正确的是
由原子序数依次增大的W、X、Y、Z、R五种短周期主族元素组成,W、R位于同一主族,W元素原子的核外电子数是其周期序数的4倍;X、Y、Z、R位于同一周期,其原子序数之和为54,且只有Y、Z相邻;X的单质可与冷水剧烈反应,下列有关说法正确的是A.简单离子半径: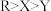 | B.最简单氢化物的稳定性: |
| C.Y的最高价氧化物对应的水化物为强酸 | D.W、Z形成的二元化合物为离子化合物 |
您最近一年使用:0次
2024-04-15更新
|
246次组卷
|
5卷引用:2024届青海省百所名校高三下学期二模理科综合试题-高中化学
6 . 下列所示实验或操作能达到实验目的的是
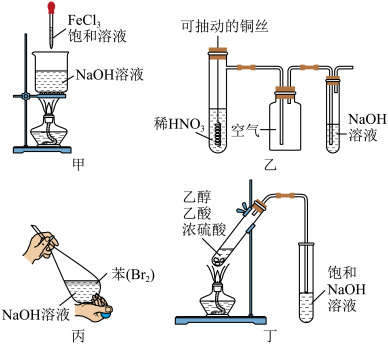
A.甲为制取 胶体 胶体 | B.乙为 的制备、收集和尾气处理 的制备、收集和尾气处理 |
| C.丙为除去苯中溶解的溴实验操作之一 | D.丁为实验室制取乙酸乙酯 |
您最近一年使用:0次
7 . 草酸钴在化学中应用广泛,可以用于制取催化剂和指示剂。工业上常以水钴矿(主要成分为 ,还含少量
,还含少量 、
、 、MgO、CaO等杂质)为原料制备钴的氧化物,其制备工艺流程如下:
、MgO、CaO等杂质)为原料制备钴的氧化物,其制备工艺流程如下:
(1)向浸液中加入 后钴元素的化合价为
后钴元素的化合价为___________ 。
(2)向溶液a中加入NaClO的主要作用是___________ ;可选用___________ (填字母)替代NaClO,若使用替代试剂,则相应反应的离子方程式为___________ 。
A.HCl B. C.
C. D.
D.
(3)向溶液c中加入足量的NaF溶液可将 、
、 转化为沉淀而除去,若所得溶液d中
转化为沉淀而除去,若所得溶液d中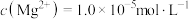 ,则溶液d中
,则溶液d中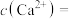
___________  。[已知该温度下:
。[已知该温度下: ,
,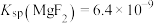 ]
]
(4)钴的氧化物常用作颜料或催化剂,其可由草酸钴晶体( )在空气中煅烧制得。取36.6g草酸钴晶体,在空气中煅烧至恒重,得到15.8gCoO与
)在空气中煅烧制得。取36.6g草酸钴晶体,在空气中煅烧至恒重,得到15.8gCoO与 的混合物,该混合物中CoO与
的混合物,该混合物中CoO与 的物质的量之比为
的物质的量之比为___________ ,写出该反应的化学方程式:___________ 。
 ,还含少量
,还含少量 、
、 、MgO、CaO等杂质)为原料制备钴的氧化物,其制备工艺流程如下:
、MgO、CaO等杂质)为原料制备钴的氧化物,其制备工艺流程如下:
(1)向浸液中加入
 后钴元素的化合价为
后钴元素的化合价为(2)向溶液a中加入NaClO的主要作用是
A.HCl B.
 C.
C. D.
D.
(3)向溶液c中加入足量的NaF溶液可将
 、
、 转化为沉淀而除去,若所得溶液d中
转化为沉淀而除去,若所得溶液d中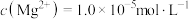 ,则溶液d中
,则溶液d中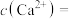
 。[已知该温度下:
。[已知该温度下: ,
,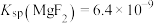 ]
](4)钴的氧化物常用作颜料或催化剂,其可由草酸钴晶体(
 )在空气中煅烧制得。取36.6g草酸钴晶体,在空气中煅烧至恒重,得到15.8gCoO与
)在空气中煅烧制得。取36.6g草酸钴晶体,在空气中煅烧至恒重,得到15.8gCoO与 的混合物,该混合物中CoO与
的混合物,该混合物中CoO与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
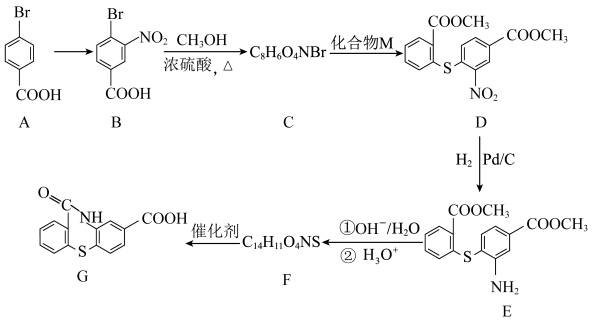
8 . 一种合成有机物G的合成路线如下:
(1)由A→B反应的试剂和条件是_____________ 。
(2)B→C反应的反应类型为__________ ,C中含氧官能团的名称为__________ 。
(3)M的化学式为C8H8O2S,则M的结构简式为__________ 。
(4)写出反应E→F的化学方程式:______________ 。
(5)化合物K是A的同系物,相对分子质量比A的多14。K的同分异构体中,同时满足下列条件,且核磁共振氢谱有5组峰,峰面积之比为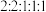 的结构简式为
的结构简式为______________ (不考虑立体异构)。
a.能与FeCl3溶液发生显色反应;b.能发生银镜反应;c.苯环上有2个取代基。
(6)以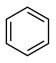 和
和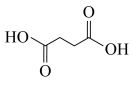 为原料,结合上述合成线路中的相关信息,设计合成
为原料,结合上述合成线路中的相关信息,设计合成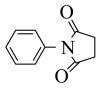 的路线
的路线__________ (用流程图表示,无机试剂任选)。
(1)由A→B反应的试剂和条件是
(2)B→C反应的反应类型为
(3)M的化学式为C8H8O2S,则M的结构简式为
(4)写出反应E→F的化学方程式:
(5)化合物K是A的同系物,相对分子质量比A的多14。K的同分异构体中,同时满足下列条件,且核磁共振氢谱有5组峰,峰面积之比为
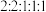 的结构简式为
的结构简式为a.能与FeCl3溶液发生显色反应;b.能发生银镜反应;c.苯环上有2个取代基。
(6)以
 和
和 为原料,结合上述合成线路中的相关信息,设计合成
为原料,结合上述合成线路中的相关信息,设计合成 的路线
的路线
您最近一年使用:0次
2024-04-11更新
|
633次组卷
|
8卷引用:2024届青海省部分学校高三下学期模拟考试理综试题-高中化学
名校
解题方法
9 . 科技强国,我国科学家在诸多领域取得新突破。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂 、
、 及清洗剂
及清洗剂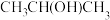 。
。
①基态F原子核外电子有_____ 种空间运动状态,下列为氟原子激发态的电子排布式的是_____ (填标号)。
A. B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为__________ 。
③氟硼酸铵( )中B的杂化方式为
)中B的杂化方式为__________ , 的空间构型为
的空间构型为__________ 。
(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是__________ (填元素符号),Mn原子的配位数为__________ ,CH3CN中 键与
键与 键数目之比为
键数目之比为__________ 。
(3)超导材料 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为__________ (列出计算式即可) 。
。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂
 、
、 及清洗剂
及清洗剂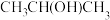 。
。①基态F原子核外电子有
A.
 B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为
③氟硼酸铵(
 )中B的杂化方式为
)中B的杂化方式为 的空间构型为
的空间构型为(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是
 键与
键与 键数目之比为
键数目之比为(3)超导材料
 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为 。
。
您最近一年使用:0次
2024-04-11更新
|
325次组卷
|
6卷引用:2024届青海省部分学校高三下学期模拟考试理综试题-高中化学
2024届青海省部分学校高三下学期模拟考试理综试题-高中化学2024届内蒙古锡林郭勒盟高三第三次模拟考试理综试卷-高中化学(已下线)化学(上海卷03)-2024年高考押题预测卷2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学(已下线)T16-结构与性质四川省雅安市2023-2024学年高三下学期4月月考理综试题-高中化学
10 . 肼是一种火箭燃料。某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。相关物质的性质如下:
I.实验室制备N2H4_____________ 。
(2)仪器a的作用是____________ 。
(3)实验室用下列装置制备并收集干净的Cl2,装置的连接顺序是E→__________ →F(用字母表示)。___________ 。
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(5)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知: )。
)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液体积的平均值为20.00mL,产品中水合肼的质量分数为__________ 。
Ⅲ.探究肼的化学性质
(6)取三颈烧瓶中溶液,加入适量稀硫酸,振荡,置于冰水浴中冷却,容器底部有无色晶体析出。过滤后用__________ 洗涤,检验洗涤是否完成的操作为____________ 。
物质 | 性状 | 熔点/℃ | 沸点/℃ | 性质 |
N2H4 | 无色液体 | 1.4 | 113 | 与水混溶,有强还原性 |
N2H6SO4 | 无色晶体 | 254 | - | 不溶于75%的乙醇溶液 |
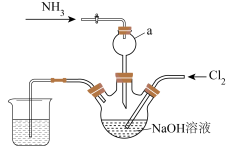
(2)仪器a的作用是
(3)实验室用下列装置制备并收集干净的Cl2,装置的连接顺序是E→
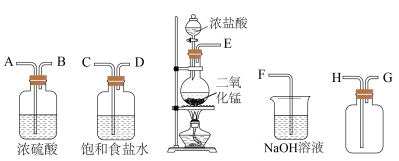
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(5)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:
 )。
)。①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液体积的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质
(6)取三颈烧瓶中溶液,加入适量稀硫酸,振荡,置于冰水浴中冷却,容器底部有无色晶体析出。过滤后用
您最近一年使用:0次
2024-04-11更新
|
165次组卷
|
4卷引用:青海省海南州贵德高级中学2023-2024学年高三下学期第九次模拟预测理综试题-高中化学