名校
解题方法
1 . 在标准状况下,将aLNH3完全溶于1L水得到VmL氨水,溶液的密度为ρg∙cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
①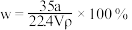 ②
②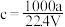 ③
③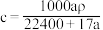 ④
④ ⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
①
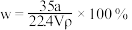 ②
②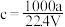 ③
③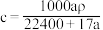 ④
④ ⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω| A.①②④ | B.②③④ | C.②④ | D.②③⑤ |
您最近一年使用:0次
2016-12-09更新
|
796次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
名校
解题方法
2 . 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是
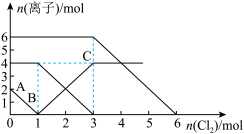

| A.离子的还原性顺序为:Fe2+>Br->I- |
| B.原混合溶液中FeBr2的物质的量为4mol |
| C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
| D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
您最近一年使用:0次
2016-12-09更新
|
1851次组卷
|
7卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
名校
3 . 已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为______ ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为___________________________________ 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是__________ 。若用惰性电极电解MgCl2溶液,其阴极反应式为____________________ 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为________________________ 。常温下,若起始电解质溶液pH=1,则pH=2时,溶液中Mg2+浓度为______ 。当溶液pH=6时,______ (填“有”或“没有”)Mg(OH)2沉淀析出(已知Ksp[Mg(OH)2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为____ (提示:I2+2S2O===2I-+S4O)(结果保留一位小数)。

回答下列有关问题:
(1)硼砂中B的化合价为
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为
您最近一年使用:0次
2016-12-09更新
|
639次组卷
|
2卷引用:2016届河南省三门峡市陕州中学高三上学期第二次精英对抗赛化学试卷
4 . 威斯迈尔反应是在富电子芳环上引入甲酰基的有效方法。其过程首先是N,N-二甲基甲酰胺与POCl3反应生成威斯迈尔试剂:
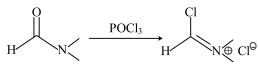
接着威斯迈尔试剂与富电子芳环反应,经水解后在芳环上引入甲酰基。例如:

(1)用共振式表示威斯迈尔试剂正离子。
___________________________________
(2)由甲氧基苯转化为对甲氧基苯甲醛的过程中,需经历以下步骤:⑴芳香亲电取代 ⑵分子内亲核取代 ⑶亲核加成 ⑷质子转移 ⑸消除。画出所有中间体的结构简式。

_________________________ ;__________________________ ;___________________________ ;_________________________________ ;
(3)完成下列反应:
________________________ ;__________________________ ;

接着威斯迈尔试剂与富电子芳环反应,经水解后在芳环上引入甲酰基。例如:

(1)用共振式表示威斯迈尔试剂正离子。
(2)由甲氧基苯转化为对甲氧基苯甲醛的过程中,需经历以下步骤:⑴芳香亲电取代 ⑵分子内亲核取代 ⑶亲核加成 ⑷质子转移 ⑸消除。画出所有中间体的结构简式。

(3)完成下列反应:

您最近一年使用:0次
2011高三·全国·竞赛
解题方法
5 . 1965年合成了催化剂A,实现了温和条件下的烯烃加氢。
(1)A是紫红色晶体,分子量925.23,抗磁性。它通过RhCl3·3H2O和过量三苯膦(PPh3)的乙醇溶液回流制得。画出A的立体结构_________ 。
(2)A可能的催化机理如下图所示(图中16e表示中心原子周围总共有16个电子):

画出D的结构式_______ 。
(3)确定图中所有配合物的中心原子的氧化态_________ 。
(4)确定A、C、D和E的中心离子的杂化轨道类型___________ 。
(5)用配合物的价键理论推测C和E显顺磁性还是抗磁性,说明理由__________ 。
(1)A是紫红色晶体,分子量925.23,抗磁性。它通过RhCl3·3H2O和过量三苯膦(PPh3)的乙醇溶液回流制得。画出A的立体结构
(2)A可能的催化机理如下图所示(图中16e表示中心原子周围总共有16个电子):

画出D的结构式
(3)确定图中所有配合物的中心原子的氧化态
(4)确定A、C、D和E的中心离子的杂化轨道类型
(5)用配合物的价键理论推测C和E显顺磁性还是抗磁性,说明理由
您最近一年使用:0次
2011高三·全国·竞赛
6 .
(1)画出2,4-戊二酮的钠盐与Mn3+形成的电中性配合物的结构式(配体用 表示)
表示)___________________ 。
(2)已知该配合物的磁矩为4.9玻尔磁子,配合物中Mn的未成对电子数为_____ 。
(3)回答:该化合物有无手性____________ (填“有”或“无”),原因是________________ 。
(4)画出2,4戊二酮负离子的结构简式(必须明确其共轭部分)________________ ,写出其中离域π键的表示符号______________________ 。
(5)橙黄色固体配合物A的名称是三氯化六氨合钴(Ⅲ),是将二氯化钴、浓氨水、氯化铵和过氧化氢混合,以活性炭为催化剂合成的。机理研究发现,反应过程中首先得到Co(NH3)62+离子,随后发生配体取代反应,得到以新配体为桥键的双核离子B4+,接着发生桥键断裂,同时2个中心原子分别将1个电子传递到均裂后的新配体上,得到2个C2+离子,最后C2+离子在活性炭表面上发生配体取代反应,并与氯离子结合形成固体配合物A。写出合成配合物A的总反应方程式;画出B4+和C2+离子的结构式。
总反应方程式_________________________________
B4+和C2+离子的结构式_______________________ -
(1)画出2,4-戊二酮的钠盐与Mn3+形成的电中性配合物的结构式(配体用
 表示)
表示)(2)已知该配合物的磁矩为4.9玻尔磁子,配合物中Mn的未成对电子数为
(3)回答:该化合物有无手性
(4)画出2,4戊二酮负离子的结构简式(必须明确其共轭部分)
(5)橙黄色固体配合物A的名称是三氯化六氨合钴(Ⅲ),是将二氯化钴、浓氨水、氯化铵和过氧化氢混合,以活性炭为催化剂合成的。机理研究发现,反应过程中首先得到Co(NH3)62+离子,随后发生配体取代反应,得到以新配体为桥键的双核离子B4+,接着发生桥键断裂,同时2个中心原子分别将1个电子传递到均裂后的新配体上,得到2个C2+离子,最后C2+离子在活性炭表面上发生配体取代反应,并与氯离子结合形成固体配合物A。写出合成配合物A的总反应方程式;画出B4+和C2+离子的结构式。
总反应方程式
B4+和C2+离子的结构式
您最近一年使用:0次
2011高三·全国·竞赛
7 . NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度由298K升至311K。已知这两个温度下N2O4(g) 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了_______ 倍。
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?____________ 为什么?_______________
 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?
您最近一年使用:0次



