名校
解题方法
1 . 对下列家务劳动所涉及原理的解释不正确的是
| 选项 | 家务劳动 | 化学知识 |
| A | 餐后将铁锅洗净后擦干 | Fe在潮湿的空气中易生锈 |
| B | 使用白醋除去水壶中的水垢 | 白醋可与CaCO3、Mg(OH)2反应 |
| C | 使用“84”消毒液(主要成分为NaClO、NaCl)进行环境消毒 | NaCl具有强氧化性 |
| D | 用温热的纯碱溶液清洗油污 | 油脂在碱性条件下可发生水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-29更新
|
308次组卷
|
3卷引用:2023年江苏省扬州市普通高中学业水平合格性模拟试卷(二)化学试题
解题方法
2 . 下表是元素周期表的一部分,针对编号①-⑫元素,回答下列有关问题:
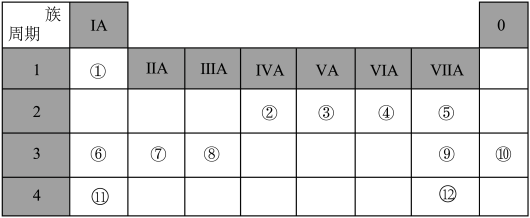
(1)在这些元素中,非金属性最强的元素是_____ (填元素符号,下同),最不活泼的元素是_____ 。
(2)写出元素③对应气态氢化物的电子式:_____ 。
(3)在元素⑥和⑪中,单质与水反应较剧烈的是_____ (填元素符号),它与水反应的化学方程式是_____ 。这是因为同主族元素,随原子序数逐渐增大,原子的电子层数逐渐增大,原子半径逐渐_____ ,元素的金属性逐渐_____ 。
(4)在元素⑥、⑦与⑧的最高价氧化物对应的水化物中,碱性由强到弱的顺序是_____ (填化学式)。
(5)能证明⑨和⑫单质氧化性强弱的实验事实(用离子方程式表示)是_____ 。
(6)①、②、④三种元素形成的有机物的分子结构模型如图所示,写出该有机物的结构简式:_____ ;
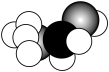
①与②所形成的最简单的烯烃与溴的四氯化碳溶液反应的化学方程式:_____ 。

(1)在这些元素中,非金属性最强的元素是
(2)写出元素③对应气态氢化物的电子式:
(3)在元素⑥和⑪中,单质与水反应较剧烈的是
(4)在元素⑥、⑦与⑧的最高价氧化物对应的水化物中,碱性由强到弱的顺序是
(5)能证明⑨和⑫单质氧化性强弱的实验事实(用离子方程式表示)是
(6)①、②、④三种元素形成的有机物的分子结构模型如图所示,写出该有机物的结构简式:

①与②所形成的最简单的烯烃与溴的四氯化碳溶液反应的化学方程式:
您最近一年使用:0次
名校
3 . 海水晒盐得到NaCl与卤水。氯碱工业电解饱和NaCl溶液得到Cl2和NaOH,Cl2与NaOH溶液反应可制取漂白剂;以NaCl、NH3、CO2等为原料可得到NaHCO3,NaHCO3可用于治疗胃酸过多。利用Cl2的氧化性可提取卤水中的溴元素,Br和Cl都位于元素周期表VIIA族,Br位于Cl的下一周期;从卤水中也可提取镁。下列说法正确的是
| A.原子半径:r(Cl) > r(Br) | B.非金属性:N > O |
| C.碱性:NaOH > Mg(OH)2 | D.热稳定性:HBr > HCl |
您最近一年使用:0次
解题方法
4 . 化学创造美好生活。下列各项劳动项目与化学原理不相对应 的是
| 选项 | 劳动项目 | 化学原理 |
| A | 用洁厕剂(含盐酸)清洗卫生间 | 盐酸与碱性物质反应 |
| B | 用84消毒液消毒教室桌椅 | 84消毒液具有强氧化性而杀菌消毒 |
| C | 公园的钢铁护栏涂刷多彩防护漆 | 防护漆隔绝潮湿空气以防止钢铁锈蚀 |
| D | 以油脂为原料自制肥皂 | 油脂能溶解油污 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 消除氮氧化物的3种方法:
①4NO2+O2+4Na2CO3+2H2O=4NaHCO3+4NaNO3
②6NO+4NH3 5N2+6H2O
5N2+6H2O
③2NO+2CO 2CO2+N2
2CO2+N2
下列说法不正确 的是
①4NO2+O2+4Na2CO3+2H2O=4NaHCO3+4NaNO3
②6NO+4NH3
 5N2+6H2O
5N2+6H2O③2NO+2CO
 2CO2+N2
2CO2+N2下列说法
| A.氮氧化物会造成酸雨等污染 |
| B.①是利用Na2CO3的碱性和氧化性消除NO2 |
| C.②③的目的是将化合态的氮元素转化为N2 |
| D.②③使用催化剂,能加快消除氮氧化物的速率 |
您最近一年使用:0次
2022-12-07更新
|
479次组卷
|
2卷引用:2022年7月浙江省普通高中学业水平考试化学试题
解题方法
6 . 下列有关物质性质的比较中,正确的是
| A.还原性:Al>Na | B.碱性:KOH>NaOH |
C.酸性: | D.稳定性:HI>HCl |
您最近一年使用:0次
7 . 下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
(1)得电子能力最强的原子是___________ ;
(2)化学性质最不活泼的单质是___________ ﹔
(3)F与Cl相比,原子半径较大的是___________ ;
(4) 与
与 相比,热稳定性较强的是
相比,热稳定性较强的是___________ ﹔
(5)原子最外层电子数与最内层电子数相等的元素是___________ ﹔
(6)某阴离子的结构示意图为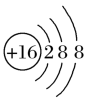 ,其离子符号是
,其离子符号是___________ ;
(7) 与
与 中,能与
中,能与 溶液反应的是
溶液反应的是___________ ﹔
(8)第三周期元素中能与冷水剧烈反应的金属单质是___________ ,写出该反应的化学方程式:___________ ;
(9)碳的一种氢化物结构式为 ,其分子式是
,其分子式是___________ ,其中碳元素与氢元素的质量比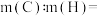
___________ ;(相对原子质量:C-12,H-1)
(10)下列各项性质的比较,符合相关性质递变规律的是___________(填标号 )。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Mg | Al | S | Cl |
(1)得电子能力最强的原子是
(2)化学性质最不活泼的单质是
(3)F与Cl相比,原子半径较大的是
(4)
 与
与 相比,热稳定性较强的是
相比,热稳定性较强的是(5)原子最外层电子数与最内层电子数相等的元素是
(6)某阴离子的结构示意图为
 ,其离子符号是
,其离子符号是(7)
 与
与 中,能与
中,能与 溶液反应的是
溶液反应的是(8)第三周期元素中能与冷水剧烈反应的金属单质是
(9)碳的一种氢化物结构式为
 ,其分子式是
,其分子式是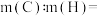
(10)下列各项性质的比较,符合相关性质递变规律的是___________(填
A.还原性: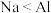 | B.非金属性: |
C.酸性: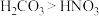 | D.碱性: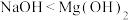 |
您最近一年使用:0次
名校
解题方法
8 . 某化学兴趣小组设计如图实验装置(夹持装置已省略),探究 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是__________ 。
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。
①装置A中制备 的离子方程式为
的离子方程式为__________ 。
②证明 的氧化性大于
的氧化性大于 的现象是
的现象是__________ 。
③装置C的作用是__________ ,装置D中所盛试剂为__________ (填化学式)溶液。
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。
① 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
②实验完成后,打开弹簧夹,持续通入 的目的是
的目的是__________ 。
(4)淀粉 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(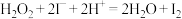 ,
, )。
)。
①滴定终点现象是__________ 。
②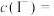
__________  。
。
 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞
 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。①装置A中制备
 的离子方程式为
的离子方程式为②证明
 的氧化性大于
的氧化性大于 的现象是
的现象是③装置C的作用是
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞
 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。①
 发生反应的化学方程式为
发生反应的化学方程式为②实验完成后,打开弹簧夹,持续通入
 的目的是
的目的是(4)淀粉
 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(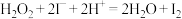 ,
, )。
)。①滴定终点现象是
②
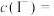
 。
。
您最近一年使用:0次
2024-04-10更新
|
199次组卷
|
3卷引用:河北省2024届普通高中高三学业水平选择性考试仿真模拟化学卷(三)
名校
解题方法
9 . 下表为元素周期表的一部分,表中列出了10种元素,针对这些元素完成下列问题
(1)非金属性最强的元素是_______ (填元素名称);
(2)NaOH与Mg(OH)2中,碱性较强的是_______ ;
(3)第三周期这五种元素中,元素原子半径最大的是_______ (填元素符号);
(4)Ne原子的最外层电子数为_______ ;
(5)写出一种含有氮元素的化肥_______ (填化学式);
(6)有一种元素形成化合物种类最多,该元素最高价氧化物是_______ (填化学式);
(7)铝是一种重要的金属材料,其主要用于_______ (填一种用途);
(8)硫具有广泛的用途,主要用于制造硫酸等。写出硫在氧气中燃烧生成二氧化硫的化学方程式:_______ 。
(9)溴被称为“海洋元素”,从海水中提取溴,通常是将氯气通入含 的苦卤中置换出单质溴,则Cl2与Br2中氧化性较强的是Cl2,反应物中Cl2与
的苦卤中置换出单质溴,则Cl2与Br2中氧化性较强的是Cl2,反应物中Cl2与 物质的量比是
物质的量比是_______ (“1∶1”或“1∶2”)。
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | S | Cl | |||
| 4 | Br |
(2)NaOH与Mg(OH)2中,碱性较强的是
(3)第三周期这五种元素中,元素原子半径最大的是
(4)Ne原子的最外层电子数为
(5)写出一种含有氮元素的化肥
(6)有一种元素形成化合物种类最多,该元素最高价氧化物是
(7)铝是一种重要的金属材料,其主要用于
(8)硫具有广泛的用途,主要用于制造硫酸等。写出硫在氧气中燃烧生成二氧化硫的化学方程式:
(9)溴被称为“海洋元素”,从海水中提取溴,通常是将氯气通入含
 的苦卤中置换出单质溴,则Cl2与Br2中氧化性较强的是Cl2,反应物中Cl2与
的苦卤中置换出单质溴,则Cl2与Br2中氧化性较强的是Cl2,反应物中Cl2与 物质的量比是
物质的量比是
您最近一年使用:0次
解题方法
10 . 某小组想通过实验探究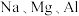 三种金属元素性质的递变规律。
三种金属元素性质的递变规律。
1.下表是元素周期表的一部分,将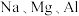 三种元素填入相应位置
三种元素填入相应位置_______ 。
I.探究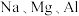 分别与水反应的情况。
分别与水反应的情况。
实验①切一小块绿豆大小的金属 ,用滤纸吸干其表面的煤油,将其投入盛有
,用滤纸吸干其表面的煤油,将其投入盛有 水(含酚酞)的烧杯中。观察到
水(含酚酞)的烧杯中。观察到 与冷水发生剧烈反应,烧杯内溶液变红。
与冷水发生剧烈反应,烧杯内溶液变红。
2. 与
与 反应生成
反应生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。该反应中作还原剂的是_______ 。
A. B.
B. C.
C.
3. 溶液中使酚酞试液变红的微粒是
溶液中使酚酞试液变红的微粒是_______ 。
A. B.
B. C.
C.
实验②分别取一小段镁条和铝条,放入两支试管中,向试管中各加入 水,再滴入2滴酚酞试液,观察到试管中均无明显现象。
水,再滴入2滴酚酞试液,观察到试管中均无明显现象。
有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后 与水反应现象仍不明显。
与水反应现象仍不明显。
4.实验②的设计中未考虑到的因素是_______ 。
5.通过上述实验,得出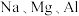 的金属性由强到弱顺序
的金属性由强到弱顺序_______ 。
A. B.
B.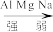
6.除反应物自身性质外,上述实验还验证了化学反应速率与_______ 有关。
Ⅱ.比较 碱性的强弱。
碱性的强弱。
实验④在试管中加入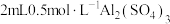 溶液,然后逐滴滴加
溶液,然后逐滴滴加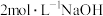 溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
实验⑤在试管中加入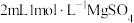 溶液,然后逐滴滴加
溶液,然后逐滴滴加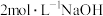 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
7.写出由实验④、⑤的实验现象可推导得出的结论。
8.综上实验可知, 的碱性由强到弱顺序:
的碱性由强到弱顺序:_______ 。
A.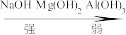 B.
B.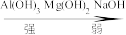
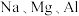 三种金属元素性质的递变规律。
三种金属元素性质的递变规律。1.下表是元素周期表的一部分,将
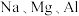 三种元素填入相应位置
三种元素填入相应位置H | |||
C | |||
I.探究
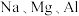 分别与水反应的情况。
分别与水反应的情况。实验①切一小块绿豆大小的金属
 ,用滤纸吸干其表面的煤油,将其投入盛有
,用滤纸吸干其表面的煤油,将其投入盛有 水(含酚酞)的烧杯中。观察到
水(含酚酞)的烧杯中。观察到 与冷水发生剧烈反应,烧杯内溶液变红。
与冷水发生剧烈反应,烧杯内溶液变红。2.
 与
与 反应生成
反应生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式A.
 B.
B. C.
C.
3.
 溶液中使酚酞试液变红的微粒是
溶液中使酚酞试液变红的微粒是A.
 B.
B. C.
C.
实验②分别取一小段镁条和铝条,放入两支试管中,向试管中各加入
 水,再滴入2滴酚酞试液,观察到试管中均无明显现象。
水,再滴入2滴酚酞试液,观察到试管中均无明显现象。有同学提出实验②的设计存在问题,故对实验②作如下调整:
实验③另取镁条和铝条,分别用砂纸打磨去除它们表面的氧化膜后,再进行以上实验操作并加热。观察到:未加热时,反应现象均不明显;加热后镁条表面有气泡生成,溶液变红;加热后
 与水反应现象仍不明显。
与水反应现象仍不明显。4.实验②的设计中未考虑到的因素是
5.通过上述实验,得出
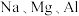 的金属性由强到弱顺序
的金属性由强到弱顺序A.
 B.
B.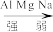
6.除反应物自身性质外,上述实验还验证了化学反应速率与
Ⅱ.比较
 碱性的强弱。
碱性的强弱。实验④在试管中加入
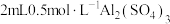 溶液,然后逐滴滴加
溶液,然后逐滴滴加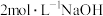 溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。
溶液至过量,边加边振荡。观察到试管中先出现白色沉淀后全部溶解。实验⑤在试管中加入
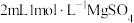 溶液,然后逐滴滴加
溶液,然后逐滴滴加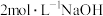 溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。
溶液至过量,边加边振荡。观察到试管中出现白色沉淀且不溶解。7.写出由实验④、⑤的实验现象可推导得出的结论。
实验序号 | 现象 | 结论 |
④ | 出现白色沉淀 |
|
沉淀全部溶解 | ||
⑤ | 出现白色沉淀 | |
沉淀不溶解 |
|
 的碱性由强到弱顺序:
的碱性由强到弱顺序:A.
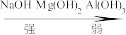 B.
B.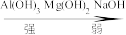
您最近一年使用:0次

 的碱性比
的碱性比 无酸性
无酸性

