解题方法
1 . I 碱法脱硫。用K2CO3溶液吸收H2S。
已知:常温下,氢硫酸和碳酸的电离常数如表。
1.K2CO3溶液中微粒浓度关系正确的是___________。
2.常温下,比较等物质的量浓度的NaHS与NaHCO3溶液的pH___________ 。
A.前者大 B.后者大 C.无法比较
向某FeCl2溶液中加入一定浓度的NaHS溶液,采用分光光度法测得
[Fe2+]=8.88×10-5mol•L-1.(常温下,Ksp(FeS)=6.3×10-18)
3.计算溶液中的 =
=___________ 。
II. 热分解法脱硫。在2 L恒容密闭容器中发生反应2H2S(g) S2(g) + 2H2(g)。
S2(g) + 2H2(g)。
4.985℃时,若加入1mol H2S,经过5s达到平衡,此时H2S的转化率为40%。
则v(S2) =___________ ,该温度下K=___________ (计算结果保留两位有效数字)。
III. Fe2(SO4)3脱硫。
吸收液[Fe2(SO4)3]作用原理如下:
① H2S(g)⇌H2S(aq) ②H2S(aq) ⇌H++HS- ③HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度以及溶液起始pH的关系如图所示。___________ 。原因是___________ 。
6.吸收液过滤出S后,可通入空气再生,写出该反应的离子方程式并标出电子转移方向和数目。___________ 。
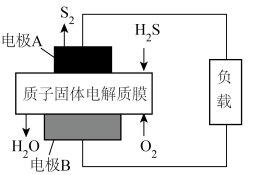
IV. 电化学法脱硫(如图)___________ 经负载流向电极___________ 。(均选填“A”或“B”) A极发生的电极反应式为___________ 。
已知:常温下,氢硫酸和碳酸的电离常数如表。
| 二元酸 | Ka1 | Ka2 |
| H2S | 1.1×10-7 | 7.1×10-15 |
| H2CO3 | 4.5×10-7 | 4.7×10-11 |
1.K2CO3溶液中微粒浓度关系正确的是___________。
A.[K+]= [ ]+ 2[ ]+ 2[ ] +[OH-] ] +[OH-] | B.[K+]= [ ]+[ ]+[ ] +[OH-] ] +[OH-] |
C.[K+]= 2[ ]+ 2[ ]+ 2[ ] +2[H2CO3] ] +2[H2CO3] | D.[K+]= [ ]+ [ ]+ [ ] +[H2CO3] ] +[H2CO3] |
A.前者大 B.后者大 C.无法比较
向某FeCl2溶液中加入一定浓度的NaHS溶液,采用分光光度法测得
[Fe2+]=8.88×10-5mol•L-1.(常温下,Ksp(FeS)=6.3×10-18)
3.计算溶液中的
 =
=II. 热分解法脱硫。在2 L恒容密闭容器中发生反应2H2S(g)
 S2(g) + 2H2(g)。
S2(g) + 2H2(g)。4.985℃时,若加入1mol H2S,经过5s达到平衡,此时H2S的转化率为40%。
则v(S2) =
III. Fe2(SO4)3脱硫。
吸收液[Fe2(SO4)3]作用原理如下:
① H2S(g)⇌H2S(aq) ②H2S(aq) ⇌H++HS- ③HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度以及溶液起始pH的关系如图所示。

6.吸收液过滤出S后,可通入空气再生,写出该反应的离子方程式并标出电子转移方向和数目。
IV. 电化学法脱硫(如图)
您最近一年使用:0次
解题方法
2 . 实验室可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是___________ 。K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的 结构如图所示(K+未画出),则一个晶胞中的K+个数为
结构如图所示(K+未画出),则一个晶胞中的K+个数为___________ 。
 结构如图所示(K+未画出),则一个晶胞中的K+个数为
结构如图所示(K+未画出),则一个晶胞中的K+个数为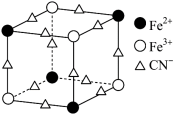
您最近一年使用:0次
解题方法
3 . 化合物Na3CrO8的负离子结构可表示为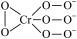 ,则Cr的化合价为
,则Cr的化合价为 呈四面体构型,结构为
呈四面体构型,结构为 , Cr2O
, Cr2O 由两个
由两个 四面体组成,这两个
四面体组成,这两个 四面体通过共用一个顶角氧原子彼此连接,结构为
四面体通过共用一个顶角氧原子彼此连接,结构为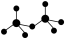 。则由n (n>1)个
。则由n (n>1)个 通过顶角氧原子连结的链式结构的通式为
通过顶角氧原子连结的链式结构的通式为
您最近一年使用:0次
解题方法
4 . 蛋氨酸铜的结构式如图。
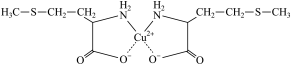
| A.配位键 | B.氢键 | C.离子键 | D.金属键 |
您最近一年使用:0次
解题方法
5 . 锰、铬、铜、铁四种元素的基态原子中,有五个未成对电子的原子核外电子排布式为___________ 。
您最近一年使用:0次
6 . 甘氨酸(分子式C2H5NO2)分子中,共有___________ 个σ键。甘氨酸分子中C原子的杂化方式为___________ 。
A. sp B. sp2 C. sp3
甘氨酸钠中第一电离能最小的元素为___________ 。
A. C B. O C. Na D. N
A. sp B. sp2 C. sp3
甘氨酸钠中第一电离能最小的元素为
A. C B. O C. Na D. N
您最近一年使用:0次
解题方法
7 . 化合物I是一种用于合成缓解肌肉痉挛药物的中间体,其合成路线如下:___________ 。有机物I与L生成M的反应类型为___________ 。有机物H中手性碳原子的个数为___________ 。
A. 0 B. 1 C. 2 D. 3
2.设计步骤A到B的原因是___________ 。
3.过量下列物质的水溶液与有机物D反应生成C7H5O3Na,该物质是___________ 。
A. NaCl B. NaOH C. Na2CO3 D. NaHCO3
试从氢键的角度解释D在冷水中溶解度小而加热时溶解度增大的原因___________ 。
4.乙醛在强碱溶液中加热反应完毕后,对该反应产物叙述正确的是___________。
5.已知K是一种二元醛,请写出K与新制氢氧化铜反应的化学方程式___________ 。
6.写出一种符合下列条件的化合物F的同分异构体___________ 。
①能水解,且能发生银镜反应
②属于芳香族化合物,红外光谱显示含有两种六元环
7.参考上述信息,写出以甲苯和Ph3P=CHCOOC2H5为原料制备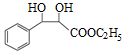
___________ 。
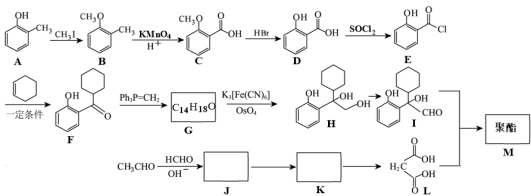
已知:①
②
A. 0 B. 1 C. 2 D. 3
2.设计步骤A到B的原因是
3.过量下列物质的水溶液与有机物D反应生成C7H5O3Na,该物质是
A. NaCl B. NaOH C. Na2CO3 D. NaHCO3
试从氢键的角度解释D在冷水中溶解度小而加热时溶解度增大的原因
4.乙醛在强碱溶液中加热反应完毕后,对该反应产物叙述正确的是___________。
| A.存在顺反结构 | B.能使溴水或酸性KMnO4溶液褪色 |
| C.与乙醛互为同系物 | D.1 mol该物质只能与1 molH2加成 |
6.写出一种符合下列条件的化合物F的同分异构体
①能水解,且能发生银镜反应
②属于芳香族化合物,红外光谱显示含有两种六元环
7.参考上述信息,写出以甲苯和Ph3P=CHCOOC2H5为原料制备

您最近一年使用:0次
8 . 利用滴定法可以测定胆矾中铜的含量,原理如下:
①2Cu2+ + 4I–=2CuI↓+ I2 ②I2 +2 S2O32–=2I–+S4O62–
1.需加入的指示剂为___________ ;需要的物理量除胆矾晶体的质量外,还需要___________ ;判定滴定终点的方法为___________ 。
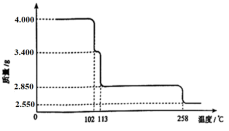
2.将制得的胆矾(CuSO4•5H2O)进行热重分析,其热重曲线(即样品质量随温度变化曲线)如图所示。试确定200℃时固体物质的化学式___________ 。(写出计算过程)
①2Cu2+ + 4I–=2CuI↓+ I2 ②I2 +2 S2O32–=2I–+S4O62–
1.需加入的指示剂为
2.将制得的胆矾(CuSO4•5H2O)进行热重分析,其热重曲线(即样品质量随温度变化曲线)如图所示。试确定200℃时固体物质的化学式
您最近一年使用:0次
解题方法
9 . 实验室模拟工业生产,利用废铜(含少量铁)和硫酸制备胆矾的过程如下:
1.灼烧后的固体用硫酸溶解。配制100 mL 1.50 mol·L-1 硫酸溶液,需用98%的硫酸(密度为1.84 g•cm-3)___________ mL(计算结果保留一位小数)。
2.粗CuSO4溶液中存在的正离子除Cu2+外,还有___________ 。
除杂操作为:在粗CuSO4溶液中滴加 3% H2O2溶液,再慢慢加入CuCO3粉末,调节溶液pH至一定范围,再加热至沸腾并过滤。
3.可用来替代CuCO3粉末的试剂是___________。
4.pH范围应控制在___________ 之间。
A. 1.9~9.0 B. 5.8~6.7 C. 3.2~4.7 D. 5.8~9.0
目的是___________ 。

| 离子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
1.灼烧后的固体用硫酸溶解。配制100 mL 1.50 mol·L-1 硫酸溶液,需用98%的硫酸(密度为1.84 g•cm-3)
2.粗CuSO4溶液中存在的正离子除Cu2+外,还有
除杂操作为:在粗CuSO4溶液中滴加 3% H2O2溶液,再慢慢加入CuCO3粉末,调节溶液pH至一定范围,再加热至沸腾并过滤。
3.可用来替代CuCO3粉末的试剂是___________。
| A.Na2CO3 | B.Cu(OH)2 | C.NaOH | D.CO2 |
A. 1.9~9.0 B. 5.8~6.7 C. 3.2~4.7 D. 5.8~9.0
目的是
您最近一年使用:0次
10 . 芬顿试剂是以H2O2和Fe2+组成的水溶液体系,具有极强的氧化能力,其机理如图所示。
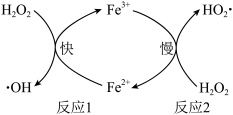
| A.芬顿试剂可以处理含酚废水 |
| B.反应1为决速步骤 |
| C.反应2的活化能比反应1的小 |
| D.反应1的机理为:H2O2 + Fe2+ + H+=Fe3+ + ·OH + H2O |
您最近一年使用:0次



