解题方法
1 . 下列物质在水溶液中的电离方程式书写正确的是
A.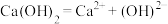 | B.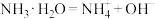 |
C.KAl(SO4)2=K++Al3++2 | D.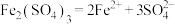 |
您最近一年使用:0次
名校
2 . 如图为元素周期表的一部分,其中X、Y、Z、W为短周期元素,X元素是地壳中含量最多的非金属元素,能形成X2和X3两种单质。下列说法正确的是


| A.X、Z、W元素的原子半径依次增大 |
| B.Y、Z、W元素的最高价氧化物对应水化物的酸性依次减弱 |
| C.X、W、Z元素的气态氢化物的热稳定性依次增大 |
| D.Y和T的单质可用于制造半导体材料 |
您最近一年使用:0次
2024-03-06更新
|
158次组卷
|
2卷引用:重庆市主城区七校2023-2024学年高一上学期期末考试化学试题
名校
3 . 利用传感器和信息处理终端对氯水的光照实验进行数据采集与分析得到以下图象,相关说法正确的是
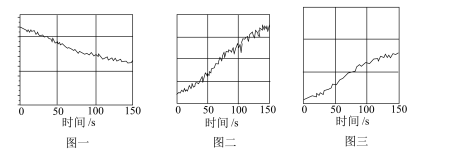

| A.图一可为光照过程中氯水中c(H+)的变化情况 |
| B.图二可为光照过程中氯水中c(HClO)的变化情况 |
| C.图三可为光照过程中氧气在瓶中的体积分数的变化情况 |
| D.根据实验数据推测,氯水长期放置后漂白性和酸性都会逐渐减弱 |
您最近一年使用:0次
2024-03-06更新
|
88次组卷
|
2卷引用:重庆市主城区七校2023-2024学年高一上学期期末考试化学试题
名校
4 . 化学与社会、健康及环境保护息息相关,下列有关物质的使用或者描述不正确的是
| A.食用富含铁元素的食品可以补充人体所需的铁元素 |
| B.服用NaHCO3可治疗胃酸过多 |
| C.Cl2有剧毒,不能用于自来水的消毒、杀菌 |
| D.Fe2O3常作为红色涂料 |
您最近一年使用:0次
2024-03-06更新
|
54次组卷
|
2卷引用:重庆市主城区七校2023-2024学年高一上学期期末考试化学试题
名校
5 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.NA个氧分子与NA个氢分子的质量比为8∶l |
| B.一定量的Na与水反应生成11.2 LH2(标准状况下),转移的电子数为NA |
| C.某温度和压强下16 g CH4气体的体积为24.5 L,含有C-H键的数目大于4NA |
| D.0.1mol·L−1的NaCl溶液中,Na+数目为0.1NA |
您最近一年使用:0次
2024-03-06更新
|
136次组卷
|
2卷引用:重庆市主城区七校2023-2024学年高一上学期期末考试化学试题
名校
解题方法
6 . 下列颜色变化与氧化还原反应无关的是
| A.新切开的钠的光亮的表面很快变暗 |
| B.棕黄色FeCl3饱和溶液滴入沸水中,继续煮沸至液体变为红褐色 |
| C.向紫红色酸性KMnO4溶液中滴入FeCl2溶液后紫红色消失 |
| D.淡黄色Na2O2固体露置于空气中逐渐变为白色 |
您最近一年使用:0次
2024-03-06更新
|
74次组卷
|
2卷引用:重庆市主城区七校2023-2024学年高一上学期期末考试化学试题
名校
7 . 常温下,用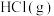 调节
调节 浊液的
浊液的 ,测得在通入
,测得在通入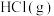 的过程中,体系中
的过程中,体系中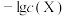 (
( 代表
代表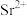 或
或 )与
)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
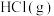 调节
调节 浊液的
浊液的 ,测得在通入
,测得在通入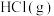 的过程中,体系中
的过程中,体系中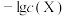 (
( 代表
代表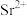 或
或 )与
)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是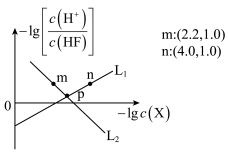
A.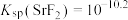 |
B.随着 的加入, 的加入, 溶解度逐渐减小 溶解度逐渐减小 |
C. 点对应的溶液中 点对应的溶液中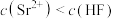 |
D. 、 、 点时的溶液中均存在 点时的溶液中均存在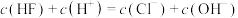 |
您最近一年使用:0次
2024-03-05更新
|
54次组卷
|
8卷引用:重庆市育才中学校2023-2024学年高三上学期三校联考模拟考化学试题(清北班)
名校
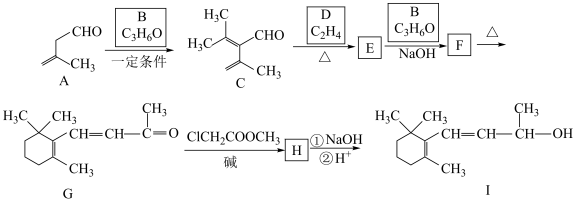
8 . 合成维生素A的中间体I方法如下所示。回答下列问题:
已知:
①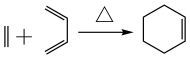
②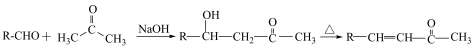
③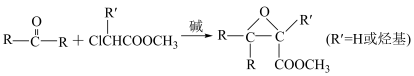
(1)A中含氧官能团的名称___________ 。
(2)B的名称为___________ 。
(3)E的结构简式为___________ ,F→G的反应类型___________ 。
(4)H的结构简式为___________ 。
(5)有机物ClCH2COOCH3与足量NaOH溶液加热时的化学方程式___________ 。
(6)M与C互为同系物,其相对质量比C少28,M的结构有___________ 种(不考虑立体异构,且同一个碳上接两个双键非常不稳定),写出一种不含支链的结构简式___________ 。

已知:
①

②
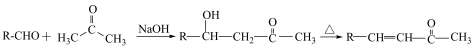
③

(1)A中含氧官能团的名称
(2)B的名称为
(3)E的结构简式为
(4)H的结构简式为
(5)有机物ClCH2COOCH3与足量NaOH溶液加热时的化学方程式
(6)M与C互为同系物,其相对质量比C少28,M的结构有
您最近一年使用:0次
名校
解题方法
9 . 砷为第四周期ⅤA族元素,金属冶炼过程产生的含砷废弃物需处理与检测。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
(1)①亚砷酸中砷元素的化合价为_____ 。
②基态砷原子的最外层电子排布式为______ 。
③砷酸(H3AsO4)的第一步电离方程式为_______ 。
(2)“一级沉砷”后仍然存在H3AsO3,写出“二级沉砷”中H2O2与H3AsO3反应的化学方程式_____ 。
(3)沉淀X主要为一种盐_______ (填化学式)。
(4)根据流程推测:亚砷酸盐的溶解性_____ (填“大于”或“小于”)相应砷酸盐。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10−6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入硫酸共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和难溶物AS2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(5)步骤2的离子方程式为________ 。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10−5g·kg−1,请通过计算说明该排放的废渣中砷元素的含量_______ (填“符合”或“不符合”)排放标准。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

(1)①亚砷酸中砷元素的化合价为
②基态砷原子的最外层电子排布式为
③砷酸(H3AsO4)的第一步电离方程式为
(2)“一级沉砷”后仍然存在H3AsO3,写出“二级沉砷”中H2O2与H3AsO3反应的化学方程式
(3)沉淀X主要为一种盐
(4)根据流程推测:亚砷酸盐的溶解性
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10−6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入硫酸共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和难溶物AS2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(5)步骤2的离子方程式为
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10−5g·kg−1,请通过计算说明该排放的废渣中砷元素的含量
您最近一年使用:0次
名校
解题方法
10 . 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3进行了某些性质实验和定量测定。
实验一:探究Na2CS3的性质
(1)取少量Na2CS3样品于试管中,加水溶解,滴加酸性KMnO4溶液,溶液紫色褪去。
①使用的酸性KMnO4溶液,可以选用____ 酸化(选填字母)。
A.硫酸 B.硝酸 C.盐酸
②已知该反应的氧化产物是 ,该反应的氧化剂与还原剂的物质的量之比为
,该反应的氧化剂与还原剂的物质的量之比为____ 。
实验二:测定Na2CS3溶液的浓度
按如图所示装置进行实验:将50.0mLNa2CS3
溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol·L−1的稀硫酸,关闭活塞。

已知: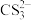 +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(2)仪器d的名称是_______ 。
(3)B中发生反应的化学方程式为_______ 。
(4)反应开始时需要先通入一段时间N2,目的是排除装置中的空气,防止A中生成的H2S被氧化。反应结束后,打开活塞K,再缓慢通入一段时间热N2(高于60℃),其目的是_______ 。
(5)为了计算该Na2CS3溶液的浓度,可测定B中生成沉淀的质量。对B中混合物进行过滤、洗涤、干燥、称重。若B中生成沉淀的质量为7.2g,则该Na2CS3溶液的物质的量浓度是_______ mol/L。
(6)也可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,装置e中的试剂为_______ ;若缺少装置f,计算值会_____ (填“无影响”“偏高”或“偏低”)。
实验一:探究Na2CS3的性质
(1)取少量Na2CS3样品于试管中,加水溶解,滴加酸性KMnO4溶液,溶液紫色褪去。
①使用的酸性KMnO4溶液,可以选用
A.硫酸 B.硝酸 C.盐酸
②已知该反应的氧化产物是
 ,该反应的氧化剂与还原剂的物质的量之比为
,该反应的氧化剂与还原剂的物质的量之比为实验二:测定Na2CS3溶液的浓度
按如图所示装置进行实验:将50.0mLNa2CS3
溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol·L−1的稀硫酸,关闭活塞。

已知:
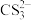 +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)(2)仪器d的名称是
(3)B中发生反应的化学方程式为
(4)反应开始时需要先通入一段时间N2,目的是排除装置中的空气,防止A中生成的H2S被氧化。反应结束后,打开活塞K,再缓慢通入一段时间热N2(高于60℃),其目的是
(5)为了计算该Na2CS3溶液的浓度,可测定B中生成沉淀的质量。对B中混合物进行过滤、洗涤、干燥、称重。若B中生成沉淀的质量为7.2g,则该Na2CS3溶液的物质的量浓度是
(6)也可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,装置e中的试剂为
您最近一年使用:0次



