名校
解题方法
1 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。
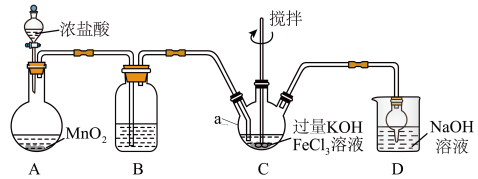
(1)仪器a的名称是______ ,装置B中除杂质所用试剂是______ ,装置D的作用是_____ 。
(2)A中发生反应的化学方程式为______ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是______ 。
(4)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和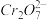 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的化学方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)写出C中总反应的离子方程式:
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和
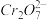 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
710次组卷
|
8卷引用:2019年四川省绵阳市高三第二次诊断性考试理综化学试题
2019年四川省绵阳市高三第二次诊断性考试理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题辽宁省实验中学、东北育才学校、鞍山一中、大连八中、大连二十四中五校联考2021-2022学年高三上学期期末联考化学试题天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题十八化学实验综合题解题策略(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)(已下线)实验综合题
名校
2 . 高锰酸钾为紫黑色、细长的棱形结晶或颗粒,是一种强氧化剂,可溶于水,常用作消毒剂、水净化剂、氧化剂、漂白剂、毒气吸收剂等。
Ⅰ.制备KMnO4
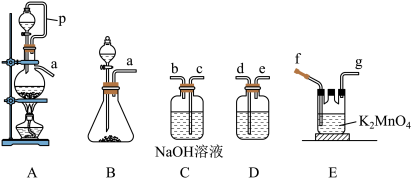
(1)若实验室选用A装置制备Cl2,导管P的作用为_______ 。
(2)若实验室选用B装置制备氯气,当锥形瓶中放置的药品为漂粉精,则对应的化学反应方程式为_______ 。
(3)用氯气氧化K2MnO4制备KMnO4,则其接口顺序为a→_______ (按气流方向从左到右,用小写字母表示)。
(4)工业上采用惰性电极隔膜法电解,可制得KMnO4.装置如图:
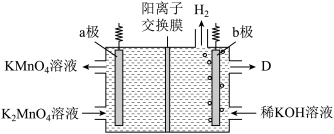
写出电解总反应的化学方程式:_______ 。
Ⅱ.测定KMnO4产品的纯度
称取2.400 0 g样品溶于水,加入硫酸酸化后配成100.00 mL溶液,用移液管取20.00 mL置于锥形瓶中,用0.500 0 mol·L-1标准(NH4)2Fe(SO4)2溶液进行滴定。
(5)滴定终点的现象是_______ 。
(6)数据处理。将三次实验消耗(NH4)2Fe(SO4)2溶液体积取平均值为30.00 mL。计算该KMnO4产品的质量分数为_______ %(保留小数点后两位)。
(7)进一步分析发现,测定结果偏高,其原因可能是_______(填标号)。
Ⅰ.制备KMnO4

(1)若实验室选用A装置制备Cl2,导管P的作用为
(2)若实验室选用B装置制备氯气,当锥形瓶中放置的药品为漂粉精,则对应的化学反应方程式为
(3)用氯气氧化K2MnO4制备KMnO4,则其接口顺序为a→
(4)工业上采用惰性电极隔膜法电解,可制得KMnO4.装置如图:

写出电解总反应的化学方程式:
Ⅱ.测定KMnO4产品的纯度
称取2.400 0 g样品溶于水,加入硫酸酸化后配成100.00 mL溶液,用移液管取20.00 mL置于锥形瓶中,用0.500 0 mol·L-1标准(NH4)2Fe(SO4)2溶液进行滴定。
(5)滴定终点的现象是
(6)数据处理。将三次实验消耗(NH4)2Fe(SO4)2溶液体积取平均值为30.00 mL。计算该KMnO4产品的质量分数为
(7)进一步分析发现,测定结果偏高,其原因可能是_______(填标号)。
| A.洗涤后,锥形瓶未干燥直接加入待测的KMnO4溶液 |
| B.装液前,滴定管水洗后没有用标准液润洗 |
| C.滴定前仰视读数,滴定后俯视读数 |
| D.标准(NH4)2Fe(SO4)2溶液部分氧化变质 |
您最近一年使用:0次
2022-09-30更新
|
404次组卷
|
4卷引用:河南省顶级名校2022-2023学年高三上学期第一次月考化学试题
河南省顶级名校2022-2023学年高三上学期第一次月考化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期10月月考化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考(一)化学试题(已下线)回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
3 . 为检验某漂白粉是否变质,进行下列探究实验:
实验1:取5g漂白粉样品于烧杯中,加足量蒸馏水并搅拌,观察到有固体不溶解。
实验2:静置,取少量实验1的上层清液于试管中。放入红色花瓣,观察到花瓣褪色。
实验3:另取5g漂白粉样品于试管中,滴加浓盐酸,观察到有气体产生。
下列说法正确的是
实验1:取5g漂白粉样品于烧杯中,加足量蒸馏水并搅拌,观察到有固体不溶解。
实验2:静置,取少量实验1的上层清液于试管中。放入红色花瓣,观察到花瓣褪色。
实验3:另取5g漂白粉样品于试管中,滴加浓盐酸,观察到有气体产生。
下列说法正确的是
| A.工业上用氯气和澄清石灰水制取漂白粉 |
| B.实验1和实验2说明漂白粉没有变质 |
| C.实验3中产生的气体只有氯气 |
D.实验3中下列反应的电子转移可表示为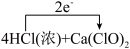 =CaCl2+2Cl2↑+2H2O =CaCl2+2Cl2↑+2H2O |
您最近一年使用:0次
2023-02-15更新
|
821次组卷
|
9卷引用:江苏省南京市2022-2023学年高一上学期期末学情调研测试化学试题
江苏省南京市2022-2023学年高一上学期期末学情调研测试化学试题(已下线)第07讲 氯气的性质和次氯酸-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)专题05 氯及其化合物【考点清单】(讲+练)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)(已下线)专题05 氯及其化合物【考题猜想】(10大题型)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)辽宁省丹东市凤城市第一中学2023-2024学年高三上学期10月测试化学试题江苏省江都区大桥中学2023-2024学年高一上学期期末复习模拟测试化学试题安徽省六安市舒城晓天中学2023-2024学年高一上学期期中考试化学试卷(已下线)专题04 氯气及氯的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)贵州省遵义市桐梓县荣兴高级中学2023-2024学年高一上学期第四次月考化学试题
解题方法
4 . 为探究某绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案。
可供选择的试剂:硫氰化钾溶液、酸性高锰酸钾溶液、氯水、氢氧化钠溶液、氯化钡溶液,请参与完成方案设计。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)如何证明绿矾已经被氧化_______ 。
(2)如何证明绿矾已经被完全氧化_______ 。
(3)在使用硫酸亚铁时,如何防止 的干扰?写出相关离子方程式
的干扰?写出相关离子方程式_______ 。
可供选择的试剂:硫氰化钾溶液、酸性高锰酸钾溶液、氯水、氢氧化钠溶液、氯化钡溶液,请参与完成方案设计。
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液。
(1)如何证明绿矾已经被氧化
(2)如何证明绿矾已经被完全氧化
(3)在使用硫酸亚铁时,如何防止
 的干扰?写出相关离子方程式
的干扰?写出相关离子方程式
您最近一年使用:0次
5 . 实验室有一瓶密封不严的漂白粉样品,其中肯定含有 ,请设计实验探究该样品中可能存在的其他物质[已知
,请设计实验探究该样品中可能存在的其他物质[已知 可使品红溶液褪色]。
可使品红溶液褪色]。
(1)提出合理假设。
假设①:该漂白粉未变质,含有___________ ;
假设②:该漂白粉全部变质,含有___________ ;
假设③:该漂白粉部分变质,既含有 ,又含有
,又含有 。
。
(2)设计实验方案,进行实验。
 ,请设计实验探究该样品中可能存在的其他物质[已知
,请设计实验探究该样品中可能存在的其他物质[已知 可使品红溶液褪色]。
可使品红溶液褪色]。(1)提出合理假设。
假设①:该漂白粉未变质,含有
假设②:该漂白粉全部变质,含有
假设③:该漂白粉部分变质,既含有
 ,又含有
,又含有 。
。(2)设计实验方案,进行实验。
| 实验步骤 | 预期现象和结论 |
| 实验①:取少量上述漂白粉样品于试管中,加入适量稀盐酸,观察是否有气泡产生 | a.若无气泡产生,则假设 b. |
| 实验②:向实验①反应后的试管中滴人1~2滴品红溶液,振荡 | c.若品红溶液褪色,结合实验①中的b判断,则假设 d.若品红溶液不褪色,结合b判断,则假设 |
您最近一年使用:0次
名校
解题方法
6 .  俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。下列说法中根据实验目的、实验操作或现象得到的相关离子方程式正确的是
俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。下列说法中根据实验目的、实验操作或现象得到的相关离子方程式正确的是
 俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。下列说法中根据实验目的、实验操作或现象得到的相关离子方程式正确的是
俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。下列说法中根据实验目的、实验操作或现象得到的相关离子方程式正确的是| 选项 | 实验目的 | 实验操作或现象 | 相关离子方程式 |
| A | 制备 | 实验室用 通入 通入 和 和 的混合溶液中来制备 的混合溶液中来制备 | 4SO2+2S2-+CO =3S2O =3S2O +CO2 +CO2 |
| B | 检验硫代硫酸钠氧化变质可能混有的 | 取少量样品溶于水,先加入过量稀盐酸,再滴加 溶液,有沉淀生成 溶液,有沉淀生成 | SO +Ba2+=BaSO4↓ +Ba2+=BaSO4↓ |
| C | 探究温度对硫代硫酸钠与硫酸反应速率的影响 | 分别将两种反应溶液先混合,再水浴加热至反应要求温度,测得该温度下的反应速率 | 2S2O +2H+=S↓+SO +2H+=S↓+SO +2H2O +2H2O |
| D | 用过量硫代硫酸钠除去水中溶解的氯气 | 黄绿色褪去 | S2O +4Cl2+5H2O=2SO +4Cl2+5H2O=2SO +8Cl-+10H+ +8Cl-+10H+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-11更新
|
2452次组卷
|
7卷引用:素养卷09 微型原理验证方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
(已下线)素养卷09 微型原理验证方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)江苏省靖江高级中学、华罗庚中学2023-2024学年高三上学期第一次阶段考试化学试题湖南省四大名校名师团队2022-2023学年高三下学期2月模拟冲刺卷(1)化学试题(已下线)专题04 离子反应湖南省部分学校2022-2023学年高三下学期开学考试化学试题湖南省衡阳市第八中学2023-2024学年高三上学期开学(暑假检测)化学试题江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
7 .  和焦亚硫酸钠
和焦亚硫酸钠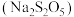 可用作食品添加剂。回答下列问题:
可用作食品添加剂。回答下列问题:
(1)实验室用 和
和 制取
制取 的化学方程式为
的化学方程式为_______ 。欲净化与收集 ,选择必要装置,按气流方向连接顺序为
,选择必要装置,按气流方向连接顺序为_______ (填仪器接口的字母编号)。
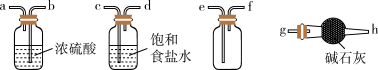
(2)①焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。已知: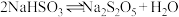 。
。
试剂:稀盐酸、稀 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液
② 是常用的食品添加剂,常用于葡萄酒、果脯、拉面等食品中。为检验某白葡萄酒中是否含有
是常用的食品添加剂,常用于葡萄酒、果脯、拉面等食品中。为检验某白葡萄酒中是否含有 能否用酸性
能否用酸性 溶液检验?作出判断并说明理由
溶液检验?作出判断并说明理由_______ 。
(3)某小组利用下列装置测定空气中 的含量。
的含量。
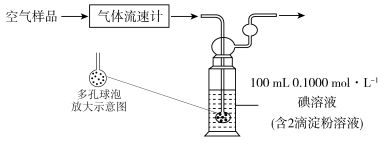
通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是_______ ;该装置中发生的离子方程式为:_______ 。若空气流速为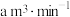 ,当观察到
,当观察到_______ 时,结束计时,测定耗时t min。假定样品中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是_______ 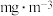 。
。
 和焦亚硫酸钠
和焦亚硫酸钠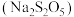 可用作食品添加剂。回答下列问题:
可用作食品添加剂。回答下列问题:(1)实验室用
 和
和 制取
制取 的化学方程式为
的化学方程式为 ,选择必要装置,按气流方向连接顺序为
,选择必要装置,按气流方向连接顺序为
(2)①焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。已知:
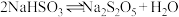 。
。试剂:稀盐酸、稀
 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液| 实验编号 | 实验步骤 | 现象 | 结论 |
| Ⅰ | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | / |
| Ⅱ | 取实验Ⅰ的溶液, | 样品已氧化变质 | |
| Ⅲ | 另取实验Ⅰ的溶液,加入酸性KMnO4溶液 | 溶液褪色 | 样品未完全氧化变质 |
 是常用的食品添加剂,常用于葡萄酒、果脯、拉面等食品中。为检验某白葡萄酒中是否含有
是常用的食品添加剂,常用于葡萄酒、果脯、拉面等食品中。为检验某白葡萄酒中是否含有 能否用酸性
能否用酸性 溶液检验?作出判断并说明理由
溶液检验?作出判断并说明理由(3)某小组利用下列装置测定空气中
 的含量。
的含量。
通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是
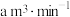 ,当观察到
,当观察到 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是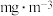 。
。
您最近一年使用:0次
2022-05-23更新
|
452次组卷
|
4卷引用:天津市滨海新区2022届普通高考模拟试卷化学试题
天津市滨海新区2022届普通高考模拟试卷化学试题天津市高三九校2022届高三第二次模拟考试化学试题湖南省娄底市新化县第一中学2021-2022学年高三下学期模拟考试化学试题(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编
8 . 亚硫酸钠(Na2SO3)是印染工业中常用的脱氧剂和漂白剂。回答下列问题:
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:___________
(2)SO2可以与H2S反应,请写出其化学方程式:___________ 。
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(4)(Ga)与A1同主族,化学性质相似,是制造半导体材料氮化镓的重要原料,其中电解NaGaO2是获得Ga单质的重要方法,如图所示,则阴极的电极反应为:___________ 。若电解获得1molGa,则阳极产生的气体在标准状况下的体积至少为 ___________ L。

(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:
(2)SO2可以与H2S反应,请写出其化学方程式:
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解,得到无色溶液 | / |
| II | 取实验I的溶液, | 样品存在氧化变质 | |
| III | 另取实验I的溶液, | 样品并未完全氧化变质 |

您最近一年使用:0次
21-22高一·全国·假期作业
9 . Na2O2是一种重要化工原料,工业上可以用来漂白纺织类物品、麦秆、纤维等。回答下列问题:
(1)Na2O2中氧元素化合价为_______ ,写出过氧化钠与水反应的化学方程式_______ 。
(2)过氧化钠若长期保存不当,容易生成_______ (填化学式),证明过氧化钠变质情况的一种实验方案如下。
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下_______ m3空气(只需列出计算表达式,已知氧气占空气体积分数约为20%,空气的密度为1.293g/cm3)。
(1)Na2O2中氧元素化合价为
(2)过氧化钠若长期保存不当,容易生成
| 操作 | 现象 | 结论 |
| 取少量样品于试管中,加水溶解,加入 | 有白色沉淀生成 | |
| 另取少量样品于试管中,再加入适量的水,用带火星的木条靠近管口 | 带火星的木条复燃 |
(3)过氧化钠还可以作为潜艇工作人员的供氧剂,某工作人员携带10kg的过氧化钠固体进入潜艇,相当于携带标况下
您最近一年使用:0次
解题方法
10 . 过氧化锶(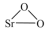 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→____ (选择必要的仪器,可重复选择)。
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式____ 。
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:
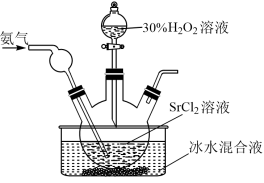
①盛装H2O2溶液的仪器名称为____ 。
②写出该方法制备SrO2·8H2O的离子方程式____ ,NH3的作用是___ 。
③冰水浴的原因是___ 。
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至____ (写出实验现象),记下此时消耗标准溶液的体积,重复实验3~4次,得如表数据:
SrO2·8H2O样品的纯度为____ (已知:I2+2S2O =2I-+S4O
=2I-+S4O )
)
 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:

①盛装H2O2溶液的仪器名称为
②写出该方法制备SrO2·8H2O的离子方程式
③冰水浴的原因是
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至
| 平行实验 | 1 | 2 | 3 | 4 |
| 消耗标准溶液体积(mL) | 19.98 | 19.50 | 20.00 | 20.02 |
 =2I-+S4O
=2I-+S4O )
)
您最近一年使用:0次



