解题方法
1 . 已知20℃硝酸钾饱和溶液质量分数为24%,密度为1.1 g/cm3,下列说法正确的是
| A.20℃时硝酸钾在水中溶解度为24 g |
| B.20℃时硝酸钾溶液的物质的量浓度一定为2.61 mol/L |
| C.20℃,1 L硝酸钾饱和溶液中含有K+约2.61 mol |
| D.20℃时等体积硝酸钾饱和溶液与蒸馏水混合所得稀溶液溶质质量分数为12% |
您最近一年使用:0次
2021-12-07更新
|
234次组卷
|
5卷引用:江西省七校2021-2022学年高三上学期第一次联考化学试题
江西省七校2021-2022学年高三上学期第一次联考化学试题(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)2.2.2 物质的量浓度相关计算(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)安徽省肥东县圣泉中学2020-2021学年高一上学期期中考试化学试题
名校
2 . 硫酸是一种重要的工业原料。
(1)稀硫酸具有酸性,其电离方程式为:___________ ;稀硫酸可以和 反应生成正盐和水,其反应的离子方程式为:
反应生成正盐和水,其反应的离子方程式为:___________ ;常用稀硫酸清洗铁锈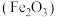 ,其反应的离子方程式为:
,其反应的离子方程式为:___________ 。
(2)某学生计划用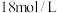 的浓硫酸配制
的浓硫酸配制 的稀硫酸500mL,需要量取浓硫酸的体积为
的稀硫酸500mL,需要量取浓硫酸的体积为___________ mL;除量筒、烧杯、试剂瓶外,还缺少的玻璃仪器有___________ 。
(3)有两份硫酸溶液,根据下表信息,回答有关问题:
①等质量两份溶液混合,则所得混合液中溶质的质量分数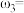
___________ (用含有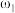 和
和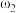 的代数式表示);
的代数式表示);
②已知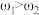 ,
,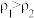 。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为
。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为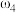 ,则
,则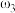
___________ 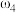 (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)在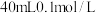 的
的 溶液中,加入足量
溶液中,加入足量 的
的 溶液使
溶液使 完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入
完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入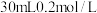 的NaOH溶液恰好反应呈中性,通过计算可知
的NaOH溶液恰好反应呈中性,通过计算可知 溶液体积为
溶液体积为___________ mL。
(5)在两份相同体积相同浓度的 溶液中,分别逐滴滴入物质的量浓度相等的
溶液中,分别逐滴滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
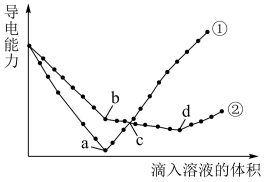
其中 和
和 反应的曲线为
反应的曲线为_____ 。(填①或②);滴定至b点时,溶液中主要存在的离子有___________ 。
(6)为方便计算,有人将98%浓硫酸表示成下列形式,其中合理的是_____ (填字母选项)。
A.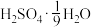 B.
B.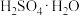
C.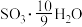 D.
D.
浓硫酸在加热条件下能和铜反应: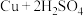 (浓)
(浓)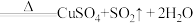 ,该反应中氧化剂和还原剂物质的量之比为
,该反应中氧化剂和还原剂物质的量之比为_____ 。
(1)稀硫酸具有酸性,其电离方程式为:
 反应生成正盐和水,其反应的离子方程式为:
反应生成正盐和水,其反应的离子方程式为: ,其反应的离子方程式为:
,其反应的离子方程式为:(2)某学生计划用
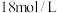 的浓硫酸配制
的浓硫酸配制 的稀硫酸500mL,需要量取浓硫酸的体积为
的稀硫酸500mL,需要量取浓硫酸的体积为(3)有两份硫酸溶液,根据下表信息,回答有关问题:
| 溶质的质量分数 | 溶液的密度 | |
| 第一份溶液 | 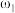 | 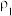 |
| 第二份溶液 | 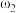 | 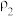 |
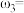
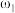 和
和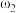 的代数式表示);
的代数式表示);②已知
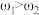 ,
,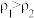 。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为
。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为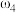 ,则
,则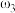
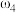 (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。(4)在
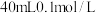 的
的 溶液中,加入足量
溶液中,加入足量 的
的 溶液使
溶液使 完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入
完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入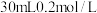 的NaOH溶液恰好反应呈中性,通过计算可知
的NaOH溶液恰好反应呈中性,通过计算可知 溶液体积为
溶液体积为(5)在两份相同体积相同浓度的
 溶液中,分别逐滴滴入物质的量浓度相等的
溶液中,分别逐滴滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
其中
 和
和 反应的曲线为
反应的曲线为(6)为方便计算,有人将98%浓硫酸表示成下列形式,其中合理的是
A.
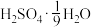 B.
B.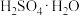
C.
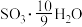 D.
D.
浓硫酸在加热条件下能和铜反应:
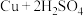 (浓)
(浓)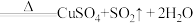 ,该反应中氧化剂和还原剂物质的量之比为
,该反应中氧化剂和还原剂物质的量之比为
您最近一年使用:0次
名校
3 . 下列有关溶液配制的叙述正确的是
| A.配制0.400 0 mol·L-1的NaOH溶液,称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容 |
| B.用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,用到的玻璃仪器有烧杯、玻璃棒、容量瓶和胶头滴管 |
| C.量取27.2 mL 18.4 mol·L-1浓硫酸于烧杯中,加水稀释、冷却后转移至500 mL容量瓶中即可得1.0 mol·L-1的H2SO4溶液 |
| D.称取0.158 g KMnO4固体,放入100 mL 容量瓶中,加水溶解并稀释至刻度,即可得到0.010 mol·L-1的KMnO4溶液 |
您最近一年使用:0次
2021-12-04更新
|
628次组卷
|
4卷引用:重庆市第八中学校2021-2022学年高三上学期期中考试化学试题
重庆市第八中学校2021-2022学年高三上学期期中考试化学试题(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)江苏省盐城市东台中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
4 . 正确的表示和计算溶液的组成和浓度,对生产生活有非常的重要意义,下列关于溶液浓度的说法中正确的是
| A.将1L0.5mol·L-1的盐酸加热浓缩为0.5L,此时盐酸浓度小于1mol·L-1 |
| B.将40g氢氧化钠溶于1L水中,可配制1mol/L的氢氧化钠溶液 |
C.将agNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/mL,溶质的物质的量浓度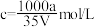 |
D.Al2(SO4)3溶液中含Al3+物质的量浓度为amol·L-1,取0.5VmL溶液稀释到5VmL,则稀释后溶液中SO 的物质的量浓度是0.3amol·L-1 的物质的量浓度是0.3amol·L-1 |
您最近一年使用:0次
21-22高一上·江苏苏州·期中
名校
解题方法
5 . 根据所学知识,回答下列问题:
(1)下列几种物质,其中属于电解质的是___________ ,属于弱电解质的是___________ (填序号)
①CO2②H2O③盐酸④KOH⑤BaSO4⑥NH3⑦冰醋酸⑧NaHCO3⑨酒精⑩H2S
(2)配制250mL0.1mol·L-1的盐酸,应用量筒量取密度为1.25g·mL-1,质量分数为36.5%浓盐酸体积___________ mL。
(3)高铁酸钾(K2FeO4)是种多功能绿色水处理剂,其中铁元素的化合价为+6价。制备高铁酸钾的反应体系中有六种微粒:FeO 、Fe(OH)3、Cl-、ClO-、OH-、H2O。
、Fe(OH)3、Cl-、ClO-、OH-、H2O。
①该反应在碱性条件下进行,请写出制备高铁酸钾的离子反应方程式___________ 。
②若该反应过程中转移了0.3mol电子,则还原产物的物质的量为___________ 。
(1)下列几种物质,其中属于电解质的是
①CO2②H2O③盐酸④KOH⑤BaSO4⑥NH3⑦冰醋酸⑧NaHCO3⑨酒精⑩H2S
(2)配制250mL0.1mol·L-1的盐酸,应用量筒量取密度为1.25g·mL-1,质量分数为36.5%浓盐酸体积
(3)高铁酸钾(K2FeO4)是种多功能绿色水处理剂,其中铁元素的化合价为+6价。制备高铁酸钾的反应体系中有六种微粒:FeO
 、Fe(OH)3、Cl-、ClO-、OH-、H2O。
、Fe(OH)3、Cl-、ClO-、OH-、H2O。①该反应在碱性条件下进行,请写出制备高铁酸钾的离子反应方程式
②若该反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次
名校
解题方法
6 . 填空。
(1)同温同压下,等质量的 和
和 气体的体积比为
气体的体积比为___________ ,所含O原子数目之比为___________ 。
(2)配制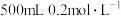 的稀HCl溶液,需要量取
的稀HCl溶液,需要量取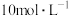 的浓HCl
的浓HCl___________ mL。
(3)2.4gC与一定量的 充分反应后得到混合气体的质量为6.4g,则混合气体中
充分反应后得到混合气体的质量为6.4g,则混合气体中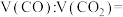
___________ 。
(1)同温同压下,等质量的
 和
和 气体的体积比为
气体的体积比为(2)配制
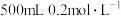 的稀HCl溶液,需要量取
的稀HCl溶液,需要量取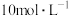 的浓HCl
的浓HCl(3)2.4gC与一定量的
 充分反应后得到混合气体的质量为6.4g,则混合气体中
充分反应后得到混合气体的质量为6.4g,则混合气体中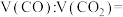
您最近一年使用:0次
7 . 现需要250mL0.5mol/L的稀盐酸,用实验室提供的浓盐酸进行配制,浓盐酸试剂瓶标签如图所示。回答下列问题:
(1)该浓盐酸的物质的量浓度为___________ mol/L。量取___________ mL。上述浓盐酸进行配制,应选用下列量筒中的___________ (填标号)。
a.10mL b.15mL c.25mL d.0mL
(2)配制操作步骤可分解为以下几步:
A.用量筒量取所需体积的浓盐酸,将其沿玻璃棒缓缓注入烧杯中,再向烧杯中加入少量蒸馏水,用玻璃棒慢慢搅动
B.将已恢复至室温的稀盐酸小心地用玻璃棒引流入250mL容量瓶
C.用约30mL蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液都注入容量瓶中
D.继续往容量瓶中加蒸馏水,至液面接近刻度线1~2cm
E.……
F.盖紧瓶塞,反复倾倒振荡,摇匀溶液
G.将配制好的稀盐酸倒入试剂瓶,贴上标签
步骤E为___________ 。
(3)操作C的目的是___________ 。
(4)配制上述溶液时,下列操作会导致所配溶液的浓度偏高的是___________ (填标号)。
a.量筒量取浓盐酸读数时俯视
b.未等恢复至室温就转移
c.向容量瓶转移时,不慎将少量溶液洒到容量瓶外面
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
(5)某同学用所配制的稀盐酸滴到5.3g碳酸钠固体中,待固体全部反应,需该盐酸体积为___________ mL。
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g/mL 质量分数:36.5% |
(1)该浓盐酸的物质的量浓度为
a.10mL b.15mL c.25mL d.0mL
(2)配制操作步骤可分解为以下几步:
A.用量筒量取所需体积的浓盐酸,将其沿玻璃棒缓缓注入烧杯中,再向烧杯中加入少量蒸馏水,用玻璃棒慢慢搅动
B.将已恢复至室温的稀盐酸小心地用玻璃棒引流入250mL容量瓶
C.用约30mL蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液都注入容量瓶中
D.继续往容量瓶中加蒸馏水,至液面接近刻度线1~2cm
E.……
F.盖紧瓶塞,反复倾倒振荡,摇匀溶液
G.将配制好的稀盐酸倒入试剂瓶,贴上标签
步骤E为
(3)操作C的目的是
(4)配制上述溶液时,下列操作会导致所配溶液的浓度偏高的是
a.量筒量取浓盐酸读数时俯视
b.未等恢复至室温就转移
c.向容量瓶转移时,不慎将少量溶液洒到容量瓶外面
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
(5)某同学用所配制的稀盐酸滴到5.3g碳酸钠固体中,待固体全部反应,需该盐酸体积为
您最近一年使用:0次
解题方法
8 . 实验室用质量分数为20.0%的盐酸配制250mL0.400 稀盐酸。请填写完整以下实验步骤并回答有关问题:
稀盐酸。请填写完整以下实验步骤并回答有关问题:
(1)步骤1:计算。查得室温下20.0%的盐酸密度为1.095 ,则该盐酸的物质的量浓度为
,则该盐酸的物质的量浓度为___________  。进而计算得出配制所需20.0%盐酸的体积。
。进而计算得出配制所需20.0%盐酸的体积。
(2)步骤2:称量。本次实验量取盐酸所需量筒规格为___________ mL。
步骤3:稀释。将量取的盐酸倒入烧杯,再倒入适量蒸馏水,静置,待溶液温度恢复至室温。
(3)步骤4:转移、洗涤。将烧杯中的溶液转移到容量瓶需使用___________ 引流。用适量蒸馏水洗涤烧杯等仪器,洗涤液转入容量瓶,重复2~3次。容量瓶内液面未达瓶颈前将瓶内溶液混匀。
(4)步骤5:定容、摇匀:加蒸馏水至距离刻度线1~2cm处,平视环形刻度线,改用___________ 逐滴加水至凹液面最低处与刻度线相切。摇匀,倒入试剂瓶并贴上标签。
(5)使用容量瓶前必须进行的一步操作是___________ 。
(6)在配制过程中,其他操作都正确,下列操作会引起浓度偏低的是___________ (填字母)。
A.容量瓶洗净后未干燥,有蒸馏水残留
B.量取盐酸后用蒸馏水将量筒内残留盐酸洗出并转入容量瓶
C.稀释盐酸的烧杯未用蒸馏水洗涤
D.转移稀释后的盐酸时少量溶液顺着容量瓶口流至瓶外
E.定容时俯视刻度线
F.摇匀后发现液面低于刻度线,重新定容至刻度线
 稀盐酸。请填写完整以下实验步骤并回答有关问题:
稀盐酸。请填写完整以下实验步骤并回答有关问题:(1)步骤1:计算。查得室温下20.0%的盐酸密度为1.095
 ,则该盐酸的物质的量浓度为
,则该盐酸的物质的量浓度为 。进而计算得出配制所需20.0%盐酸的体积。
。进而计算得出配制所需20.0%盐酸的体积。(2)步骤2:称量。本次实验量取盐酸所需量筒规格为
步骤3:稀释。将量取的盐酸倒入烧杯,再倒入适量蒸馏水,静置,待溶液温度恢复至室温。
(3)步骤4:转移、洗涤。将烧杯中的溶液转移到容量瓶需使用
(4)步骤5:定容、摇匀:加蒸馏水至距离刻度线1~2cm处,平视环形刻度线,改用
(5)使用容量瓶前必须进行的一步操作是
(6)在配制过程中,其他操作都正确,下列操作会引起浓度偏低的是
A.容量瓶洗净后未干燥,有蒸馏水残留
B.量取盐酸后用蒸馏水将量筒内残留盐酸洗出并转入容量瓶
C.稀释盐酸的烧杯未用蒸馏水洗涤
D.转移稀释后的盐酸时少量溶液顺着容量瓶口流至瓶外
E.定容时俯视刻度线
F.摇匀后发现液面低于刻度线,重新定容至刻度线
您最近一年使用:0次
解题方法
9 . 实验是化学的基础,配制一定物质的量浓度溶液是必修1的重要实验,按要求填写下列空白。
(1)用固体配制溶液:某同学按下列步骤配制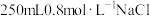 溶液。
溶液。
①实验室提供了以下仪器:烧杯、 量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是
量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是_______ 。在所缺少的仪器上无需有的标记是_______ (填字母序号)。
A.浓度B.温度C.刻度线D.容量
②实验步骤:
A.计算所需 的质量并用托盘天平称量
的质量并用托盘天平称量 的质量为
的质量为_______ g。
B.将 加入
加入 烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是
烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是_______ 。
C.向容量瓶中加蒸馏水至刻度线,在进行此操作时当加水至刻度线1~2厘米处应如何操作:_______ 。
③取出该 溶液
溶液 加水稀释到
加水稀释到 ,稀释后溶液中
,稀释后溶液中 的物质的量浓度是
的物质的量浓度是_______ 。
(2)用浓溶液配制稀溶液:实验室现需要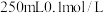 的盐酸溶液,准备用密度为
的盐酸溶液,准备用密度为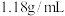 ,质量分数为36.5%浓盐酸来配制。
,质量分数为36.5%浓盐酸来配制。
①浓盐酸的物质的量浓度为_______  。
。
②配制 的盐酸溶液,用量筒量取浓盐酸的体积约为
的盐酸溶液,用量筒量取浓盐酸的体积约为_______  。
。
(3)误差分析:配制 溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。
溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。
(1)用固体配制溶液:某同学按下列步骤配制
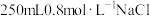 溶液。
溶液。①实验室提供了以下仪器:烧杯、
 量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是
量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是A.浓度B.温度C.刻度线D.容量
②实验步骤:
A.计算所需
 的质量并用托盘天平称量
的质量并用托盘天平称量 的质量为
的质量为B.将
 加入
加入 烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是
烧杯中,并加入适量水完全溶解后,将烧杯中溶液转移至一定容积的容量瓶中,为了防止溶液溅出,应采取的措施是C.向容量瓶中加蒸馏水至刻度线,在进行此操作时当加水至刻度线1~2厘米处应如何操作:
③取出该
 溶液
溶液 加水稀释到
加水稀释到 ,稀释后溶液中
,稀释后溶液中 的物质的量浓度是
的物质的量浓度是(2)用浓溶液配制稀溶液:实验室现需要
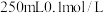 的盐酸溶液,准备用密度为
的盐酸溶液,准备用密度为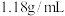 ,质量分数为36.5%浓盐酸来配制。
,质量分数为36.5%浓盐酸来配制。①浓盐酸的物质的量浓度为
 。
。②配制
 的盐酸溶液,用量筒量取浓盐酸的体积约为
的盐酸溶液,用量筒量取浓盐酸的体积约为 。
。(3)误差分析:配制
 溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。
溶液和稀盐酸时,以下操作会使结果偏高的是_______(填字母序号)。| A.量取浓盐酸时仰视读数 |
| B.混匀后液面低于刻度线,加水补齐 |
| C.定容时俯视容量瓶瓶颈的刻度线 |
D.未洗涤溶解 的烧杯 的烧杯 |
您最近一年使用:0次
解题方法
10 . 某次实验需要使用480 mL、0.1 mol/L的Na2CO3溶液,现用Na2CO3·10H2O配制该溶液,回答下列问题。
(1)实验中需要称取_______ g Na2CO3·10H2O,溶解前_______ (填“需要”、“不需要”)通过加热方法除去结晶水。
(2)配制步骤可表示如下图所示。
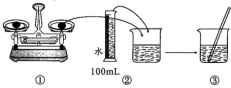

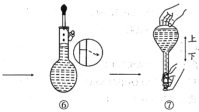
其中有错误的操作是_______ (填“编号”),当液面距刻度线_______ cm时改用胶头滴管滴加蒸馏水。
(3)在配制过程中,下列操作会使溶液浓度偏小的是_______(填字母)。
(4)取20 mL所配溶液与0.2 mol/LBaCl2溶液混合,若二者恰好反应完,则所用BaCl2溶液体积是_______ 。若取10 mL所配制的溶液,将其稀释至50 mL,则稀释后的溶液中c(Na2CO3)=_______ ,所加水的体积_______ (填“等于”、“小于”、“大于”)40 mL。
(1)实验中需要称取
(2)配制步骤可表示如下图所示。



其中有错误的操作是
(3)在配制过程中,下列操作会使溶液浓度偏小的是_______(填字母)。
| A.移液时,未洗涤烧杯内壁和玻璃棒 |
| B.定容时俯视刻度线 |
| C.未冷却到室温就将溶液转移到容量瓶并定容 |
| D.定容后塞上瓶塞反复摇匀,静置后液面低于刻度线,再加水至刻度线 |
您最近一年使用:0次



