1 . 实验时需用约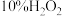 溶液
溶液 ,现用市售
,现用市售 (密度近似为
(密度近似为 )的
)的 来配制,简述其具体配制方法
来配制,简述其具体配制方法_______ 。
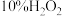 溶液
溶液 ,现用市售
,现用市售 (密度近似为
(密度近似为 )的
)的 来配制,简述其具体配制方法
来配制,简述其具体配制方法
您最近一年使用:0次
2023高三·全国·专题练习
2 . 现有浓H3PO4质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的H3PO4溶液,则需浓H3PO4_______ mL(保留一位小数)。
您最近一年使用:0次
3 . 配制250mL0.125mol/L的NaOH溶液
(1)通过计算需要称量NaOH_______ g。进溶解、冷却后,需转移到_______ mL的容量瓶中,再洗掉烧杯、玻璃棒再将洗涤液转移到容量瓶中,最后,缓缓地把蒸馏水注入容量瓶,直到液面接近刻度_______ 处,改用_______ (仪器)加水到刻度线,使溶液的_______ 正好跟刻度线相切。塞好瓶塞,反复摇匀。
(2)配制稀的氢氧化钠溶液,也可用稀释法。如,取10mL 6mol/L的NaOH溶液加水稀释至100mL,溶液的物质的量浓度变为_______ mol/L。
(1)通过计算需要称量NaOH
(2)配制稀的氢氧化钠溶液,也可用稀释法。如,取10mL 6mol/L的NaOH溶液加水稀释至100mL,溶液的物质的量浓度变为
您最近一年使用:0次
名校
解题方法
4 . 关于如图所示过程的说法正确的是
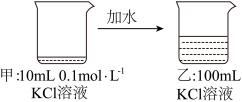

| A.甲比乙中溶质的质量分数小 | B.乙中 |
| C.乙比甲中KCl的溶解度大 | D.乙中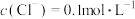 |
您最近一年使用:0次
2023-01-05更新
|
225次组卷
|
3卷引用:北京市东城区2022-2023学年高一上学期期末统一检测化学试卷
22-23高一上·江苏南通·期中
名校
解题方法
5 . 黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe3O4、Fe2O3)生产 溶液的流程如下图所示:
溶液的流程如下图所示:
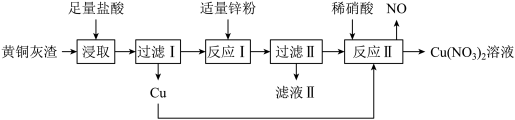
(1)写出“浸取”时Fe3O4反应的离子方程式:_______ 。
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由:_______ 。
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是_______ 。
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。
①若要获得100mL1.4mol·L-1的稀硝酸,需要用到浓硝酸的体积为_______ mL。
②NO是一种无色气体,依据信息写出“反应Ⅱ”的化学方程式:_______ 。
 溶液的流程如下图所示:
溶液的流程如下图所示:
(1)写出“浸取”时Fe3O4反应的离子方程式:
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由:
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。
①若要获得100mL1.4mol·L-1的稀硝酸,需要用到浓硝酸的体积为
②NO是一种无色气体,依据信息写出“反应Ⅱ”的化学方程式:
您最近一年使用:0次
2022-12-22更新
|
277次组卷
|
4卷引用:江苏省南通市如皋市2022-2023学年高一上学期期中教学质量调研化学试题
(已下线)江苏省南通市如皋市2022-2023学年高一上学期期中教学质量调研化学试题江苏省盐城市射阳县第二中学2022-2023学年高一上学期11月期中考试化学试题黑龙江省 牡丹江市第一高级中学2023-2024学年高一上学期12月月考化学试题河南省顶级名校2023-2024学年高一上学期12月月考化学试题
6 . 计算填空:
(1)实验室要配制360 g 10%的盐酸,需要36%的浓盐酸的质量是_______ 。
(2)配制溶质质量分数20%的稀硫酸溶液100 g,需要98%的浓硫酸(密度为1.84 g·mL-1)的体积是_______ 。
(3)配制溶质质量分数为20%的硫酸溶液1000g,需要98%的浓硫酸的质量是_______ ,需要10%的稀硫酸的质量是_______ 。
(1)实验室要配制360 g 10%的盐酸,需要36%的浓盐酸的质量是
(2)配制溶质质量分数20%的稀硫酸溶液100 g,需要98%的浓硫酸(密度为1.84 g·mL-1)的体积是
(3)配制溶质质量分数为20%的硫酸溶液1000g,需要98%的浓硫酸的质量是
您最近一年使用:0次
名校
7 . 硫酸的工业制取原理为① ,②
,②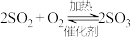 ,③
,③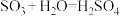 。请回答下列问题:
。请回答下列问题:
(1)请配平反应①的化学方程式:_______
 。
。
(2)标准状况下,
 的摩尔质量为
的摩尔质量为_______ ,质量为_______ g。
(3)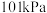 、120℃下,等质量的
、120℃下,等质量的 和
和 的物质的量之比为
的物质的量之比为_______ ,密度之比为_______ 。
(4)质量分数为98%的浓硫酸(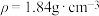 )的物质的量浓度为
)的物质的量浓度为_______  ;实验室需要配制
;实验室需要配制
 硫酸溶液,需要用量筒量取该浓硫酸的体积为
硫酸溶液,需要用量筒量取该浓硫酸的体积为_______ mL;若从配制好的硫酸溶液中取出 ,其浓度为
,其浓度为_______  ,将这
,将这 硫酸溶液稀释至
硫酸溶液稀释至 ,溶液中
,溶液中 浓度为
浓度为_______  。
。
 ,②
,②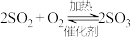 ,③
,③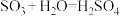 。请回答下列问题:
。请回答下列问题:(1)请配平反应①的化学方程式:
 。
。(2)标准状况下,

 的摩尔质量为
的摩尔质量为(3)
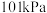 、120℃下,等质量的
、120℃下,等质量的 和
和 的物质的量之比为
的物质的量之比为(4)质量分数为98%的浓硫酸(
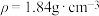 )的物质的量浓度为
)的物质的量浓度为 ;实验室需要配制
;实验室需要配制
 硫酸溶液,需要用量筒量取该浓硫酸的体积为
硫酸溶液,需要用量筒量取该浓硫酸的体积为 ,其浓度为
,其浓度为 ,将这
,将这 硫酸溶液稀释至
硫酸溶液稀释至 ,溶液中
,溶液中 浓度为
浓度为 。
。
您最近一年使用:0次
2022-12-07更新
|
205次组卷
|
3卷引用:四川省成都市四校2022-2023学年高一上学期12月联考化学试题
名校
8 . 下图是化学实验室浓盐酸试剂标签上的部分内容。

(1)写出工业上制HCl的化学方程式_______ ,在实验室中进行该反应,现象是_______
(2)该盐酸的物质的量浓度为_______ ,
(3)同学计划用该浓盐酸配制 的稀盐酸,现实验需要稀盐酸470 mL,可供选用的仪器有:
的稀盐酸,现实验需要稀盐酸470 mL,可供选用的仪器有:
A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E玻璃棒。
①配制稀盐酸时,选择的仪器有:_______ (填序号),还缺少的仪器有_______ 。
②经计算,配制 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为_______ mL。
③测定所配制的稀盐酸,发现其浓度大于 ,引起误差的原因可能是
,引起误差的原因可能是_______ 。
A.量取浓盐酸时俯视刻度线
B.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶刻度线
E.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(4)现有该浓盐酸100g,需要加入一定量的水将其物质的量浓度稀释为原来的1/2,则加入水的体积是_______ 。
A.大于100 mL B.小于100 mL C.等于100 mL

(1)写出工业上制HCl的化学方程式
(2)该盐酸的物质的量浓度为
(3)同学计划用该浓盐酸配制
 的稀盐酸,现实验需要稀盐酸470 mL,可供选用的仪器有:
的稀盐酸,现实验需要稀盐酸470 mL,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E玻璃棒。
①配制稀盐酸时,选择的仪器有:
②经计算,配制
 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为③测定所配制的稀盐酸,发现其浓度大于
 ,引起误差的原因可能是
,引起误差的原因可能是A.量取浓盐酸时俯视刻度线
B.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容时俯视容量瓶刻度线
E.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(4)现有该浓盐酸100g,需要加入一定量的水将其物质的量浓度稀释为原来的1/2,则加入水的体积是
A.大于100 mL B.小于100 mL C.等于100 mL
您最近一年使用:0次
2022-12-07更新
|
464次组卷
|
5卷引用:四川省成都市第七中学2022-2023学年高一上学期12月月考化学试题
9 . 已知,有一质量分数为40%的NaOH溶液,密度为1.42g/mL,求:
(1)该NaOH溶液的物质的量浓度为___________ ;
(2)取上述NaOH溶液50mL,加水稀释至355mL,稀释后的NaOH溶液的物质的量浓度为___________ ;
(3)将一定量的Na、Fe混合物投入足量水中,充分反应,共收集到气体44.8L(标准状况下),若将同质量、同组分的Na、Fe混合物投入足量盐酸中,充分反应,共收集到气体56.0L(标准状况下)。问:Na和Fe分别多少克___________ ?(该题请写出相应的计算过程,没过程不得分。)
(1)该NaOH溶液的物质的量浓度为
(2)取上述NaOH溶液50mL,加水稀释至355mL,稀释后的NaOH溶液的物质的量浓度为
(3)将一定量的Na、Fe混合物投入足量水中,充分反应,共收集到气体44.8L(标准状况下),若将同质量、同组分的Na、Fe混合物投入足量盐酸中,充分反应,共收集到气体56.0L(标准状况下)。问:Na和Fe分别多少克
您最近一年使用:0次
名校
10 . 下列说法不正确的是
A.VL  溶液中含 溶液中含 mg,则溶液中 mg,则溶液中 的物质的量浓度为 的物质的量浓度为 |
B.某盐酸密度为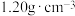 ,质量分数为36.5%,此盐酸物质的量浓度为 ,质量分数为36.5%,此盐酸物质的量浓度为 |
| C.将30%的氨水和10%的氨水等体积混合后,所得溶液的质量分数小于20%(已知氨水的浓度越大,其密度越小) |
D.100g浓度为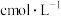 的硫酸中加入一定的水稀释成 的硫酸中加入一定的水稀释成 ,则加入水的体积大于100mL(已知硫酸的浓度越大,其密度越大) ,则加入水的体积大于100mL(已知硫酸的浓度越大,其密度越大) |
您最近一年使用:0次
2022-11-30更新
|
482次组卷
|
4卷引用:黑龙江省哈尔滨市第三中学2022-2023学年高一上学期第二次阶段性考试化学试题



