名校
1 . Ⅰ.完成下列问题
(1)市售浓盐酸的密度为1.180 g/mL,物质的量浓度为 11.64 mol/L,此浓盐酸的质量分数为_______ ;若将100g此盐酸加水稀释至5.82mol/L,则加入水的质量_______ 100g。(填“大于”、“等于”或“小于”);
Ⅱ.某同学在实验室中用此浓盐酸与MnO2为原料制取纯净干燥的Cl2,装置如下图:
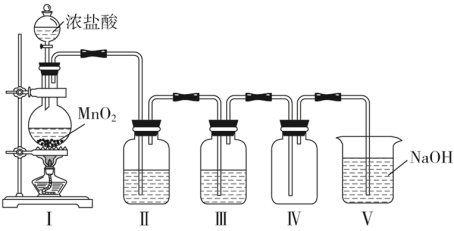
(2)装置Ⅰ中盛装浓盐酸的仪器名称为_______ ;圆底烧瓶中发生反应的离子方程式为_______ ;此反应中HCl体现出性质有_______ 和 _______ 。若生成标准状况下22.4L Cl2,被氧化的HCl分子数是_______ 。
(3)Ⅱ和Ⅲ中盛装的试剂分别是_______ 和_______ 。
(4)氯气的水溶液为氯水,Cl2与H2O反应的离子方程式为_______ ;
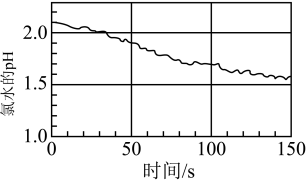
(5)如图是数字化实验得到的光照过程中氯水的pH变化情况。对此,下列有关说法正确的是_______
(6)装置Ⅴ中NaOH溶液的作用是吸收尾气,其中发生反应的化学方程式为 _______ 。
(1)市售浓盐酸的密度为1.180 g/mL,物质的量浓度为 11.64 mol/L,此浓盐酸的质量分数为
Ⅱ.某同学在实验室中用此浓盐酸与MnO2为原料制取纯净干燥的Cl2,装置如下图:

(2)装置Ⅰ中盛装浓盐酸的仪器名称为
(3)Ⅱ和Ⅲ中盛装的试剂分别是
(4)氯气的水溶液为氯水,Cl2与H2O反应的离子方程式为
(5)如图是数字化实验得到的光照过程中氯水的pH变化情况。对此,下列有关说法正确的是_______

| A.光照使氯水中的次氯酸分解为盐酸,溶液的酸性增强 |
| B.随着对氯水光照时间的延长,氯水的漂白性将增强 |
| C.随着对氯水光照时间的延长,溶液中Cl-的浓度不断减小 |
| D.随着对氯水光照时间的延长,氯水颜色逐渐变浅 |
您最近一年使用:0次
名校
2 . 填空。
(1)工业上用_______ 和_______ 作为原料来制取漂白粉,反应的化学方程式为_______ 。漂白粉的有效成分是_______ ,漂白粉溶于水后,滴加少量盐酸可加快漂白和杀菌的速度,此过程中发生反应的化学方程式_______ 。
(2)从200 mL、5 mol/L Na2CO3溶液中取出20 mL溶液,其溶质的物质的量是_______ 。将取出的溶液稀释至100 mL,其Na+的物质的量浓度是_______ 。
(3)有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.2 mol/L, 的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为_______ 。
(4)在标准状况下,CO和CO2的混合气体共11.2 L,质量为18.8 g,其中含有_______ 个CO分子,该混合气体中CO与CO2的密度之比为_______ 。
(1)工业上用
(2)从200 mL、5 mol/L Na2CO3溶液中取出20 mL溶液,其溶质的物质的量是
(3)有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.2 mol/L,
 的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为
的物质的量浓度为0.5 mol/L,则此溶液中K+的物质的量浓度为(4)在标准状况下,CO和CO2的混合气体共11.2 L,质量为18.8 g,其中含有
您最近一年使用:0次
名校
3 . 某小组设计如下实验研究实验室中的甲酸。已知:25℃时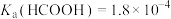
(1)配制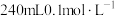 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为_______ mL。
(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴_______ 溶液,用 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是_______ (填字母)。
A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
(4)小组同学用_______ 测出25℃时该甲酸溶液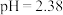 ,则水电离产生的
,则水电离产生的 数量级为
数量级为_______ 。
(5)25℃时甲酸与醋酸钠溶液反应: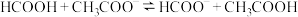 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数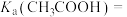
_______ 。
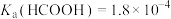
(1)配制
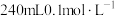 的HCOOH溶液,需
的HCOOH溶液,需 的HCOOH溶液的体积为
的HCOOH溶液的体积为(2)为确定甲酸溶液的准确浓度,取20mL甲酸溶液于锥形瓶中,加入2滴
 的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是
的NaOH溶液滴定至终点,消耗NaOH溶液的体积为22.04mL,滴定实验中所使用的锥形瓶的容积最恰当的是A.50mL B.100mL C.200mL D.250mL
(3)下列关于滴定操作的说法正确的_______
| A.滴定前应检查滴定管是否漏水,进行洗涤、润洗 |
| B.将标准溶液装入滴定管时,应借助玻璃棒或漏斗等玻璃仪器转移 |
| C.进行滴定操作时,眼睛要始终注视着滴定管内液面的变化 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
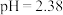 ,则水电离产生的
,则水电离产生的 数量级为
数量级为(5)25℃时甲酸与醋酸钠溶液反应:
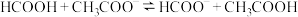 ,该反应的平衡常数为10,则该温度下醋酸的电离常数
,该反应的平衡常数为10,则该温度下醋酸的电离常数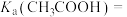
您最近一年使用:0次
2022-11-12更新
|
230次组卷
|
2卷引用:湖北省荆、荆、襄、宜四地七校考试联盟2022-2023学年高二上学期期中联考化学试题
22-23高一上·全国·课时练习
解题方法
4 . 配制步骤
(1)配制100 mL 1.00 mol·L-1氯化钠溶液
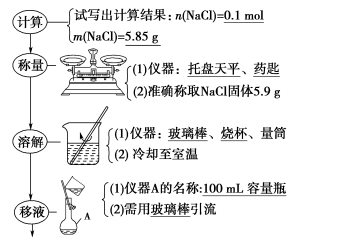
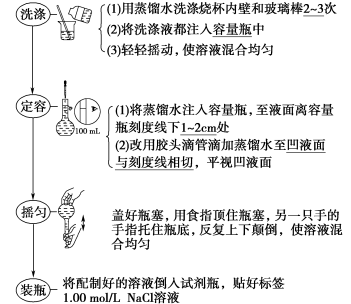
(2)用浓溶液稀释配制稀溶液
浓溶液稀释前后,溶液中溶质的物质的量不变,即得等式为:_______ 。
(3)注意事项:
①回答仪器应注明容量瓶规格,如500ml容量瓶。
②混合溶液不能直接体积相加和。
(1)配制100 mL 1.00 mol·L-1氯化钠溶液


(2)用浓溶液稀释配制稀溶液
浓溶液稀释前后,溶液中溶质的物质的量不变,即得等式为:
(3)注意事项:
①回答仪器应注明容量瓶规格,如500ml容量瓶。
②混合溶液不能直接体积相加和。
您最近一年使用:0次
解题方法
5 . 实验室用14mol/L浓硫酸配制90mL 2.0 mol/L稀硫酸。
(1)量筒量取浓硫酸的体积约是_______ mL。
(2)选用容量瓶的规格是_______(填字母)。
(3)除了上题的容量瓶外,该实验还需要的玻璃仪器有量筒、烧杯、_____ 。
(4)容量瓶上标有_______(填字母,下同)。
①温度 ②浓度 ③容积 ④压强 ⑤刻度线
(5)下列操作会导致所得溶液浓度偏低的是_______。
(1)量筒量取浓硫酸的体积约是
(2)选用容量瓶的规格是_______(填字母)。
| A.50 mL | B.100 mL | C.250 mL | D.500 mL |
(4)容量瓶上标有_______(填字母,下同)。
①温度 ②浓度 ③容积 ④压强 ⑤刻度线
| A.①③⑤ | B.①③④ | C.②④ | D.②④⑤ |
| A.配制中未用蒸馏水洗涤烧杯和玻璃棒 |
| B.定容时俯视容量瓶刻度线 |
| C.稀释后未冷却至室温即转移至容量瓶 |
| D.摇匀后发现液面低于刻度线再加水 |
您最近一年使用:0次
22-23高一上·全国·课时练习
解题方法
6 . 关于溶液稀释,下列说法正确的是
| A.稀释过程中,离子的浓度不变 | B.稀释过程中,溶液的物质的量不变 |
| C.稀释过程中,溶质的质量及物质的量不变 | D.稀释过程中,溶液的密度不变 |
您最近一年使用:0次
7 . 硫酸铁是水处理行业用作净水的混凝剂和污泥的处理剂,广泛用于水的处理。一种以黄铁矿烧渣(主要成分为 、
、 ,
, 等)为原料制取硫酸铁晶体的工艺流程如下:
等)为原料制取硫酸铁晶体的工艺流程如下:
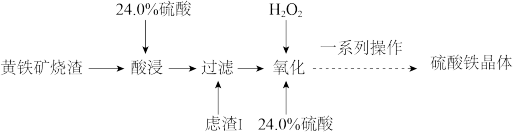
回答下列问题:
(1)“酸浸”前将黄铁矿烧渣粉碎的目的是___________ 。
(2)已知: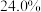 硫酸的密度
硫酸的密度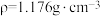 ,则
,则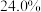 硫酸的物质的量浓度为
硫酸的物质的量浓度为___________ ;若实验室用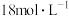 的浓硫酸配制
的浓硫酸配制 硫酸,则需用量筒量
硫酸,则需用量筒量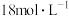 的浓硫酸的体积为
的浓硫酸的体积为___________  。
。
(3)在实验操作中常需要在加入 之前,对过滤后的滤液进行取样分析,取样分析的目的是
之前,对过滤后的滤液进行取样分析,取样分析的目的是___________ 。
(4)“酸浸”后过滤所得滤液中所含的阳离子有___________ (填离子符号)。
(5)“氧化”过程发生的反应的离子方程式为___________ ;“氧化”时可用硝酸代替氧化剂 ,优点是原料成本低,缺点是
,优点是原料成本低,缺点是___________ 。
(6)从“氧化”后的溶液中获得硫酸铁晶体,需经“一系列操作”,则“一系列操作”为___________ 、过滤洗涤、烘干。
 、
、 ,
, 等)为原料制取硫酸铁晶体的工艺流程如下:
等)为原料制取硫酸铁晶体的工艺流程如下:
回答下列问题:
(1)“酸浸”前将黄铁矿烧渣粉碎的目的是
(2)已知:
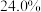 硫酸的密度
硫酸的密度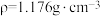 ,则
,则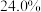 硫酸的物质的量浓度为
硫酸的物质的量浓度为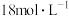 的浓硫酸配制
的浓硫酸配制 硫酸,则需用量筒量
硫酸,则需用量筒量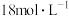 的浓硫酸的体积为
的浓硫酸的体积为 。
。(3)在实验操作中常需要在加入
 之前,对过滤后的滤液进行取样分析,取样分析的目的是
之前,对过滤后的滤液进行取样分析,取样分析的目的是(4)“酸浸”后过滤所得滤液中所含的阳离子有
(5)“氧化”过程发生的反应的离子方程式为
 ,优点是原料成本低,缺点是
,优点是原料成本低,缺点是(6)从“氧化”后的溶液中获得硫酸铁晶体,需经“一系列操作”,则“一系列操作”为
您最近一年使用:0次
21-22高一·全国·假期作业
解题方法
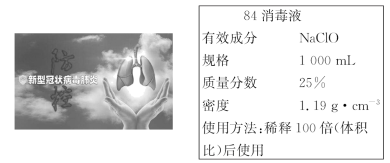
8 . 2020年,全球爆发的新型冠状病毒肺炎疫情严重影响人们的身体健康。“84消毒液”能有效杀灭各种细菌和病毒,某同学购买了一瓶某品牌的“84消毒液”,其瓶体上的消毒液说明如图:
(1)工业上制备“84消毒液”的化学方程式为____ 。
(2)该“84消毒液”中的NaClO的物质的量浓度为____ 。
(3)该同学取100mL“84消毒液”稀释后用于消毒,稀释后的溶液的物质的量浓度_____ 。

(1)工业上制备“84消毒液”的化学方程式为
(2)该“84消毒液”中的NaClO的物质的量浓度为
(3)该同学取100mL“84消毒液”稀释后用于消毒,稀释后的溶液的物质的量浓度
您最近一年使用:0次
名校
9 . 溶液的配制过程能引起浓度偏低的是
①用1g的饱和氨水加5g水配成1:5(体积比)的稀氨水
②配制一定浓度的氢氧化钠溶液,称量10.5g 溶质固体时,10g砝码放入托盘天平左盘并移动游码至0.5刻度处进行称量(其他操作均正确)
③10%的乙醇的20%的乙醇等体积混合配制15%的乙醇溶液
④质量分数为30%和50%的两种硫酸等质量混合配成40%的硫酸
⑤在90mL水中加入18.4mol/L的硫酸10mL,配制1.84mol/L的硫酸溶液
⑥向100g浓度为cmol/L的硫酸中加入100mL水,可得浓度为c/2mol/L 的硫酸
⑦用浓硫酸配制一定浓度的稀硫酸,量取浓溶液时仰视刻度线
①用1g的饱和氨水加5g水配成1:5(体积比)的稀氨水
②配制一定浓度的氢氧化钠溶液,称量10.5g 溶质固体时,10g砝码放入托盘天平左盘并移动游码至0.5刻度处进行称量(其他操作均正确)
③10%的乙醇的20%的乙醇等体积混合配制15%的乙醇溶液
④质量分数为30%和50%的两种硫酸等质量混合配成40%的硫酸
⑤在90mL水中加入18.4mol/L的硫酸10mL,配制1.84mol/L的硫酸溶液
⑥向100g浓度为cmol/L的硫酸中加入100mL水,可得浓度为c/2mol/L 的硫酸
⑦用浓硫酸配制一定浓度的稀硫酸,量取浓溶液时仰视刻度线
| A.①③⑤⑥ | B.②③⑥ | C.①②④ | D.②⑤⑦ |
您最近一年使用:0次
名校
10 . 共和国勋章获得者钟南山院士强调,要注意疫情防控常态化,坚持做好日常消毒工作。常见的消毒剂有漂白粉、84消毒液(有效成分NaClO)、双氧水等。
Ⅰ.已知某“84消毒液”瓶体部分标签如下所示:84消毒液:(有效成分)NaClO;(规格)1000mL;(质量分数)25%;(密度)1.19g/cm3
(1)该“84消毒液”的物质的量浓度为_______  (计算结果保留两位有效数字)。
(计算结果保留两位有效数字)。
(2)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。写出反应的离子方程式:_______ ;
(3)实验室用 的浓盐酸配制
的浓盐酸配制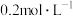 的盐酸240mL;得浓盐酸的体积为
的盐酸240mL;得浓盐酸的体积为_______ mL;使用的定量仪器有_______ 。
(4)84消毒液若与双氧水溶液混合减弱或失去杀菌消毒功能(反应产物之一是 ),解释原因
),解释原因_______ 。
Ⅱ.实验室制备84消毒液的装置如图1所示:
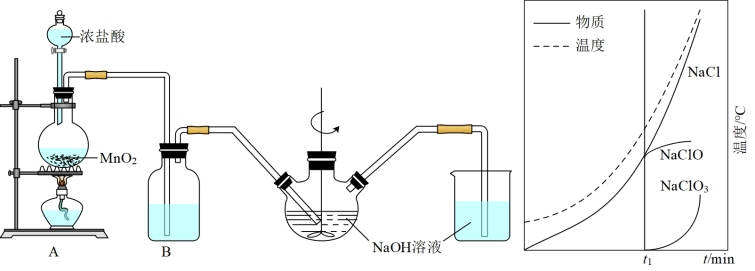
(5)装置B中盛放的试剂是_______ ;简述该装置对制取NaClO的作用_______ 。
(6)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图2所示。 分钟后所发生主要反应的化学方程式为
分钟后所发生主要反应的化学方程式为_______ 。
Ⅰ.已知某“84消毒液”瓶体部分标签如下所示:84消毒液:(有效成分)NaClO;(规格)1000mL;(质量分数)25%;(密度)1.19g/cm3
(1)该“84消毒液”的物质的量浓度为
 (计算结果保留两位有效数字)。
(计算结果保留两位有效数字)。(2)“84消毒液”与“洁厕灵”(主要成分为盐酸)一起使用反而会弄巧成拙,产生有毒的气体,造成中毒事件。写出反应的离子方程式:
(3)实验室用
 的浓盐酸配制
的浓盐酸配制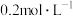 的盐酸240mL;得浓盐酸的体积为
的盐酸240mL;得浓盐酸的体积为(4)84消毒液若与双氧水溶液混合减弱或失去杀菌消毒功能(反应产物之一是
 ),解释原因
),解释原因Ⅱ.实验室制备84消毒液的装置如图1所示:

(5)装置B中盛放的试剂是
(6)三颈烧瓶中生成各物质的物质的量和溶液的温度随时间的变化如图2所示。
 分钟后所发生主要反应的化学方程式为
分钟后所发生主要反应的化学方程式为
您最近一年使用:0次



