1 . 氮及其化合物对人类生产、生活有着重要的作用。
(1) 的结构式是
的结构式是_______ 。 常用作粮食、瓜果的保护气,其主要原因是
常用作粮食、瓜果的保护气,其主要原因是_______ 。
(2)目前工业合成氨的原理是 ,该反应正反应为放热反应。下列催化剂措施中,能加快该反应的化学反应速率的是
,该反应正反应为放热反应。下列催化剂措施中,能加快该反应的化学反应速率的是_______ (填标号)。
A.其他条件不变,适当增大 的浓度
的浓度
B.其他条件不变,降低反应体系的温度
C.其他条件不变,减小反应体系的压强
D.其他条件不变,使用更高效的催化剂
(3)三元催化器是汽车排气系统重要的机外净化装置,可同时将碳氢化合物、一氧化碳和氮氧化物( )三种污染物转化为无害物质,其工作原理如下图所示。反应过程中被氧化的元素名称是
)三种污染物转化为无害物质,其工作原理如下图所示。反应过程中被氧化的元素名称是_______ 。若 为
为 ,则写出
,则写出 和
和 反应的化学方程式为
反应的化学方程式为_______ 。

(4)某汽车安全气囊的气体发生剂主要含有叠氮化钠( )、氧化铁、高氯酸钾、碳酸氢钠等物质。
)、氧化铁、高氯酸钾、碳酸氢钠等物质。
①其中叠氮化钠是气体发生剂,受撞击时产生氮气和金属钠。若该反应生成67.2L(标准状况下)氮气时,转移电子的物质的量为_______  。
。
②高氯酸钾是助氧化剂,在反应过程中与金属钠作用生成氯化钾和氧化钠。鉴别高氯酸钾中钾元素的实验操作及现象为_______ 。
(1)
 的结构式是
的结构式是 常用作粮食、瓜果的保护气,其主要原因是
常用作粮食、瓜果的保护气,其主要原因是(2)目前工业合成氨的原理是
 ,该反应正反应为放热反应。下列催化剂措施中,能加快该反应的化学反应速率的是
,该反应正反应为放热反应。下列催化剂措施中,能加快该反应的化学反应速率的是A.其他条件不变,适当增大
 的浓度
的浓度B.其他条件不变,降低反应体系的温度
C.其他条件不变,减小反应体系的压强
D.其他条件不变,使用更高效的催化剂
(3)三元催化器是汽车排气系统重要的机外净化装置,可同时将碳氢化合物、一氧化碳和氮氧化物(
 )三种污染物转化为无害物质,其工作原理如下图所示。反应过程中被氧化的元素名称是
)三种污染物转化为无害物质,其工作原理如下图所示。反应过程中被氧化的元素名称是 为
为 ,则写出
,则写出 和
和 反应的化学方程式为
反应的化学方程式为
(4)某汽车安全气囊的气体发生剂主要含有叠氮化钠(
 )、氧化铁、高氯酸钾、碳酸氢钠等物质。
)、氧化铁、高氯酸钾、碳酸氢钠等物质。①其中叠氮化钠是气体发生剂,受撞击时产生氮气和金属钠。若该反应生成67.2L(标准状况下)氮气时,转移电子的物质的量为
 。
。②高氯酸钾是助氧化剂,在反应过程中与金属钠作用生成氯化钾和氧化钠。鉴别高氯酸钾中钾元素的实验操作及现象为
您最近一年使用:0次
2021-07-21更新
|
156次组卷
|
2卷引用:河北省张家口市2020-2021学年高一下学期期末考试化学试题
2 . 近年来,有科学家提出,使用氯气消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。二氧化氯( ,是易溶于水的黄绿色气体)是高效、低毒的消毒剂。回答下列问题:
,是易溶于水的黄绿色气体)是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用 与
与 在
在 存在下制得
存在下制得 。
。
①该反应的离子方程式为___________ 。
②每生成 ,消耗还原剂的物质的量为
,消耗还原剂的物质的量为___________  ,转移的电子数为
,转移的电子数为___________  。
。
(2)实验室以 、盐酸、
、盐酸、 为原料,通过图中流程制备
为原料,通过图中流程制备 。
。

① 属于
属于___________ (填“离子化合物”或“共价化合物”), 分子内存在
分子内存在___________ (填“极性键”、“非极性键”或“极性键和非极性键”)。
②除去 中的
中的 可选用的试剂是
可选用的试剂是___________ (填标号)。
a. 固体氯化钙
b. 澄清石灰水
c. 浓硫酸
d. 饱和食盐水
③ 溶液和
溶液和 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
 ,是易溶于水的黄绿色气体)是高效、低毒的消毒剂。回答下列问题:
,是易溶于水的黄绿色气体)是高效、低毒的消毒剂。回答下列问题:(1)工业上可用
 与
与 在
在 存在下制得
存在下制得 。
。①该反应的离子方程式为
②每生成
 ,消耗还原剂的物质的量为
,消耗还原剂的物质的量为 ,转移的电子数为
,转移的电子数为 。
。(2)实验室以
 、盐酸、
、盐酸、 为原料,通过图中流程制备
为原料,通过图中流程制备 。
。
①
 属于
属于 分子内存在
分子内存在②除去
 中的
中的 可选用的试剂是
可选用的试剂是a. 固体氯化钙
b. 澄清石灰水
c. 浓硫酸
d. 饱和食盐水
③
 溶液和
溶液和 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
名校
3 . 氟气化学性质十分活泼,具有很强的氧化性,工业上氟气常用作火箭燃料的氧化剂、卤化氟的原料、冷冻剂等。已知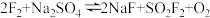 ,针对该反应的下列有关说法正确的有
,针对该反应的下列有关说法正确的有
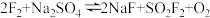 ,针对该反应的下列有关说法正确的有
,针对该反应的下列有关说法正确的有A. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
B. 的氧化性强于 的氧化性强于 |
| C.生成42gNaF时,该反应转移1mol电子 |
| D.反应中既有极性键、非极性键的断裂,又有极性键、非极性键的形成 |
您最近一年使用:0次
2021-07-13更新
|
363次组卷
|
4卷引用:河北省廊坊市第一中学2022~2023 学年高一上学期期末考试化学试题
解题方法
4 . 硫元素的价类二维图如图所示。
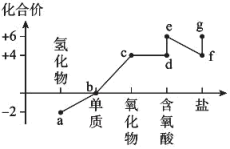
下列说法正确的是

下列说法正确的是
A.a在水溶液中的电离方程式为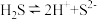 |
| B.b只有一种分子,不存在同素异形体 |
| C.d、e均属于二元强酸 |
| D.a与c、d、e都有可能反应生成b |
您最近一年使用:0次
2021-07-13更新
|
411次组卷
|
2卷引用:河北省藁城新冀明中学2021-2022学年高三上学期第一次月考化学试题
5 . 在肉制品加工中,使用的护色剂 亚硝酸钠
亚硝酸钠 必须严格控制用量,以确保食用安全。已知:NaNO2+HI
必须严格控制用量,以确保食用安全。已知:NaNO2+HI NO↑+I2+NaI+H2O
NO↑+I2+NaI+H2O
(1)配平并标出电子转移的方向和数目:______  HI
HI NO↑+
NO↑+
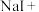

(2)该反应中的氧化剂是___________ 。
(3)若有1mol电子转移,则氧化产物的物质的量是___________ mol。
(4)若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是___________
A.亚硝酸钠是还原剂 维生素C是氧化剂
维生素C是氧化剂
C.维生素C能把铁离子还原成为亚铁离子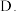 亚硝酸钠被还原
亚硝酸钠被还原
 亚硝酸钠
亚硝酸钠 必须严格控制用量,以确保食用安全。已知:NaNO2+HI
必须严格控制用量,以确保食用安全。已知:NaNO2+HI NO↑+I2+NaI+H2O
NO↑+I2+NaI+H2O(1)配平并标出电子转移的方向和数目:
 HI
HI NO↑+
NO↑+
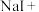

(2)该反应中的氧化剂是
(3)若有1mol电子转移,则氧化产物的物质的量是
(4)若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是
A.亚硝酸钠是还原剂
 维生素C是氧化剂
维生素C是氧化剂C.维生素C能把铁离子还原成为亚铁离子
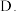 亚硝酸钠被还原
亚硝酸钠被还原
您最近一年使用:0次
6 . 硫酸锰是重要的二价锰盐,约80%的锰盐都是由它加工制得。因此,近年来由软锰矿生产硫酸锰的工艺十分活跃。软锰矿中的锰为四价态,它不溶于酸和碱,必须采用还原的方法将锰(Ⅳ)还原为锰(Ⅱ)后才能溶于硫酸溶液生成硫酸锰。某种由软锰矿(主要成分MnO2,含有MgO,Fe2O3,CaO等杂质)制备硫酸锰的工艺流程如图:
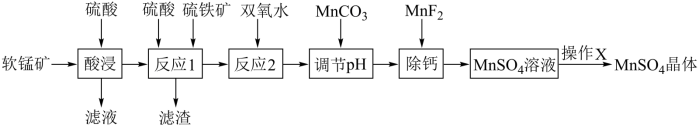
资料:
①硫铁矿主要成分FeS2,杂质不参与反应
②该工艺条件下,各金属离子开始沉淀和完全沉淀的pH如表:
③该工艺条件下,CaSO4微溶于水
(1)“酸浸”时为加快反应速率除加热外,还可采取的措施有___ 。(写一条即可)
(2)“酸浸”过程能否用浓盐酸代替硫酸?___ ,(填“能”或“否”)理由是___ 。
(3)反应1中FeS2和MnO2颗粒组成两个 原电池,如图所示:其中,MnO2原电池反应迅速,而FeS2原电池由于生成的硫覆盖在FeS2颗粒表面,溶解速率受阻变慢。

①MnO2原电池中,MnO2为原电池的___ (填“正极”或“负极”),发生的电极反应式为:___ 。
②FeS2原电池中,FeS2为原电池的___ (填“正极”或“负极”)。电极产物是__ 。
(4)加入MnCO3调节pH可以将滤液中的Fe3+转化为Fe(OH)3而除去,配平发生反应的离子方程式:___ 。
3MnCO3+2Fe3++ =3Mn2++2Fe(OH)3+
=3Mn2++2Fe(OH)3+
(5)反应1后的滤液中所含金属阳离子有Mn2+、___ 。

资料:
①硫铁矿主要成分FeS2,杂质不参与反应
②该工艺条件下,各金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe3+ | Fe2+ | Mg2+ | Mn2+ |
| 开始沉淀的pH | 2.1 | 7.5 | 9.6 | 9.3 |
| 完全沉淀的pH | 3.2 | 8.9 | 11.1 | 10.8 |
③该工艺条件下,CaSO4微溶于水
(1)“酸浸”时为加快反应速率除加热外,还可采取的措施有
(2)“酸浸”过程能否用浓盐酸代替硫酸?
(3)反应1中FeS2和MnO2颗粒组成

①MnO2原电池中,MnO2为原电池的
②FeS2原电池中,FeS2为原电池的
(4)加入MnCO3调节pH可以将滤液中的Fe3+转化为Fe(OH)3而除去,配平发生反应的离子方程式:
3MnCO3+2Fe3++
 =3Mn2++2Fe(OH)3+
=3Mn2++2Fe(OH)3+
(5)反应1后的滤液中所含金属阳离子有Mn2+、
您最近一年使用:0次
7 . 实验室中利用固体KMnO4进行如图实验,下列说法错误的是
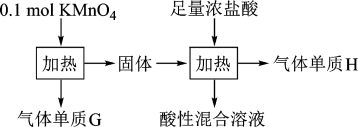

| A.G与H均为氧化产物 | B.实验中KMnO4只作氧化剂 |
| C.Mn元素至少参与了3个氧化还原反应 | D.G与H的物质的量之和可能为0.25mol |
您最近一年使用:0次
2021-06-29更新
|
8449次组卷
|
20卷引用:河北省邯郸市大名县第一中学2021-2022学年高二下学期期末考试化学试题
河北省邯郸市大名县第一中学2021-2022学年高二下学期期末考试化学试题2021年新高考山东化学高考真题山东省济宁市实验中学2022届高三上学期开学考试化学试题(已下线)专题04 氧化还原反应-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省枣庄市第三中学2022届高三第一次月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题2021年山东高考化学试题变式题11-20(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)江西省樟树航天中学高三年级2021-2022学年高三上学期10月调研考试化学试题山东省新泰市第一中学2022—2023学年高一上学期期中考试化学试题(已下线)热点情景汇编-专题三 氧化还原中的化学贵州省遵义市第一中学2022-2023学年高一上学期期中考试化学试题(已下线)专题04 氧化还原反应及其应用(讲)-2023年高考化学二轮复习讲练测(新高考专用)湖南省株洲市第二中学2023届高三上学期第二次月考化学试题(已下线)专题08 氧化还原反应方程式的书写及计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 氧化还原反应基本概念的判断(已下线)第4讲 氧化还原反应的基本概念与规律(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)
8 . X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是
A.X、Y生成H2的物质的量之比一定为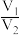 |
B.X、Y消耗酸的物质的量之比一定为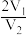 |
C.产物中X、Y化合价之比一定为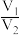 |
D.由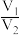 一定能确定产物中X、Y的化合价 一定能确定产物中X、Y的化合价 |
您最近一年使用:0次
2021-06-29更新
|
8206次组卷
|
27卷引用:河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题
河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题2021年新高考山东化学高考真题(已下线)课时11 物质的量、气体摩尔体积-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题02 化学计量与化学计算-备战2022年高考化学真题及地市好题专项集训【山东专用】江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题山东省烟台市第二中学2021-2022学年高一10月月考化学试题2021年山东高考化学试题变式题1-10湖北省武汉市汉阳、江夏2021-2022学年高一上学期12月联考化学试题河南省濮阳市第一高级中学2022-2023学年高三上学期第一次月考化学试题(已下线)第04讲 物质的量 气体摩尔体积 (练)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题湖南攸县长鸿实验中学2022-2023学年高三上学期第二次月考化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题(已下线)热点情景汇编-专题三 氧化还原中的化学武汉市第一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题02 阿伏加德罗常数及其化学计算 (练)-2023年高考化学二轮复习讲练测(新高考专用)江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题(已下线)第一章 物质的量 第1讲 物质的量 气体摩尔体积山东省齐鲁名师联盟2023-2024学年高三上学期第一次诊断考试化学试题(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点02 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)辽宁省沈阳市五校协作体2023-2024学年高一上学期11月期中考试化学试题(已下线)题型01 以物质的量为中心的计算-【好题汇编】备战2023-2024学年高一化学期末真题分类汇编(江苏专用)(已下线)第01讲 物质的量 气体摩尔体积(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
9 . 在一些特定的条件下,铁也可以生成具有保护作用的氧化膜。例如,铁在浓硝酸、浓硫酸中可以生成氧化膜(称为钝化膜),在碱性溶液中也易被一些并不强的氧化剂氧化生成钝化膜。拿一把已除锈、去油的小刀放入发蓝液(50 g氢氧化钠、10 g硝酸钠、3 g亚硝酸钠和100 mL水所形成的溶液)中,加热煮沸20 min,就可形成蓝黑色的“烤蓝”。根据上面的信息判断下列叙述不正确的是
| A.在烤蓝的过程中,铁没有损失 |
| B.烤蓝实质是一部分铁被氧化成致密的氧化膜,起到了抗腐蚀作用 |
| C.在“烤蓝”液中硝酸钠、亚硝酸钠起了氧化剂作用 |
| D.在烤蓝前除锈可以使用盐酸 |
您最近一年使用:0次
名校
解题方法
10 . 化学与人类的生活有着密切联系,下列过程涉及氧化还原反应的是
| A.SO2漂白的纸张易变黄 | B.长江入海口沙洲的形成 |
| C.苹果汁中加入维生素C可防止苹果汁变黄 | D.紫甘蓝汁中加入食醋会变为红色 |
您最近一年使用:0次
2021-06-19更新
|
575次组卷
|
4卷引用:河北省新乐市第一中学2021-2022学年高一上学期第一次月考化学试题



